© Tim Dosen Biokimia (Biologi, FMIPA, Universitas Negeri Surabaya)
2 Syarah (Penjelasan) Slide ke-1 (Cover)
Slide ini merupakan halaman judul dari presentasi yang berjudul "Asam Amino dan Protein", yang disusun oleh Tim Biokimia, Jurusan Biologi, Universitas Negeri Surabaya (Unesa) pada tahun 2008.
Syarah PPT:
Judul ini menunjukkan bahwa materi yang akan dibahas dalam slide ini berfokus pada asam amino dan protein, dua komponen fundamental dalam biokimia dan biologi molekuler. Asam amino merupakan monomer (unit dasar) dari protein, sedangkan protein adalah makromolekul biologis yang berperan dalam berbagai fungsi seluler. Keberadaan tim penyusun dari Jurusan Biologi Unesa mengindikasikan bahwa materi ini disusun dengan pendekatan akademik berbasis ilmu biologi, dengan kemungkinan cakupan meliputi struktur, klasifikasi, sintesis, degradasi, serta fungsi biologis asam amino dan protein.
Karena presentasi ini dibuat pada tahun 2008, kemungkinan ada beberapa informasi yang dapat diperbarui berdasarkan penelitian terbaru dalam biokimia. Jika di dalam slide berikutnya terdapat konsep-konsep yang memerlukan pembaruan atau klarifikasi berdasarkan sumber terbaru, maka akan diberikan anotasi yang sesuai.
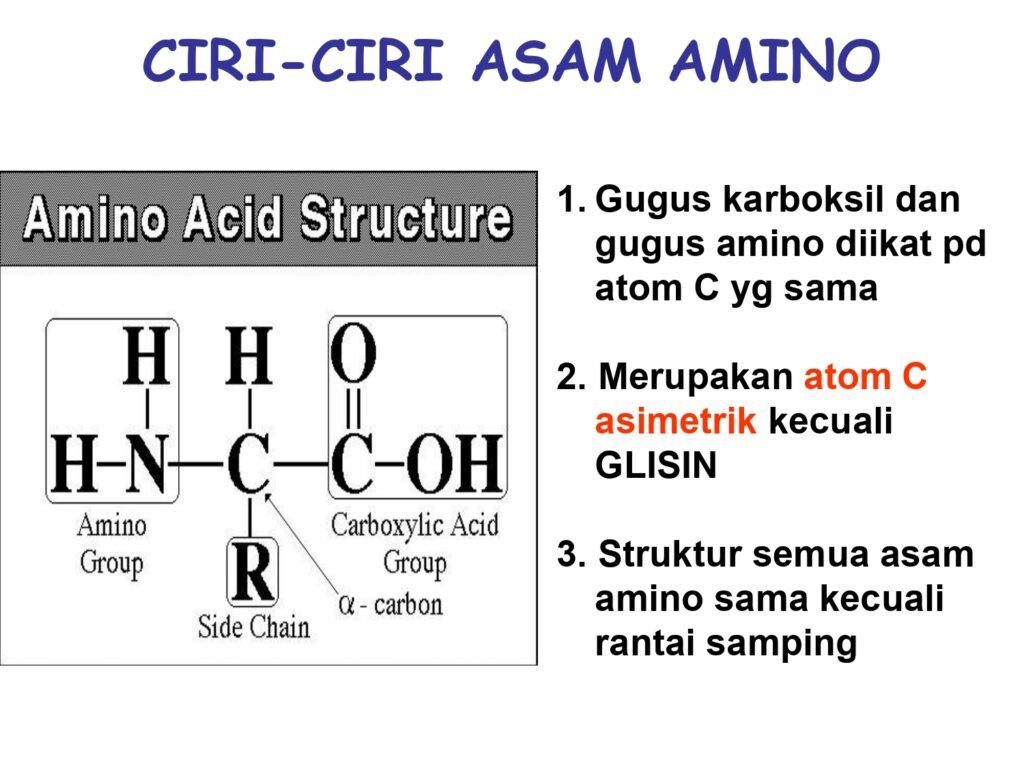
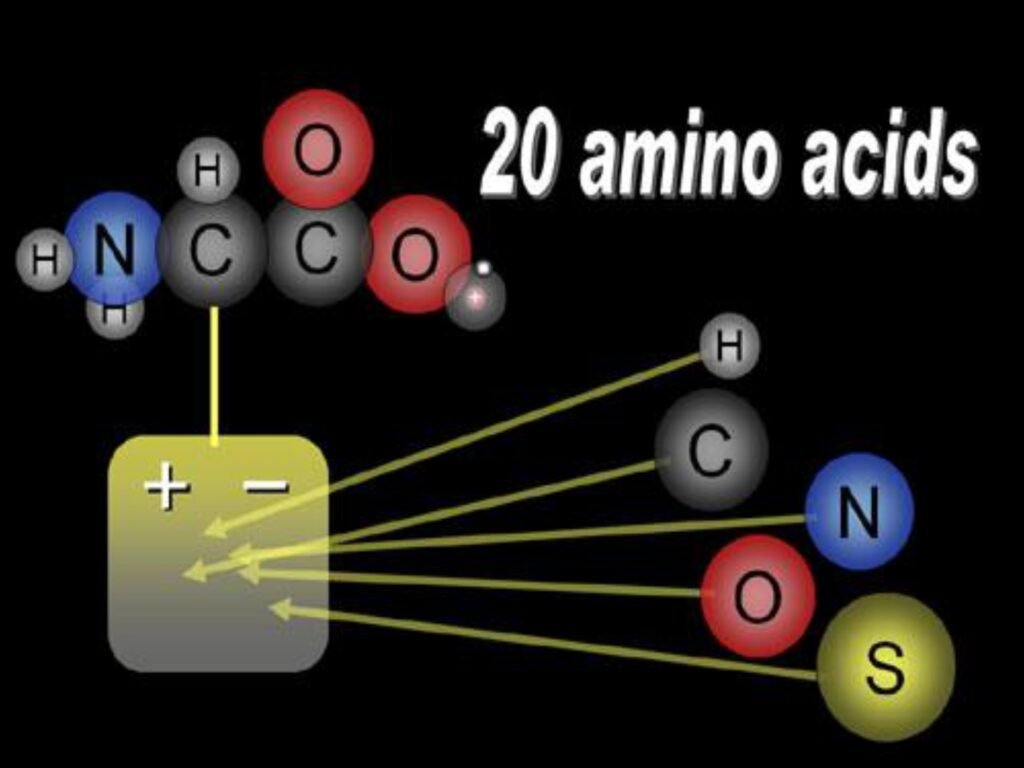
4 Syarah (Penjelasan) Slide ke-2
Slide ini menjelaskan karakteristik umum asam amino dengan tiga poin utama. Berikut adalah penjelasan lebih mendalam untuk setiap pernyataan:
-
"Gugus karboksil dan gugus amino diikat pada atom C yang sama."
Asam amino merupakan molekul organik yang memiliki gugus karboksil (-COOH) dan gugus amino (-NH₂) yang terikat pada atom karbon yang sama, yaitu karbon alfa (Cα). Karbon ini juga mengikat atom hidrogen dan rantai samping spesifik yang disebut residu R (side chain). Struktur ini menjadikan asam amino sebagai zat amfoter, artinya dapat bertindak sebagai asam atau basa tergantung pada kondisi lingkungannya. -
"Merupakan atom C asimetrik kecuali GLISIN."
Dalam kimia organik, atom karbon disebut asimetrik (chiral) jika memiliki empat gugus yang berbeda yang terikat padanya. Hampir semua asam amino memiliki karbon alfa sebagai pusat kiral, yang menyebabkan keberadaan dua bentuk enansiomer (L dan D). Namun, glisin adalah pengecualian karena gugus R-nya berupa atom hidrogen (H), sehingga karbon alfa mengikat dua gugus yang sama (dua hidrogen), membuatnya tidak asimetrik (akiral). Oleh karena itu, glisin tidak memiliki bentuk enansiomer seperti asam amino lainnya. -
"Struktur semua asam amino sama kecuali rantai samping."
Semua asam amino memiliki inti struktur yang sama, yaitu karbon alfa yang mengikat gugus amino, gugus karboksil, dan atom hidrogen. Yang membedakan satu asam amino dengan yang lain adalah rantai samping (gugus R), yang dapat bersifat hidrofobik, hidrofilik, bermuatan positif atau negatif, dan memiliki berbagai ukuran serta kompleksitas kimiawi. Rantai samping inilah yang menentukan sifat fisikokimia dan fungsi biologis dari masing-masing asam amino dalam protein.
Jika ada tambahan konsep dari referensi terbaru, misalnya mengenai modifikasi asam amino dalam proses pasca-translasi atau peran gugus R dalam interaksi protein, maka akan diberikan anotasi pada slide yang relevan.
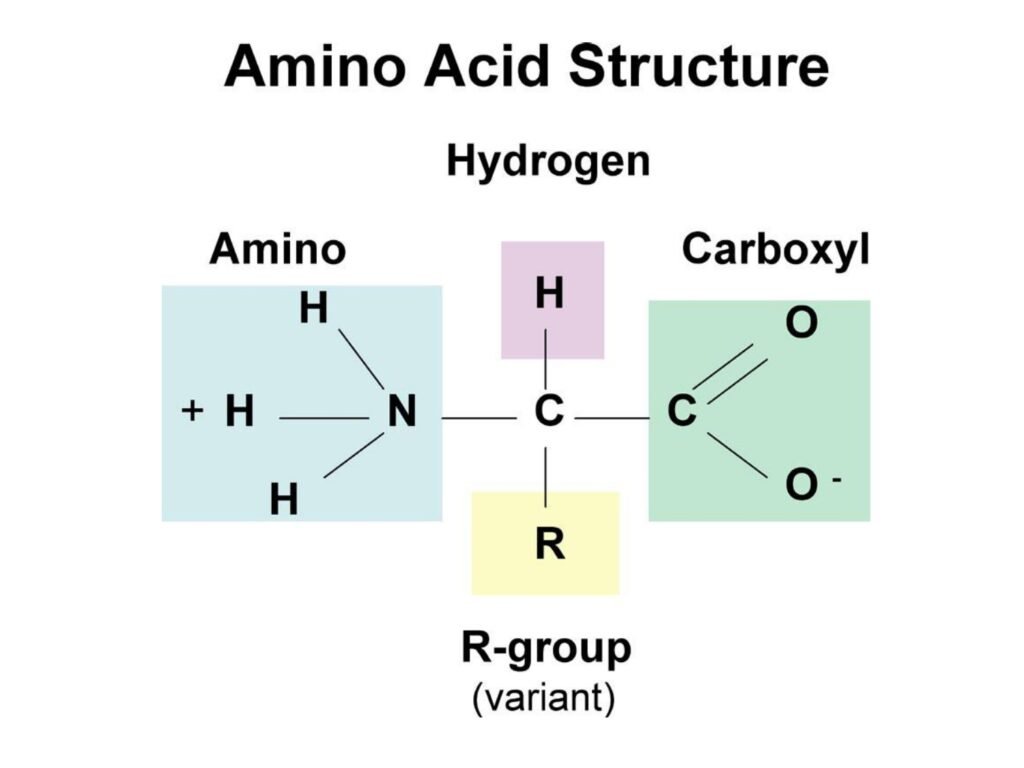
6 Syarah (Penjelasan) Slide ke-3
Slide ini berjudul "Amino Acid Structure" yang berarti "Struktur Asam Amino" dan menggambarkan susunan molekul asam amino secara umum.
-
Terjemahan per kata/frasa dalam diagram:
-
Amino Acid Structure → Struktur Asam Amino
-
Hydrogen → Hidrogen
-
Amino → Amino
-
Carboxyl → Karboksil
-
R-group (variant) → Gugus R (varian)
-
-
Penjelasan Struktur Asam Amino:
Asam amino merupakan blok pembangun utama protein yang memiliki struktur dasar yang sama, terdiri dari empat gugus utama yang terikat pada karbon pusat (Cα):-
Gugus amino (-NH₂): Bersifat basa dan dapat menerima ion hidrogen (proton), berperan dalam reaksi pembentukan ikatan peptida.
-
Gugus karboksil (-COOH): Bersifat asam dan dapat melepaskan proton, berkontribusi dalam pembentukan struktur protein.
-
Atom hidrogen (H): Salah satu dari empat gugus yang terikat pada karbon alfa, tidak memiliki perbedaan struktural antar asam amino.
-
Gugus R (side chain): Merupakan bagian yang paling bervariasi di antara 20 asam amino alami. Gugus ini menentukan sifat kimia dan fungsi biologis dari setiap asam amino.
-
-
Signifikansi Biologis dari Struktur Ini:
-
Keempat gugus tersebut menentukan sifat amfoter asam amino, yang berarti dapat bertindak sebagai asam atau basa tergantung pada pH lingkungan.
-
Struktur ini juga memungkinkan asam amino untuk mengalami isomerisasi optik, menghasilkan bentuk L- dan D- enansiomer, meskipun dalam sistem biologis, hampir semua asam amino dalam protein berada dalam bentuk L-amino acid.
-
Gugus R memiliki beragam sifat, seperti hidrofobik, hidrofilik, bermuatan positif atau negatif, yang memengaruhi struktur dan fungsi protein yang dibentuknya.
-
Diagram ini juga menunjukkan struktur ionik asam amino dalam kondisi fisiologis, di mana gugus amino bermuatan positif (+) dan gugus karboksil bermuatan negatif (-), membentuk zwitterion, yaitu bentuk molekul yang memiliki muatan positif dan negatif tetapi tetap bersifat netral secara keseluruhan.
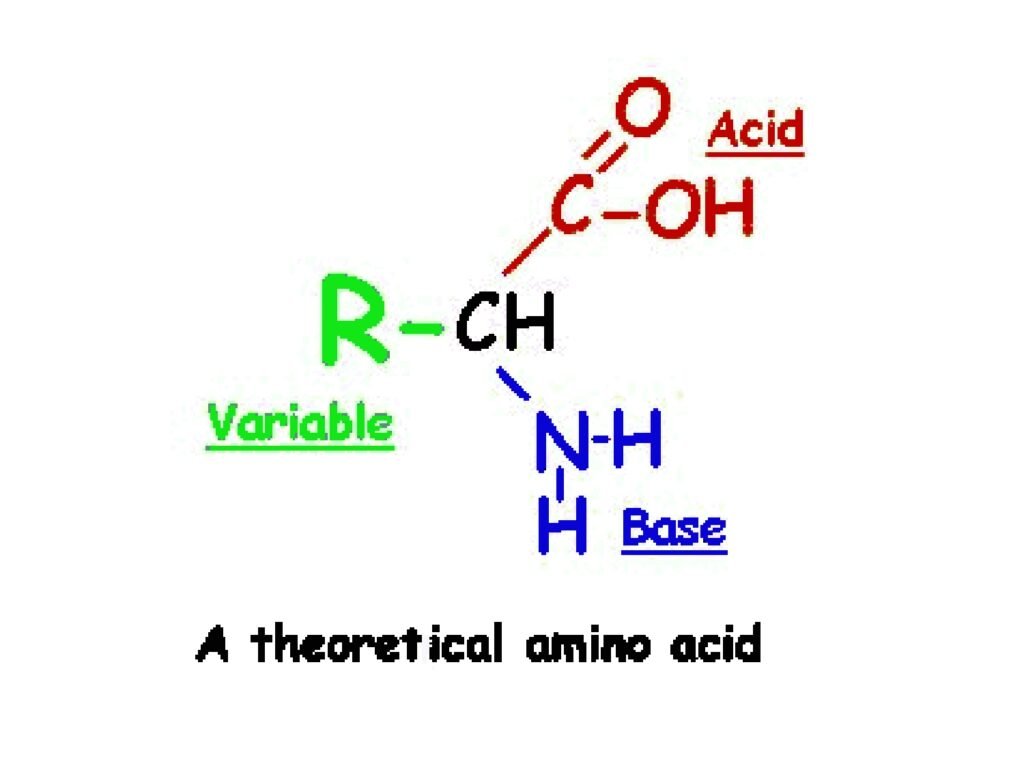
8 Syarah (Penjelasan) Slide ke-4
Slide ini berjudul "A theoretical amino acid", yang berarti "Asam amino teoretis". Diagram pada slide ini menggambarkan susunan dasar dari molekul asam amino dan membedakan bagian-bagian utamanya dengan warna berbeda.
-
Terjemahan per kata/frasa dalam diagram:
-
Acid → Asam
-
Base → Basa
-
Variable → Variabel
-
A theoretical amino acid → Sebuah asam amino teoretis
-
-
Penjelasan Struktur Molekul:
Diagram ini menggambarkan kerangka dasar asam amino, yang terdiri dari:-
Gugus karboksil (-COOH) (merah, diberi label "Acid")
Gugus ini bersifat asam, karena dapat melepaskan ion hidrogen (H⁺) dalam larutan, yang berkontribusi pada reaktivitas asam amino dalam pembentukan ikatan peptida. -
Gugus amino (-NH₂) (biru, diberi label "Base")
Gugus ini bersifat basa, karena dapat menerima ion hidrogen (H⁺), sehingga berperan dalam menyeimbangkan pH dan pembentukan ikatan hidrogen dalam protein. -
Atom karbon alfa (C)
Atom karbon ini adalah pusat dari asam amino, mengikat gugus amino, gugus karboksil, satu atom hidrogen, dan gugus R yang bervariasi di setiap asam amino. -
Gugus R (hijau, diberi label "Variable")
Gugus R adalah bagian yang menentukan identitas asam amino. Setiap asam amino memiliki gugus R yang unik, yang dapat bersifat hidrofobik, hidrofilik, bermuatan positif atau negatif.
-
-
Makna "Asam Amino Teoretis":
Istilah "theoretical amino acid" dalam slide ini mengacu pada representasi umum dari struktur asam amino tanpa menunjukkan jenis asam amino tertentu. Dalam kenyataannya, ada 20 asam amino esensial dalam sistem biologis yang memiliki gugus R berbeda dan menentukan karakteristik uniknya dalam membentuk protein. -
Signifikansi dalam Biokimia:
-
Karena memiliki gugus asam dan basa dalam satu molekul, asam amino adalah molekul amfoter, yang dapat bertindak sebagai asam maupun basa tergantung pada pH lingkungan.
-
Pada pH fisiologis (~7,4), asam amino biasanya berada dalam bentuk zwitterion, di mana gugus amino bermuatan positif (+NH₃⁺) dan gugus karboksil bermuatan negatif (-COO⁻).
-
Bentuk ini memungkinkan pembentukan ikatan peptida dalam sintesis protein, yang terjadi melalui reaksi kondensasi antara gugus karboksil satu asam amino dengan gugus amino dari asam amino lain.
-
Struktur ini merupakan dasar dari semua kehidupan, karena protein yang disusun dari asam amino memainkan peran krusial dalam hampir semua fungsi biologis, seperti enzim, hormon, struktur sel, dan transportasi molekul.
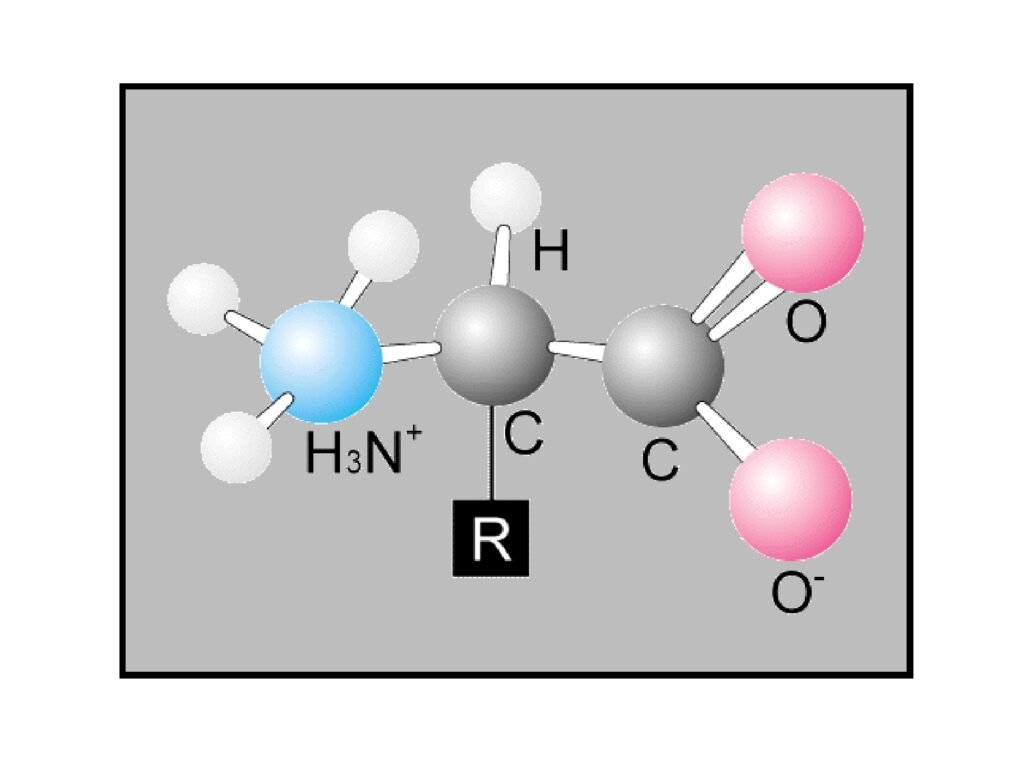
10 Syarah (Penjelasan) Slide ke-5
Slide ini menampilkan model tiga dimensi dari struktur asam amino dalam kondisi fisiologis. Model ini menunjukkan bentuk zwitterion, yaitu keadaan asam amino di mana gugus amino dan gugus karboksil bermuatan listrik namun secara keseluruhan tetap netral.
-
Komponen Struktur dalam Model:
-
Gugus Amino (H₃N⁺) (berwarna biru):
Gugus ini bersifat basa, dapat menerima ion hidrogen (H⁺), dan dalam kondisi fisiologis (pH ~7,4), gugus ini mengalami protonasi menjadi H₃N⁺, memberikan muatan positif pada molekul. -
Gugus Karboksil (-COO⁻) (berwarna merah muda):
Gugus ini bersifat asam, melepaskan ion hidrogen (H⁺) dalam larutan, sehingga berada dalam bentuk terdeprotonasi (-COO⁻) pada pH fisiologis, memberikan muatan negatif pada molekul. -
Karbon Alfa (C):
Karbon pusat yang mengikat gugus amino, gugus karboksil, atom hidrogen, dan gugus R (rantai samping yang menentukan jenis asam amino). -
Gugus R (berlabel R dalam kotak hitam):
Bagian yang menentukan sifat unik dari masing-masing asam amino. Gugus ini bisa bersifat hidrofobik, hidrofilik, bermuatan positif atau negatif, yang mempengaruhi peran asam amino dalam struktur protein.
-
-
Bentuk Zwitterion:
Pada pH fisiologis (sekitar 7,4), asam amino berada dalam bentuk zwitterion, yaitu keadaan di mana molekul memiliki muatan positif (+) pada gugus amino dan muatan negatif (-) pada gugus karboksil. Meskipun memiliki dua muatan, total muatan keseluruhan tetap netral. -
Signifikansi dalam Biokimia:
-
Keadaan zwitterion memungkinkan asam amino untuk berfungsi sebagai buffer, menjaga keseimbangan pH dalam sistem biologis.
-
Dalam kondisi pH lebih rendah (asam), gugus karboksil akan terprotonasi (-COOH), sehingga molekul memiliki muatan positif secara keseluruhan.
-
Dalam kondisi pH lebih tinggi (basa), gugus amino akan terdeprotonasi (-NH₂), menyebabkan molekul memiliki muatan negatif secara keseluruhan.
-
Bentuk ini sangat penting dalam pembentukan ikatan peptida, di mana gugus karboksil satu asam amino bereaksi dengan gugus amino dari asam amino lain melalui reaksi kondensasi, membentuk protein.
-
Gambar ini merepresentasikan konsep dasar dalam biokimia struktural, menunjukkan bagaimana asam amino berperilaku dalam lingkungan fisiologis dan bagaimana interaksi kimianya memungkinkan penyusunan struktur protein yang lebih kompleks.
12 Syarah (Penjelasan) Slide ke-6
Slide ini merupakan judul bagian yang akan membahas klasifikasi asam amino berdasarkan gugus R. Gugus R (side chain) adalah bagian dari asam amino yang berbeda-beda di antara 20 asam amino standar dan menentukan sifat kimia serta fungsinya dalam protein.
-
Pentingnya Gugus R dalam Klasifikasi Asam Amino:
Gugus R menentukan apakah suatu asam amino bersifat hidrofobik, hidrofilik, bermuatan positif, atau bermuatan negatif, yang berpengaruh pada interaksi antar asam amino dalam struktur protein. Karena itu, klasifikasi asam amino umumnya berdasarkan sifat gugus R-nya. -
Kategori Umum dalam Klasifikasi Asam Amino Berdasarkan Gugus R:
a. Asam Amino Nonpolar (Hidrofobik):-
Gugus R bersifat nonpolar dan cenderung tidak larut dalam air.
-
Contoh: Glycine (Gly), Alanine (Ala), Valine (Val), Leucine (Leu), Isoleucine (Ile), Methionine (Met), Phenylalanine (Phe), Tryptophan (Trp), Proline (Pro).
b. Asam Amino Polar Tidak Bermuatan: -
Gugus R memiliki gugus polar tetapi tidak memiliki muatan listrik pada pH fisiologis.
-
Contoh: Serine (Ser), Threonine (Thr), Asparagine (Asn), Glutamine (Gln), Cysteine (Cys), Tyrosine (Tyr).
c. Asam Amino Bermuatan Positif (Basa): -
Gugus R mengandung gugus amina yang bisa menangkap proton, sehingga bermuatan positif pada pH fisiologis.
-
Contoh: Lysine (Lys), Arginine (Arg), Histidine (His).
d. Asam Amino Bermuatan Negatif (Asam): -
Gugus R mengandung gugus karboksil yang bisa melepaskan proton, sehingga bermuatan negatif pada pH fisiologis.
-
Contoh: Aspartate (Asp), Glutamate (Glu).
-
-
Signifikansi dalam Biologi dan Struktur Protein:
-
Klasifikasi ini sangat penting dalam memahami bagaimana protein melipat dan berfungsi, karena interaksi antar gugus R berkontribusi dalam pembentukan struktur primer, sekunder, tersier, dan kuartener dari protein.
-
Asam amino dengan gugus hidrofobik cenderung ditemukan di bagian dalam protein globular, sedangkan asam amino dengan gugus polar atau bermuatan sering berada di permukaan protein yang berinteraksi dengan air atau lingkungan sekitarnya.
-
Slide ini menjadi pengantar untuk bagian selanjutnya yang akan membahas masing-masing kelompok asam amino secara lebih detail.
14 Syarah (Penjelasan) Slide ke-7
Slide ini menampilkan konsep 20 asam amino yang menjadi penyusun utama protein dalam sistem biologis. Diagram tersebut menunjukkan kerangka dasar asam amino dan menghubungkannya dengan berbagai unsur kimia yang membentuk gugus R.
-
Terjemahan per kata/frasa dalam diagram:
-
20 amino acids → 20 asam amino
-
-
Komponen Struktur dalam Diagram:
-
Bagian utama asam amino:
Diagram ini menunjukkan kerangka dasar asam amino, yang terdiri dari gugus amino (-NH₃⁺, berwarna biru), karbon alfa (C), gugus karboksil (-COO⁻, berwarna merah), dan atom hidrogen (H). -
Hubungan dengan berbagai unsur kimia:
Terdapat beberapa unsur yang ditampilkan dalam diagram ini yang terkait dengan keragaman gugus R (side chain) dari 20 asam amino. Unsur-unsur tersebut meliputi:-
Karbon (C, hitam) – merupakan rangka utama dalam semua gugus R.
-
Hidrogen (H, abu-abu kecil) – banyak ditemukan dalam berbagai jenis rantai samping.
-
Nitrogen (N, biru) – terdapat dalam beberapa gugus R, terutama pada asam amino dengan sifat basa seperti arginine, lysine, dan histidine.
-
Oksigen (O, merah) – terdapat dalam asam amino dengan gugus karboksil tambahan seperti aspartate dan glutamate, yang bersifat asam.
-
Sulfur (S, kuning) – terdapat dalam asam amino methionine dan cysteine, yang berperan penting dalam pembentukan ikatan disulfida untuk stabilisasi struktur protein.
-
-
-
Makna dari Diagram ini dalam Konteks Biokimia:
-
Keanekaragaman 20 asam amino berasal dari gugus R yang berbeda-beda, yang memungkinkan protein memiliki berbagai struktur dan fungsi dalam sistem biologis.
-
Interaksi antara gugus R menentukan bagaimana protein melipat, berinteraksi, dan menjalankan fungsinya dalam sel.
-
Asam amino dengan sulfur (S), nitrogen (N), dan oksigen (O) dalam gugus R berperan dalam ikatan hidrogen, ikatan ionik, serta pembentukan jembatan disulfida, yang sangat penting dalam stabilitas dan aktivitas enzim serta protein struktural.
-
-
Signifikansi Biologis:
-
Semua organisme hidup menggunakan kombinasi dari 20 asam amino standar untuk menyusun protein melalui kode genetik universal.
-
Protein yang terbentuk dari kombinasi asam amino ini dapat berfungsi sebagai enzim, hormon, antibodi, protein struktural (seperti kolagen dan keratin), serta protein transportasi (seperti hemoglobin dan albumin).
-
Sifat kimia dari gugus R sangat menentukan apakah asam amino tersebut berinteraksi dengan air (hidrofilik) atau menghindari air (hidrofobik), yang mempengaruhi struktur dan fungsi protein.
-
Slide ini memperkenalkan keanekaragaman asam amino berdasarkan elemen penyusunnya, yang menjadi dasar dalam memahami bagaimana struktur kimia menentukan fungsi biologis protein.
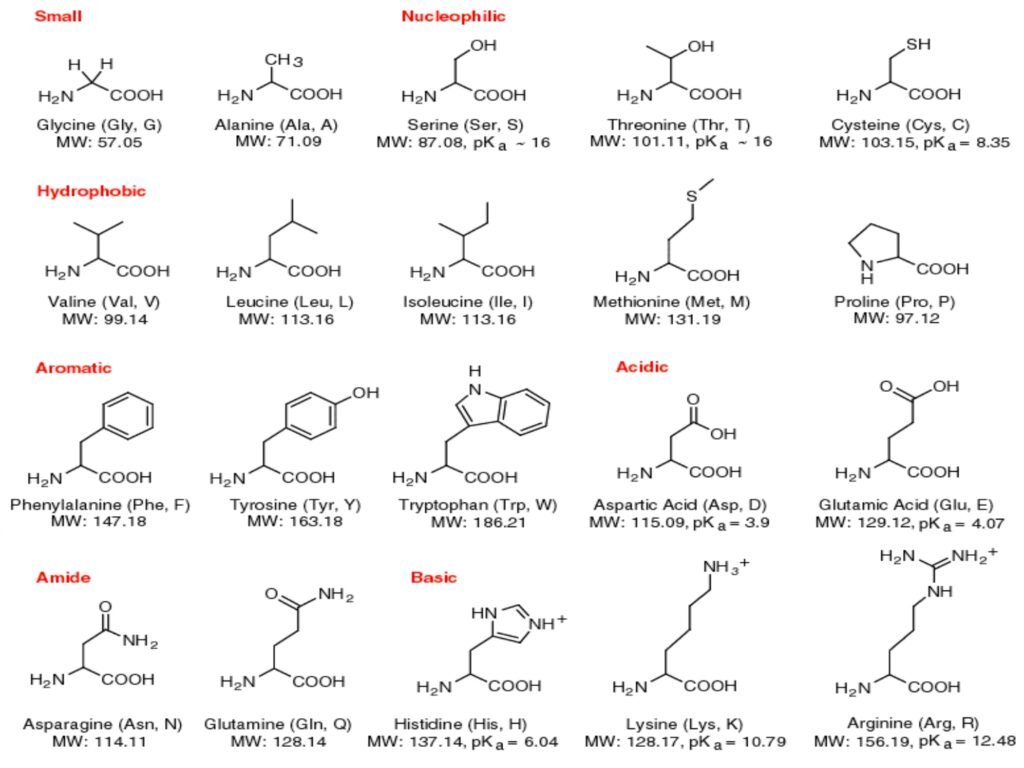
16 Syarah (Penjelasan) Slide ke-8
Slide ini menyajikan 20 asam amino standar, yang diklasifikasikan berdasarkan sifat kimia gugus R (side chain). Klasifikasi ini sangat penting dalam memahami bagaimana protein berfungsi dalam sistem biologis.
-
Klasifikasi Asam Amino Berdasarkan Gugus R:
a. Small (Kecil)-
Glycine (Gly, G) dan Alanine (Ala, A) termasuk dalam kelompok ini karena memiliki gugus R yang sederhana.
-
Glycine adalah satu-satunya asam amino akiral, sementara alanine memiliki gugus metil (-CH₃) sebagai rantai sampingnya.
b. Nucleophilic (Nukleofilik)
-
Serine (Ser, S), Threonine (Thr, T), dan Cysteine (Cys, C) memiliki gugus yang mengandung oksigen atau sulfur, yang memungkinkan mereka berpartisipasi dalam reaksi nukleofilik.
-
Cysteine memiliki gugus tiol (-SH) yang berperan penting dalam pembentukan ikatan disulfida untuk stabilisasi protein.
c. Hydrophobic (Hidrofobik)
-
Valine (Val, V), Leucine (Leu, L), Isoleucine (Ile, I), Methionine (Met, M), dan Proline (Pro, P) termasuk dalam kelompok ini.
-
Asam amino ini cenderung ditemukan di bagian dalam protein globular, karena tidak berinteraksi dengan air.
-
Methionine mengandung atom sulfur, sedangkan Proline memiliki struktur siklik, yang membatasi fleksibilitas rantai peptida.
d. Aromatic (Aromatik)
-
Phenylalanine (Phe, F), Tyrosine (Tyr, Y), dan Tryptophan (Trp, W) memiliki cincin aromatik dalam gugus R mereka.
-
Mereka berperan dalam interaksi hidrofobik dan penyerapan UV (sekitar 280 nm), yang berguna dalam analisis protein.
e. Acidic (Bersifat Asam)
-
Aspartic Acid (Asp, D) dan Glutamic Acid (Glu, E) memiliki gugus karboksilat dalam gugus R, sehingga bersifat asam dan bermuatan negatif pada pH fisiologis.
-
Berperan dalam interaksi ionik dan katalisis enzimatik.
f. Amide (Mengandung Gugus Amida)
-
Asparagine (Asn, N) dan Glutamine (Gln, Q) adalah versi netral dari asam aspartat dan glutamat, karena memiliki gugus amida (-CONH₂) sebagai pengganti gugus karboksilat.
-
Sangat penting dalam ikatan hidrogen yang menstabilkan struktur protein.
g. Basic (Bersifat Basa)
-
Histidine (His, H), Lysine (Lys, K), dan Arginine (Arg, R) memiliki gugus R yang dapat menerima proton, sehingga bermuatan positif pada pH fisiologis.
-
Histidine memiliki pKa ~6,04, sehingga sering ditemukan dalam situs aktif enzim karena dapat bertindak sebagai donor atau akseptor proton.
-
Lysine dan Arginine memiliki pKa lebih tinggi (>10), sehingga selalu bermuatan positif pada pH fisiologis.
-
-
Makna Biologis dari Klasifikasi Ini:
-
Klasifikasi ini membantu memahami bagaimana protein berlipat dan berfungsi, karena sifat gugus R menentukan interaksi molekuler dalam protein.
-
Asam amino hidrofobik cenderung mengarah ke inti protein, sedangkan asam amino hidrofilik ditemukan pada permukaan protein, berinteraksi dengan lingkungan berair.
-
Asam amino bermuatan sangat penting dalam interaksi elektrostatis, sedangkan asam amino aromatik sering berperan dalam stabilisasi struktur dan pengikatan ligan.
-
Slide ini merupakan peta dasar untuk memahami sifat kimia dan fungsi biologis dari masing-masing asam amino dalam sistem biologis.
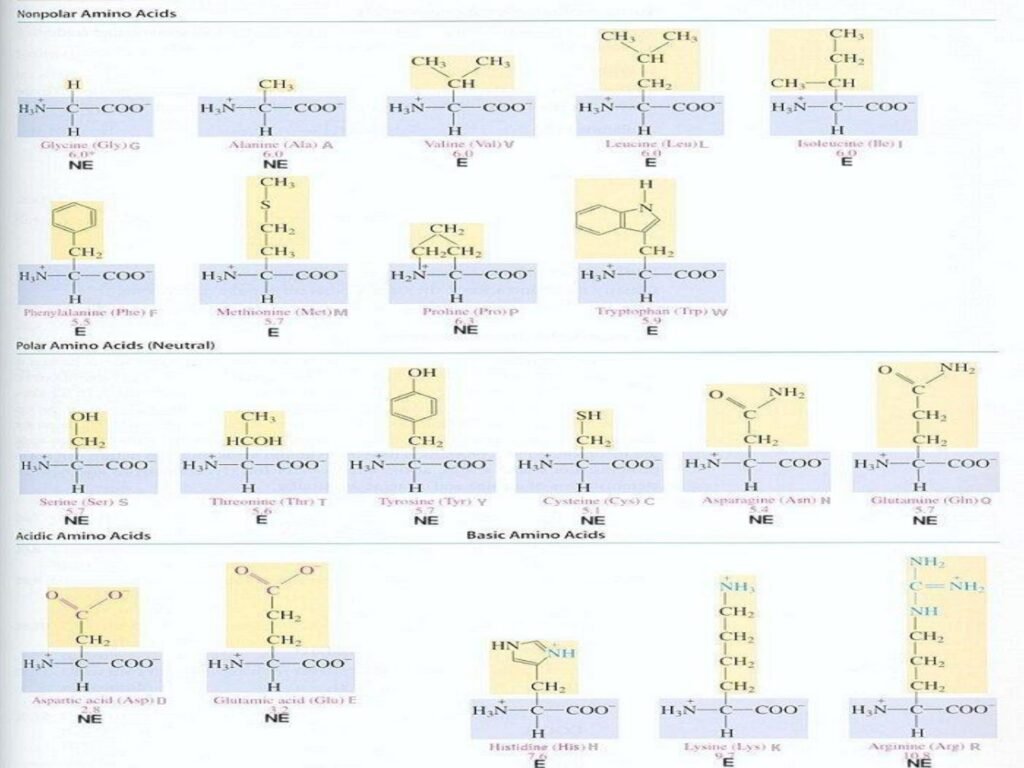
18 Syarah (Penjelasan) Slide ke-9
Slide ini mengelompokkan 20 asam amino standar berdasarkan sifat kepolaran dan muatan gugus R. Klasifikasi ini sangat penting dalam memahami bagaimana asam amino berinteraksi dalam lingkungan biologis dan bagaimana mereka menentukan struktur serta fungsi protein.
1. Nonpolar Amino Acids (Asam Amino Nonpolar)
-
Glycine (Gly, G) dan Alanine (Ala, A) → Asam amino dengan gugus R sederhana, kecil, dan nonpolar, sehingga bersifat hidrofobik.
-
Valine (Val, V), Leucine (Leu, L), dan Isoleucine (Ile, I) → Asam amino dengan rantai samping hidrokarbon bercabang, bersifat sangat hidrofobik, sering ditemukan di inti protein globular.
-
Phenylalanine (Phe, F), Methionine (Met, M), Proline (Pro, P), dan Tryptophan (Trp, W) →
-
Phenylalanine dan Tryptophan memiliki gugus aromatik, yang berperan dalam interaksi hidrofobik dan penyerapan UV (~280 nm).
-
Methionine memiliki gugus sulfur (-S-), yang penting dalam biosintesis protein sebagai donor metil.
-
Proline bersifat unik karena memiliki struktur siklik, menyebabkan pembatasan fleksibilitas dalam rantai polipeptida.
-
2. Polar Amino Acids (Asam Amino Polar - Netral)
-
Serine (Ser, S) dan Threonine (Thr, T) → Mengandung gugus hidroksil (-OH), memungkinkan partisipasi dalam ikatan hidrogen dan modifikasi post-translasi seperti fosforilasi.
-
Tyrosine (Tyr, Y) → Mengandung cincin fenol, yang dapat mengalami fosforilasi dalam regulasi jalur sinyal seluler.
-
Cysteine (Cys, C) → Memiliki gugus tiol (-SH) yang berperan dalam pembentukan ikatan disulfida, penting untuk stabilisasi protein.
-
Asparagine (Asn, N) dan Glutamine (Gln, Q) → Mengandung gugus amida (-CONH₂), sering berperan dalam ikatan hidrogen dan interaksi protein dengan air.
3. Acidic Amino Acids (Asam Amino Bermuatan Negatif)
-
Aspartic Acid (Asp, D) dan Glutamic Acid (Glu, E) →
-
Memiliki gugus karboksilat (-COO⁻) dalam rantai samping, yang menjadikannya bermuatan negatif pada pH fisiologis.
-
Berperan dalam katalisis enzimatik dan interaksi ionik dalam protein.
-
4. Basic Amino Acids (Asam Amino Bermuatan Positif)
-
Histidine (His, H) → Mengandung cincin imidazol yang bersifat basa lemah (pKa ~6,04), menjadikannya penting dalam mekanisme katalitik enzim.
-
Lysine (Lys, K) dan Arginine (Arg, R) →
-
Mengandung gugus amina tambahan yang membuatnya bermuatan positif pada pH fisiologis.
-
Arginine memiliki gugus guanidinium, yang sangat basa dan sering berperan dalam ikatan ionik dan interaksi DNA-protein.
-
Signifikansi Biologis dari Klasifikasi Ini:
-
Asam amino hidrofobik cenderung mengarah ke bagian inti protein, sementara asam amino polar cenderung berada di permukaan protein yang berinteraksi dengan lingkungan berair.
-
Asam amino bermuatan negatif sering berperan dalam katalisis enzim dan interaksi ionik, sementara asam amino bermuatan positif sering ditemukan di situs aktif enzim dan berinteraksi dengan asam nukleat (DNA/RNA).
-
Pemahaman klasifikasi ini membantu dalam perancangan obat, bioinformatika, dan rekayasa protein.
Slide ini memberikan peta visual yang jelas tentang sifat kimia dan fungsi masing-masing asam amino, serta bagaimana mereka berkontribusi dalam struktur dan fungsi protein.
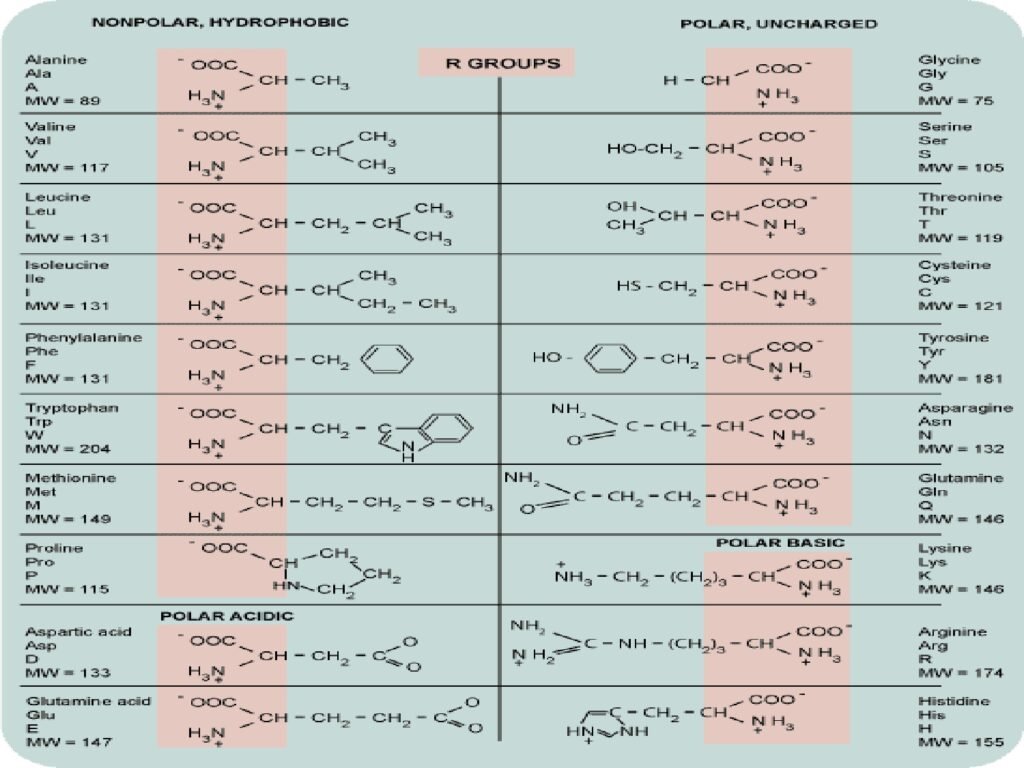
20 Syarah (Penjelasan) Slide ke-10
Slide ini menampilkan 20 asam amino standar, diklasifikasikan berdasarkan sifat kepolaran dan muatan gugus R. Pengelompokan ini sangat penting untuk memahami bagaimana asam amino berinteraksi dalam protein serta perannya dalam struktur dan fungsi biologis.
1. Nonpolar, Hydrophobic (Tidak Bermuatan, Hidrofobik)
-
Alanine (Ala, A), Valine (Val, V), Leucine (Leu, L), dan Isoleucine (Ile, I)
-
Memiliki gugus R berupa rantai hidrokarbon sederhana.
-
Sangat hidrofobik, cenderung berada di inti protein globular.
-
-
Phenylalanine (Phe, F) dan Tryptophan (Trp, W)
-
Memiliki cincin aromatik dalam gugus R.
-
Berperan dalam interaksi hidrofobik dan penyerapan UV (~280 nm).
-
-
Methionine (Met, M)
-
Mengandung atom sulfur (S), penting dalam biosintesis protein.
-
-
Proline (Pro, P)
-
Struktur siklik unik yang membatasi fleksibilitas rantai polipeptida, sering ditemukan dalam tikungan protein.
-
2. Polar, Uncharged (Polar, Tidak Bermuatan)
-
Glycine (Gly, G)
-
Asam amino paling sederhana, tidak memiliki pusat kiral.
-
Fleksibilitas tinggi dalam struktur protein.
-
-
Serine (Ser, S) dan Threonine (Thr, T)
-
Memiliki gugus hidroksil (-OH), berperan dalam ikatan hidrogen dan fosforilasi.
-
-
Cysteine (Cys, C)
-
Memiliki gugus tiol (-SH), yang dapat membentuk ikatan disulfida, penting dalam stabilisasi protein.
-
-
Tyrosine (Tyr, Y)
-
Memiliki gugus hidroksil yang bisa mengalami fosforilasi, berperan dalam regulasi sinyal seluler.
-
-
Asparagine (Asn, N) dan Glutamine (Gln, Q)
-
Mengandung gugus amida (-CONH₂), sering terlibat dalam ikatan hidrogen dalam struktur protein.
-
3. Polar Acidic (Polar, Bermuatan Negatif)
-
Aspartic Acid (Asp, D) dan Glutamic Acid (Glu, E)
-
Memiliki gugus karboksilat (-COO⁻) dalam gugus R.
-
Bermuatan negatif pada pH fisiologis (~7.4).
-
Berperan dalam interaksi ionik dan katalisis enzimatik.
-
4. Polar Basic (Polar, Bermuatan Positif)
-
Lysine (Lys, K) dan Arginine (Arg, R)
-
Mengandung gugus amina tambahan, memberikan muatan positif pada pH fisiologis.
-
Arginine memiliki gugus guanidinium, sangat penting dalam interaksi DNA-protein.
-
-
Histidine (His, H)
-
Mengandung cincin imidazol, yang bisa bertindak sebagai donor atau akseptor proton dalam reaksi enzimatik.
-
Memiliki pKa ~6.04, sehingga dapat berubah muatan dalam kisaran pH biologis.
-
Signifikansi Biologis dari Klasifikasi Ini
-
Asam amino hidrofobik cenderung terletak di inti protein, sedangkan asam amino polar cenderung berada di permukaan protein.
-
Asam amino bermuatan berperan dalam ikatan ionik, penting dalam stabilisasi struktur protein dan situs aktif enzim.
-
Pemahaman klasifikasi ini sangat berguna dalam bioinformatika, rekayasa protein, dan desain obat.
Slide ini merupakan ringkasan mendetail tentang sifat kimia dan biologi 20 asam amino standar, yang menjadi dasar bagi berbagai fungsi biologis dalam kehidupan.
22 Syarah (Penjelasan) Slide ke-11
Slide ini membahas reaksi kimia spesifik asam amino (AA) berdasarkan gugus fungsionalnya serta metode deteksi dan identifikasinya. Pemahaman reaksi ini sangat penting dalam analisis biokimia, studi protein, dan bioteknologi.
1. Reaksi Kimia Berdasarkan Gugus Fungsional Asam Amino
Setiap asam amino memiliki dua gugus fungsional utama yang dapat mengalami reaksi spesifik:
-
Gugus Amino (-NH₂) → Reaksi Asetilasi
-
Asetilasi terjadi ketika gugus amino bereaksi dengan anhidrida asetat atau asetil klorida, menghasilkan N-asetil asam amino.
-
Proses ini penting dalam modifikasi protein post-translasi, seperti N-terminal acetylation, yang mempengaruhi stabilitas dan fungsi protein dalam sel.
-
-
Gugus Karboksil (-COOH) → Reaksi Esterifikasi
-
Esterifikasi terjadi saat gugus karboksil bereaksi dengan alkohol dalam kondisi asam, membentuk ester asam amino.
-
Reaksi ini sering digunakan dalam analisis kromatografi untuk mempermudah pemisahan dan identifikasi asam amino.
-
2. Reaksi Penting untuk Deteksi dan Identifikasi Asam Amino
Dua metode utama yang digunakan dalam analisis asam amino adalah:
-
Reaksi Ninhidrin
-
Reagen Ninhidrin bereaksi dengan gugus amina primer (-NH₂) pada asam amino, membentuk senyawa berwarna ungu (Ruhemann’s purple).
-
Digunakan secara luas dalam analisis kuantitatif asam amino, termasuk dalam kromatografi kertas dan elektroforesis.
-
Prolin dan hidroksiprolin memberikan warna kuning, bukan ungu, karena memiliki amina sekunder.
-
-
Reaksi dengan FDNB (1-Fluoro-2,4-dinitrobenzene)
-
FDNB (Reagen Sanger) bereaksi dengan gugus amina bebas di ujung N-terminal dari asam amino dalam suatu peptida atau protein.
-
Menghasilkan senyawa berwarna kuning, yang dapat diidentifikasi melalui spektrofotometri.
-
Metode ini digunakan untuk penentuan urutan N-terminal dalam analisis protein.
-
3. Signifikansi Biokimia dari Reaksi Kimia Ini
-
Reaksi ini membantu dalam karakterisasi asam amino, termasuk dalam identifikasi komposisi protein dan peptida.
-
Dalam penelitian medis, metode ini digunakan untuk diagnosis gangguan metabolisme asam amino, seperti fenilketonuria (PKU) melalui tes urin menggunakan reagen Ninhidrin.
-
Reaksi FDNB digunakan dalam teknik sekuensing protein, termasuk dalam penentuan struktur insulin oleh Frederick Sanger.
Slide ini memberikan pemahaman mendalam tentang sifat kimia asam amino dan teknik analisisnya, yang sangat penting dalam biokimia struktural dan analisis protein.
24 Syarah (Penjelasan) Slide ke-12
Slide ini membahas asam amino esensial, yaitu asam amino yang tidak dapat disintesis oleh tubuh manusia dan harus diperoleh dari makanan. Kekurangan asam amino esensial dapat menyebabkan gangguan kesehatan yang serius, termasuk Kwashiorkor.
1. Daftar Asam Amino Esensial
Asam amino esensial adalah 9 asam amino yang harus diperoleh dari makanan karena tubuh manusia tidak dapat mensintesisnya dalam jumlah yang cukup. Daftar ini termasuk:
-
Valine (Val), Isoleucine (Ile), Leucine (Leu) → Asam amino bercabang (branched-chain amino acids, BCAAs) yang penting dalam sintesis protein dan metabolisme otot.
-
Threonine (Thr) → Berperan dalam pembentukan protein dan keseimbangan imun.
-
Methionine (Met) → Mengandung atom sulfur (S), diperlukan dalam sintesis protein dan pembentukan senyawa penting seperti S-adenosylmethionine (SAMe).
-
Phenylalanine (Phe) dan Tryptophan (Trp) → Asam amino aromatik yang menjadi prekursor untuk neurotransmiter seperti dopamin, serotonin, dan melatonin.
-
Lysine (Lys) → Berperan dalam sintesis protein, penyerapan kalsium, dan produksi hormon.
-
Histidine (His) → Penting untuk pertumbuhan bayi dan produksi histamin yang berperan dalam respon imun.
Catatan:
-
Cysteine (Cys) tidak termasuk esensial, tetapi dapat disintesis dari Methionine, sehingga sering dikaitkan dengan asam amino esensial dalam kondisi tertentu.
-
Arginine (Arg) dianggap semi-esensial, karena tubuh dapat mensintesisnya, tetapi dalam kondisi pertumbuhan atau penyakit tertentu, kebutuhan Arginine meningkat sehingga harus diperoleh dari makanan.
2. Mengapa Asam Amino Esensial Harus Didapatkan dari Makanan?
-
Tubuh manusia tidak memiliki enzim spesifik untuk mensintesis asam amino esensial dari molekul prekursor sederhana.
-
Asupan yang cukup dari makanan kaya protein (daging, ikan, telur, susu, kacang-kacangan) sangat penting untuk pertumbuhan, perbaikan jaringan, dan produksi enzim serta hormon.
-
Jika tidak dikonsumsi dalam jumlah yang cukup, tubuh akan mengalami katabolisme protein otot untuk memenuhi kebutuhan esensial ini, yang menyebabkan penyusutan otot (muscle wasting).
3. Dampak Kekurangan Asam Amino Esensial: Kwashiorkor
-
Kwashiorkor adalah penyakit akibat kekurangan protein, terutama di daerah dengan konsumsi kalori yang cukup tetapi rendah protein.
-
Gejala utama meliputi edema (pembengkakan akibat retensi cairan), atrofi otot, pertumbuhan terhambat, dan gangguan mental permanen.
-
Kasus di negara maju jarang terjadi, tetapi bisa ditemukan pada anak-anak yang mengalami kekerasan atau malnutrisi ekstrem.
-
Pada orang dewasa, defisiensi asam amino esensial juga dapat menyebabkan kelelahan kronis, gangguan fungsi kognitif, dan gangguan imun.
4. Signifikansi Biologis dan Klinis
-
Mengetahui asam amino esensial penting dalam nutrisi klinis, pengobatan penyakit metabolik, dan diet seimbang.
-
Peningkatan konsumsi asam amino esensial tertentu (seperti BCAA) dapat membantu pemulihan otot pada atlet dan pasien dengan penyakit katabolik.
-
Asupan protein lengkap diperlukan untuk mendukung fungsi tubuh optimal, terutama pada bayi, anak-anak, ibu hamil, dan pasien dengan penyakit kronis.
Kesimpulan
Slide ini menekankan pentingnya asam amino esensial dalam diet manusia dan dampak buruk dari kekurangan asam amino ini. Memahami peran masing-masing asam amino dalam tubuh dapat membantu dalam perencanaan diet yang lebih sehat dan terapi nutrisi klinis.
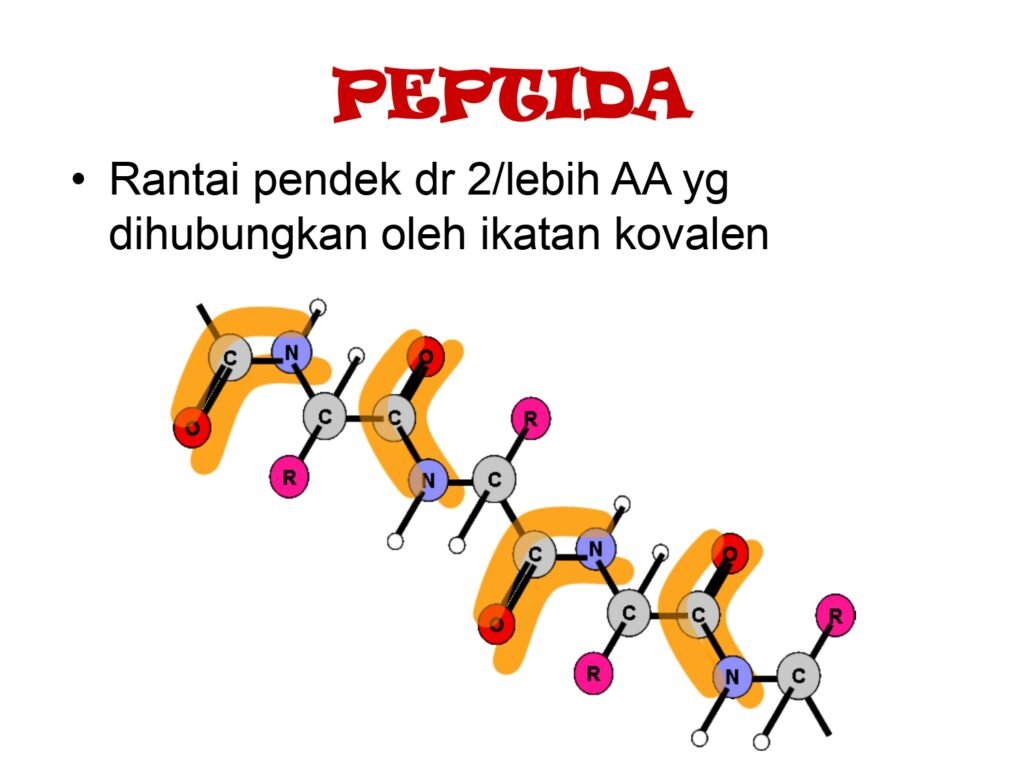
26 Syarah (Penjelasan) Slide ke-13
Slide ini membahas konsep peptida, yang merupakan rantai pendek asam amino (AA) yang terhubung oleh ikatan kovalen. Peptida adalah prekursor protein, memainkan peran penting dalam berbagai fungsi biologis, termasuk sebagai hormon, neurotransmiter, dan sinyal seluler.
1. Definisi Peptida
-
Peptida adalah rantai yang terdiri dari dua atau lebih asam amino yang dihubungkan oleh ikatan peptida, yaitu ikatan kovalen antara gugus karboksil (-COOH) satu asam amino dengan gugus amino (-NH₂) asam amino lainnya.
-
Peptida dapat diklasifikasikan berdasarkan panjangnya:
-
Dipeptida → terdiri dari dua asam amino.
-
Tripeptida → terdiri dari tiga asam amino.
-
Oligopeptida → terdiri dari beberapa asam amino (kurang dari 20-30 residu).
-
Polipeptida → terdiri dari lebih dari 30 residu, membentuk struktur lebih kompleks yang akhirnya membentuk protein fungsional.
-
2. Struktur Peptida dan Ikatan Peptida
-
Ikatan Peptida adalah ikatan kovalen amida yang terbentuk melalui reaksi kondensasi, yaitu pelepasan satu molekul air (H₂O) saat gugus karboksil (-COOH) asam amino pertama bereaksi dengan gugus amino (-NH₂) asam amino kedua.
-
Ikatan ini cukup stabil, tetapi dapat dihidrolisis oleh enzim protease atau dalam kondisi asam/basa ekstrem.
-
Peptida memiliki ujung N-terminal (gugus amino bebas) dan ujung C-terminal (gugus karboksil bebas) yang menentukan arah pembacaan dan fungsinya dalam interaksi biologis.
3. Signifikansi Biokimia Peptida
-
Peptida sebagai prekursor protein: Polipeptida dengan struktur sekunder, tersier, dan kuartener yang lebih kompleks akan membentuk protein fungsional.
-
Peptida dalam fungsi biologis:
-
Hormon peptida → Contohnya insulin, yang mengatur metabolisme glukosa.
-
Neuropeptida → Seperti endorfin, yang berperan dalam regulasi rasa sakit dan emosi.
-
Peptida antimikroba → Seperti defensin, yang berperan dalam sistem imun.
-
-
Aplikasi dalam bioteknologi dan pengobatan:
-
Peptida digunakan dalam terapi peptida untuk penyakit seperti diabetes, kanker, dan penyakit autoimun.
-
Peptida juga menjadi dasar dalam desain obat dan vaksin, misalnya dalam vaksin berbasis peptida.
-
Kesimpulan
Slide ini memperkenalkan konsep dasar peptida, yang merupakan langkah awal dalam pembentukan protein dan berbagai biomolekul penting lainnya. Pemahaman tentang peptida sangat krusial dalam biokimia, farmasi, dan bioteknologi modern.
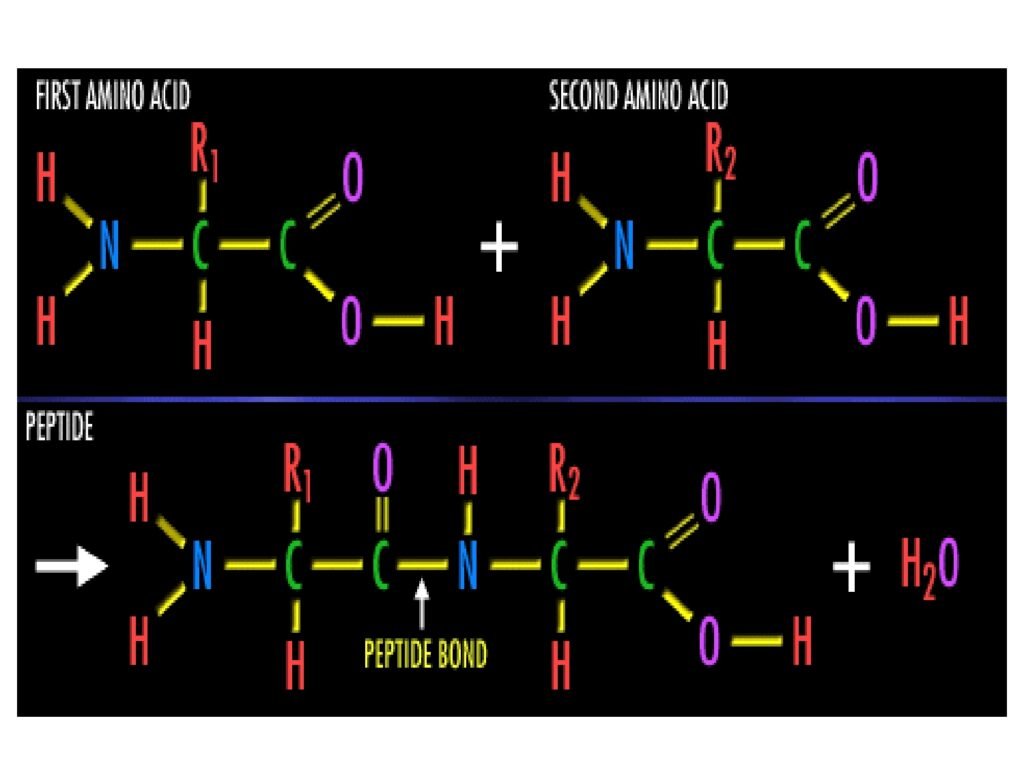
28 Syarah (Penjelasan) Slide ke-14
Slide ini menggambarkan proses pembentukan ikatan peptida antara dua asam amino melalui reaksi kondensasi, yang menghasilkan peptida dan molekul air (H₂O). Ikatan peptida merupakan dasar penyusunan protein, yang menentukan struktur dan fungsinya dalam sistem biologis.
1. Reaksi Pembentukan Ikatan Peptida
-
Bagian atas gambar:
-
Dua asam amino berinteraksi, masing-masing terdiri dari gugus amino (-NH₂) di satu sisi dan gugus karboksil (-COOH) di sisi lainnya.
-
Gugus karboksil (-COOH) dari asam amino pertama akan bereaksi dengan gugus amino (-NH₂) dari asam amino kedua.
-
-
Bagian bawah gambar:
-
Hasil reaksi menunjukkan terbentuknya ikatan peptida (-CO-NH-), dengan pelepasan satu molekul air (H₂O) sebagai hasil sampingan dari reaksi kondensasi.
-
Rangka utama dari peptida terdiri dari pola berulang N-C-C (nitrogen-karbon-karbon).
-
2. Mekanisme Reaksi Kondensasi
-
Reaksi kondensasi adalah reaksi di mana dua molekul bergabung dengan pelepasan molekul air (H₂O).
-
Gugus hidroksil (-OH) dari gugus karboksil dan satu atom hidrogen (H) dari gugus amino dilepaskan, menghasilkan ikatan kovalen antara nitrogen (N) dan karbon (C) dalam ikatan peptida.
-
Reaksi ini dikatalisis oleh enzim peptidil transferase dalam ribosom selama sintesis protein.
3. Sifat Kimia Ikatan Peptida
-
Ikatan peptida memiliki karakter resonansi, yang memberikan sifat parsial rangkap pada ikatan C-N, sehingga menyebabkan kekakuan dan planaritas struktur.
-
Karena kekakuan ini, struktur peptida tidak dapat berotasi bebas, yang berperan dalam pembentukan struktur sekunder seperti α-heliks dan β-sheet dalam protein.
4. Signifikansi Biologis Ikatan Peptida
-
Ikatan peptida adalah dasar pembentukan protein, yang berperan dalam hampir semua aspek kehidupan, termasuk enzim, hormon, transportasi molekul, dan struktur seluler.
-
Proses pembentukan dan pemutusan ikatan peptida dikendalikan secara ketat dalam tubuh, misalnya melalui enzim protease yang berperan dalam pencernaan protein dan regulasi seluler.
-
Modifikasi post-translasi pada rantai peptida dapat menentukan aktivitas dan stabilitas protein dalam sel.
Kesimpulan
Slide ini menunjukkan bagaimana dua asam amino dapat bergabung melalui ikatan peptida untuk membentuk struktur dasar protein. Pemahaman tentang ikatan peptida sangat penting dalam biokimia, farmasi, dan bioteknologi, terutama dalam bidang rekayasa protein dan pengembangan obat berbasis peptida.
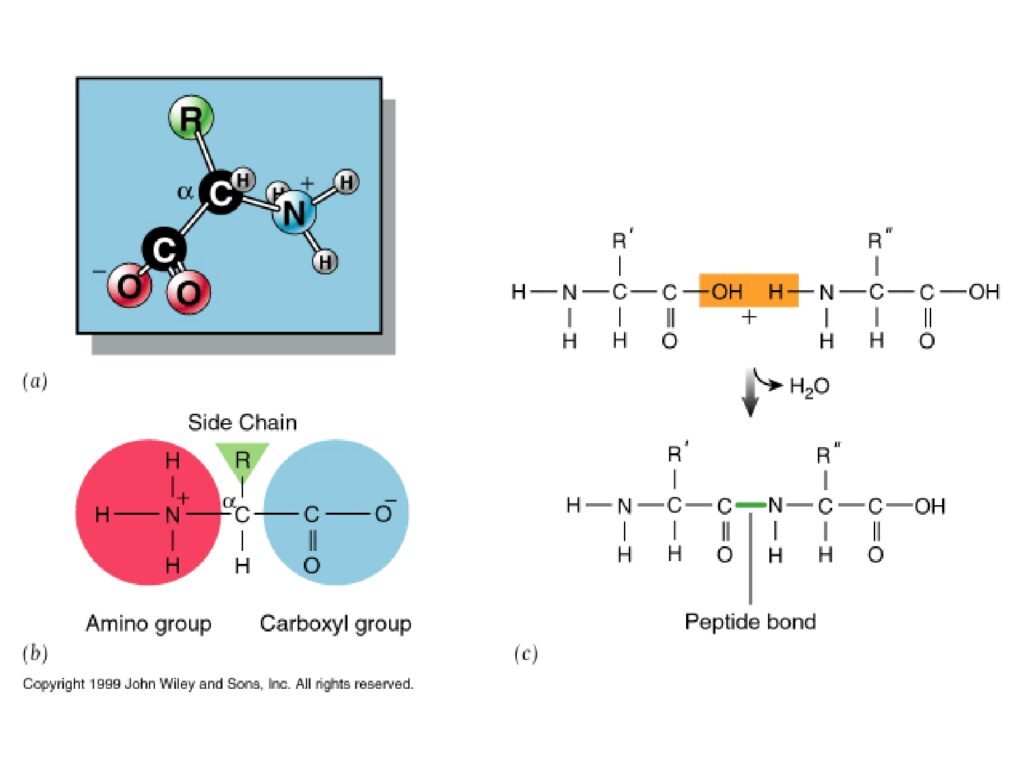
30 Syarah (Penjelasan) Slide ke-15
Slide ini menjelaskan struktur asam amino dan mekanisme pembentukan ikatan peptida, yang merupakan dasar dari sintesis protein dalam organisme hidup. Diagram dalam slide ini terbagi menjadi beberapa bagian yang menunjukkan struktur asam amino individu, gugus fungsionalnya, dan proses reaksi kondensasi untuk membentuk ikatan peptida.
1. Struktur Dasar Asam Amino (Gambar a & b)
-
Gambar (a) menunjukkan representasi molekul asam amino dalam bentuk tiga dimensi, dengan karbon alfa (Cα) sebagai pusat yang menghubungkan:
-
Gugus amino (-NH₃⁺, berwarna biru)
-
Gugus karboksil (-COO⁻, berwarna merah)
-
Atom hidrogen (H)
-
Gugus R (side chain, berwarna hijau), yang menentukan jenis asam amino
-
-
Gambar (b) menyederhanakan struktur dengan diagram bola:
-
Gugus amino (merah)
-
Gugus karboksil (biru)
-
Gugus R (hijau) yang bervariasi antar asam amino
-
2. Mekanisme Pembentukan Ikatan Peptida (Gambar c)
-
Langkah awal: Dua asam amino bergabung, di mana gugus karboksil (-COOH) dari asam amino pertama bereaksi dengan gugus amino (-NH₂) dari asam amino kedua.
-
Pelepasan molekul air (H₂O): Gugus hidroksil (-OH) dari karboksil dan satu atom hidrogen (H) dari amino dilepaskan, menghasilkan reaksi kondensasi.
-
Terbentuknya ikatan peptida (-CO-NH-): Ikatan kovalen kuat terbentuk antara karbon dan nitrogen, disebut ikatan peptida, yang ditunjukkan dengan garis hijau dalam gambar.
-
Polarisasi ikatan peptida: Karena adanya karakter resonansi, ikatan peptida memiliki sifat parsial rangkap, menyebabkan struktur yang lebih kaku dan planar, yang berpengaruh dalam pembentukan struktur sekunder protein.
3. Signifikansi Biologis Ikatan Peptida
-
Ikatan peptida adalah dasar penyusunan protein, membentuk struktur primer dari protein yang kemudian melipat menjadi struktur sekunder, tersier, dan kuartener.
-
Proses sintesis protein terjadi di dalam ribosom melalui mekanisme translasi, di mana mRNA digunakan sebagai cetak biru untuk merangkai asam amino menjadi rantai polipeptida.
-
Ikatan peptida sangat stabil, tetapi dapat dipecah oleh enzim protease dalam proses pencernaan dan degradasi protein dalam tubuh.
Kesimpulan
Slide ini memberikan gambaran fundamental tentang struktur asam amino dan bagaimana mereka bergabung untuk membentuk protein melalui ikatan peptida. Pemahaman ini sangat penting dalam bidang biokimia, bioteknologi, dan kedokteran, terutama dalam penelitian terkait protein, enzim, dan desain obat berbasis peptida.
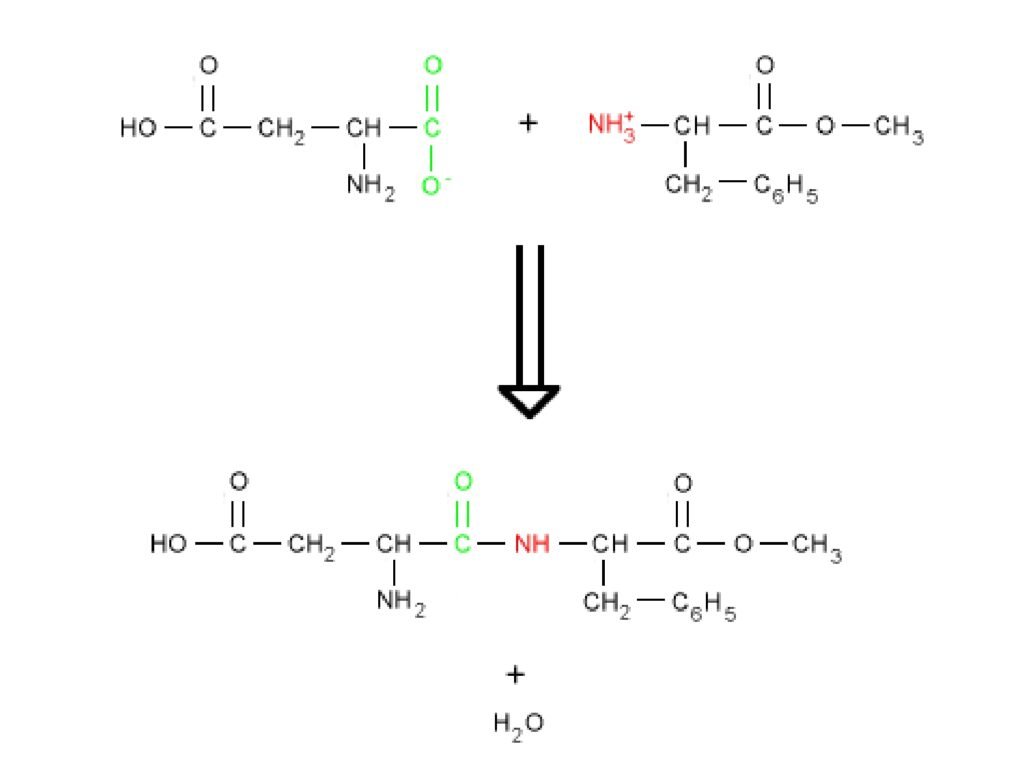
32 Syarah (Penjelasan) Slide ke-16
Slide ini menggambarkan reaksi kondensasi antara dua asam amino yang menghasilkan ikatan peptida dan pelepasan molekul air (H₂O). Ini adalah mekanisme dasar dalam pembentukan protein, yang terjadi selama sintesis protein dalam ribosom.
1. Reaksi Kondensasi Antara Dua Asam Amino
-
Gambar bagian atas:
-
Dua molekul asam amino terlibat dalam reaksi:
-
Asam amino di sebelah kiri memiliki gugus karboksil (-COOH, ditandai hijau).
-
Asam amino di sebelah kanan memiliki gugus amino (-NH₃⁺, ditandai merah).
-
-
-
Gambar bagian bawah:
-
Setelah reaksi terjadi, gugus karboksil kehilangan gugus hidroksil (-OH) dan gugus amino kehilangan satu atom hidrogen (-H), menghasilkan ikatan peptida (-CO-NH-).
-
Molekul air (H₂O) dilepaskan sebagai hasil sampingan.
-
2. Karakteristik Ikatan Peptida
-
Ikatan peptida (-CO-NH-) adalah ikatan kovalen yang stabil dan memiliki karakter parsial rangkap karena adanya resonansi elektron antara karbonil (C=O) dan nitrogen (-NH-).
-
Akibatnya, ikatan peptida bersifat planar dan kaku, membatasi rotasi bebas dan memainkan peran penting dalam pembentukan struktur sekunder protein.
-
Ikatan peptida ini dapat dihidrolisis oleh enzim protease, yang berperan dalam degradasi protein dalam pencernaan dan regulasi seluler.
3. Signifikansi Biologis Reaksi Ini
-
Reaksi ini adalah langkah dasar dalam sintesis protein, terjadi dalam ribosom selama proses translasi.
-
Proses ini dikatalisis oleh enzim peptidil transferase dalam ribosom, menggunakan tRNA sebagai pembawa asam amino yang akan dirangkai menjadi rantai polipeptida.
-
Ikatan peptida membentuk struktur primer protein, yang kemudian mengalami pelipatan lebih lanjut menjadi struktur sekunder, tersier, dan kuartener untuk membentuk protein fungsional.
-
Kerusakan atau mutasi dalam pembentukan ikatan peptida dapat menyebabkan penyakit metabolik atau kelainan genetik yang memengaruhi sintesis protein.
Kesimpulan
Slide ini menjelaskan bagaimana dua asam amino bergabung untuk membentuk ikatan peptida melalui reaksi kondensasi, suatu proses fundamental dalam biosintesis protein. Memahami reaksi ini sangat penting dalam biokimia, bioteknologi, dan ilmu kedokteran, terutama dalam studi tentang protein, enzim, dan obat berbasis peptida.
34 Syarah (Penjelasan) Slide ke-17
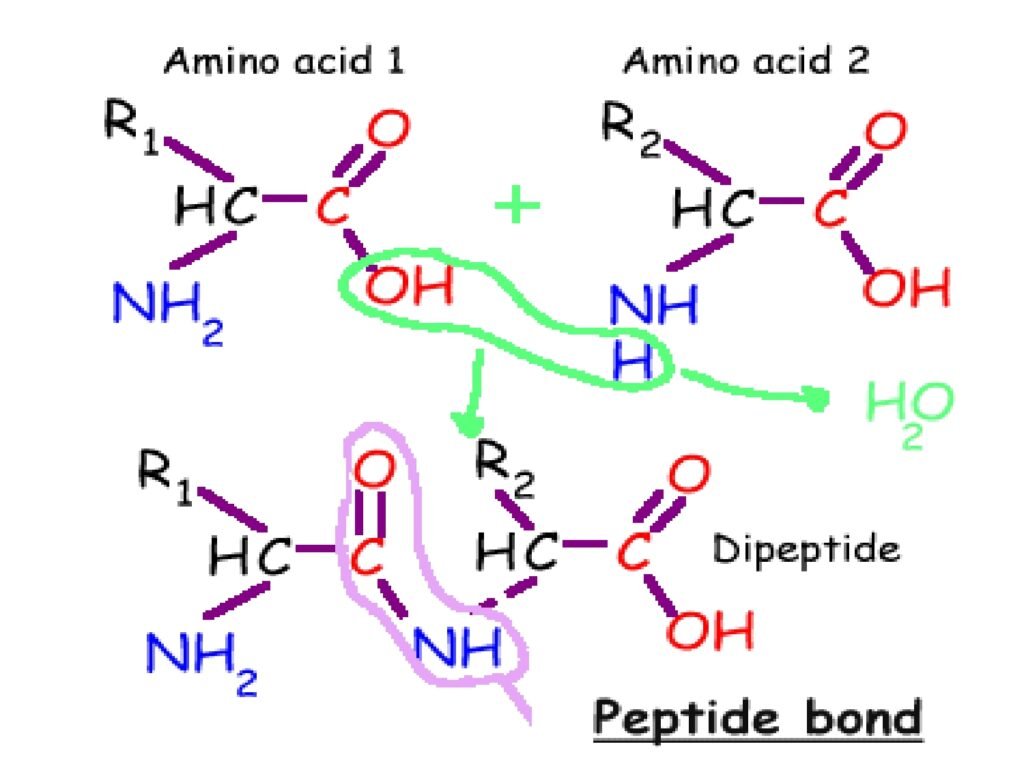
Slide ini menggambarkan proses pembentukan ikatan peptida antara dua asam amino, menghasilkan dipeptida dan pelepasan molekul air (H₂O) sebagai hasil sampingan.
1. Reaksi Pembentukan Ikatan Peptida
-
Bagian atas gambar:
-
Dua asam amino berinteraksi:
-
Asam amino 1 (Amino Acid 1) memiliki gugus karboksil (-COOH).
-
Asam amino 2 (Amino Acid 2) memiliki gugus amino (-NH₂).
-
-
Bagian yang dilingkari hijau menunjukkan bahwa -OH dari gugus karboksil dan -H dari gugus amino akan bergabung membentuk molekul air (H₂O).
-
-
Bagian bawah gambar:
-
Setelah reaksi, terbentuk dipeptida, yang terdiri dari dua asam amino yang dihubungkan oleh ikatan peptida (-CO-NH-).
-
Bagian yang dilingkari ungu menunjukkan ikatan peptida yang baru terbentuk.
-
2. Mekanisme Reaksi Kondensasi
-
Reaksi kondensasi terjadi ketika dua molekul bergabung dengan pelepasan air (H₂O).
-
Gugus hidroksil (-OH) dari gugus karboksil dan satu atom hidrogen (H) dari gugus amino dilepaskan, membentuk ikatan kovalen peptida.
-
Reaksi ini dikatalisis oleh enzim peptidil transferase dalam ribosom selama proses translasi.
3. Signifikansi Ikatan Peptida dalam Sintesis Protein
-
Ikatan peptida adalah dasar struktur primer protein, yang kemudian mengalami pelipatan menjadi struktur sekunder, tersier, dan kuartener.
-
Dipeptida dapat berkembang menjadi polipeptida, yang akhirnya membentuk protein fungsional.
-
Stabilitas ikatan peptida disebabkan oleh resonansi elektron, yang menyebabkan sifat parsial rangkap pada ikatan tersebut, membuatnya lebih kaku dan planar.
-
Pemutusan ikatan peptida dapat terjadi melalui reaksi hidrolisis, yang dikatalisis oleh enzim protease dalam pencernaan dan metabolisme protein.
4. Aplikasi Biokimia dan Bioteknologi
-
Pemahaman tentang ikatan peptida sangat penting dalam bidang bioteknologi dan kedokteran, terutama dalam desain peptida terapeutik dan enzim proteolitik.
-
Dipeptida dan oligopeptida memiliki peran dalam berbagai fungsi biologis, seperti peptida sinyal, hormon, dan neurotransmiter.
-
Studi tentang peptida juga berkontribusi dalam pengembangan obat berbasis peptida dan vaksin berbasis protein.
Kesimpulan
Slide ini menampilkan konsep fundamental tentang pembentukan ikatan peptida dan sintesis dipeptida, yang merupakan proses penting dalam biokimia protein dan ekspresi gen. Memahami reaksi ini sangat berguna dalam bioinformatika, biomedis, dan rekayasa protein.
36 Syarah (Penjelasan) Slide ke-18
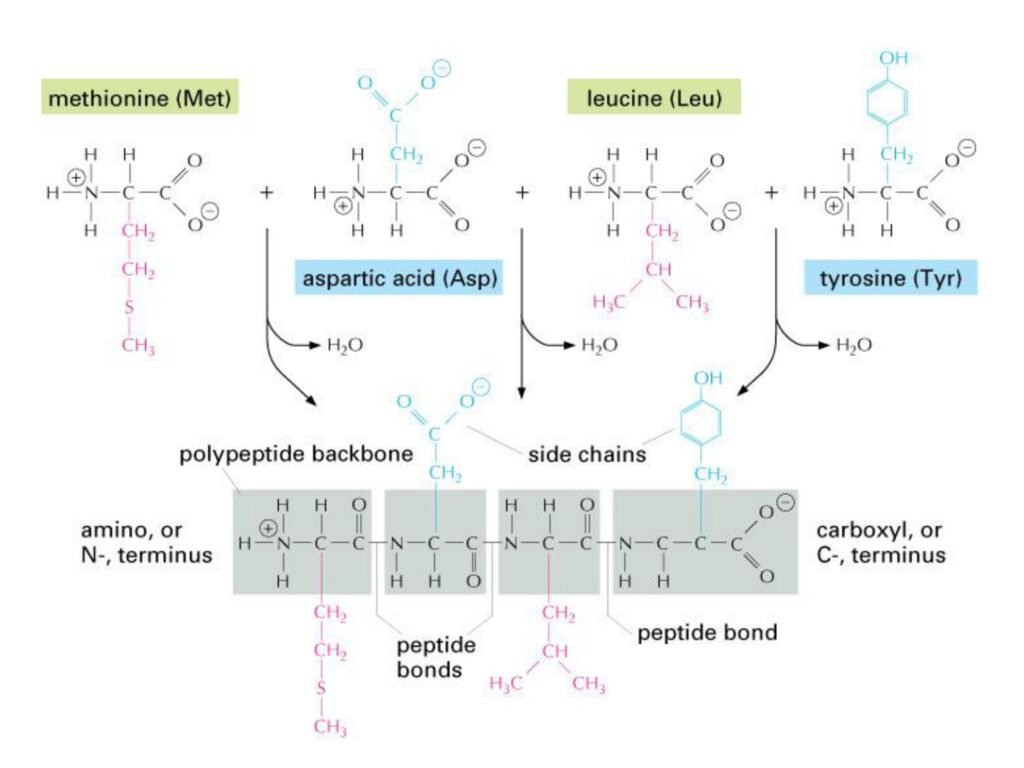
Slide ini menggambarkan bagaimana beberapa asam amino bergabung membentuk rantai polipeptida melalui ikatan peptida yang terjadi dalam reaksi kondensasi. Struktur ini menjadi dasar dari sintesis protein dalam sel.
1. Proses Pembentukan Polipeptida
-
Slide ini menampilkan reaksi kondensasi antara beberapa asam amino:
-
Methionine (Met) – asam amino yang mengandung gugus sulfur, sering berperan sebagai asam amino pertama dalam translasi.
-
Aspartic acid (Asp) – asam amino bermuatan negatif karena gugus karboksilat pada rantai sampingnya.
-
Leucine (Leu) – asam amino nonpolar dengan rantai samping bercabang, penting dalam struktur protein.
-
Tyrosine (Tyr) – asam amino dengan gugus fenol, dapat mengalami fosforilasi dalam regulasi sinyal seluler.
-
-
Setiap reaksi menghasilkan pelepasan satu molekul air (H₂O), menandakan terjadinya ikatan peptida baru (-CO-NH-).
-
Struktur yang dihasilkan adalah polipeptida, dengan ujung amino (N-terminus) dan ujung karboksil (C-terminus).
2. Struktur Polipeptida
-
Rantai utama polipeptida (polypeptide backbone) terdiri dari pola berulang -N-C-C- yang membentuk tulang punggung protein.
-
Gugus samping (side chains, R-groups) menentukan sifat dan fungsi polipeptida.
-
Ikatan peptida yang ditunjukkan dalam gambar merupakan ikatan kovalen kuat yang memberikan stabilitas terhadap rantai polipeptida.
3. Signifikansi Biokimia Pembentukan Polipeptida
-
Polipeptida adalah prekursor protein, yang akan mengalami pelipatan menjadi struktur sekunder (α-heliks, β-sheet), tersier, dan kuartener untuk membentuk protein fungsional.
-
Proses ini terjadi dalam ribosom selama translasi, di mana tRNA membawa asam amino ke ribosom untuk dirangkai menjadi polipeptida sesuai dengan kode genetik.
-
Mutasi atau kesalahan dalam sintesis polipeptida dapat menyebabkan disfungsi protein, yang berkontribusi terhadap berbagai penyakit genetik dan metabolik.
4. Aplikasi dalam Ilmu Biologi dan Bioteknologi
-
Pemahaman tentang ikatan peptida dan struktur polipeptida sangat penting dalam rekayasa protein, desain obat, dan pengembangan enzim terapeutik.
-
Protein rekombinan dibuat dengan mengontrol ekspresi polipeptida tertentu dalam sistem bioteknologi seperti E. coli atau sel mamalia.
-
Desain vaksin berbasis peptida bergantung pada pemahaman struktur polipeptida untuk merancang epitop antigenik yang optimal.
Kesimpulan
Slide ini menjelaskan bagaimana asam amino dapat berikatan membentuk polipeptida, yang kemudian berkembang menjadi protein fungsional. Pemahaman tentang proses ini adalah dasar dalam biokimia, bioinformatika, dan ilmu kedokteran, khususnya dalam penelitian terkait protein, enzim, dan terapi berbasis peptida.
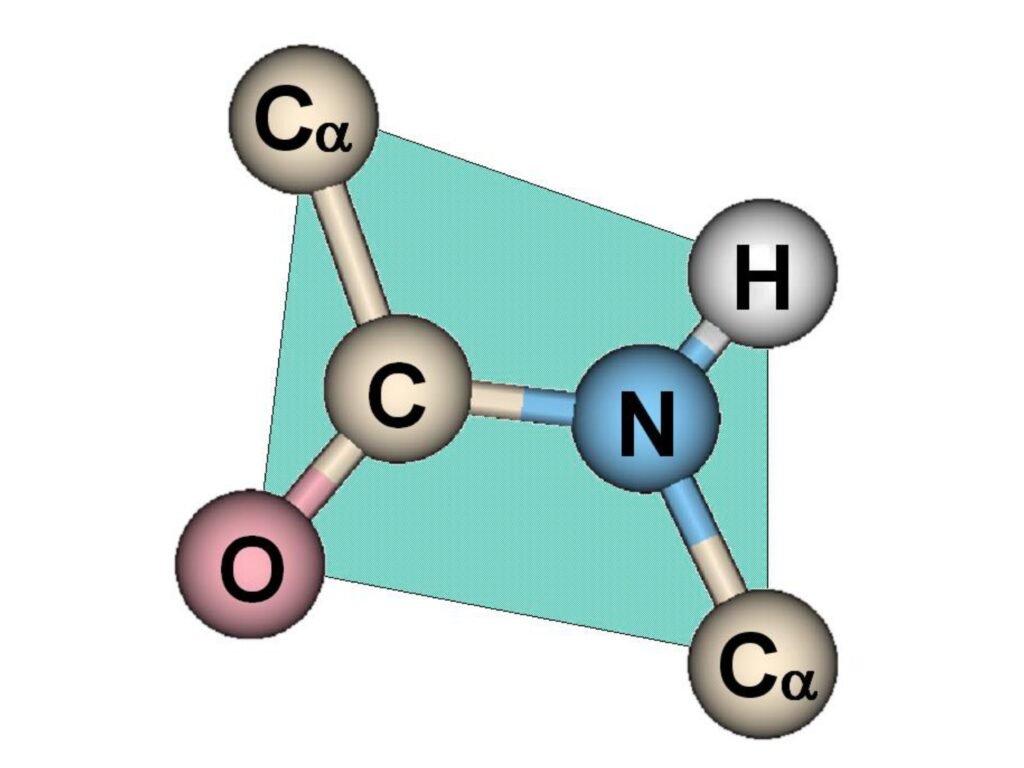
38 Syarah (Penjelasan) Slide ke-19
Slide ini menampilkan struktur tiga dimensi ikatan peptida, yang merupakan komponen fundamental dalam struktur utama protein. Ikatan peptida memiliki sifat unik yang memengaruhi konformasi dan stabilitas protein.
1. Komponen Struktur Ikatan Peptida
-
Atom-atom utama dalam ikatan peptida terdiri dari:
-
Karbon α (Cα) – pusat dari setiap asam amino yang menghubungkan gugus R (rantai samping).
-
Karbon karbonil (C) – bagian dari gugus karboksil yang berkontribusi dalam pembentukan ikatan peptida.
-
Oksigen (O) – bagian dari gugus karbonil yang berkontribusi dalam interaksi hidrogen pada struktur sekunder protein.
-
Nitrogen (N) – berasal dari gugus amino asam amino berikutnya dan membentuk ikatan dengan karbon karbonil.
-
Hidrogen (H) – terikat pada nitrogen dan dapat berperan dalam interaksi hidrogen dalam struktur protein.
-
2. Sifat Kekakuan dan Planaritas Ikatan Peptida
-
Ikatan peptida memiliki karakter parsial rangkap karena adanya resonansi elektron antara karbon karbonil dan nitrogen.
-
Akibatnya, ikatan peptida bersifat planar dan kaku, sehingga tidak dapat berotasi bebas seperti ikatan tunggal biasa.
-
Struktur ini membentuk bidang planar, yang ditunjukkan dalam gambar sebagai bidang hijau, memperlihatkan bahwa atom C, N, O, dan H berada dalam satu bidang.
-
Kekakuan ini berkontribusi terhadap stabilitas struktur sekunder protein, seperti α-heliks dan β-sheet.
3. Implikasi Struktural dalam Protein
-
Karena ikatan peptida tidak dapat berotasi bebas, rotasi dalam protein hanya dapat terjadi di sekitar karbon α (Cα).
-
Dua sudut yang menentukan konformasi protein adalah:
-
Sudut phi (ϕ) – rotasi antara Cα dan nitrogen (N).
-
Sudut psi (ψ) – rotasi antara Cα dan karbon karbonil (C).
-
-
Pola rotasi ini penting dalam prediksi struktur protein dan dalam memahami pelipatan protein yang menentukan fungsinya.
4. Signifikansi Biologis dan Bioteknologi
-
Pemahaman tentang sifat ikatan peptida sangat penting dalam desain obat dan protein rekayasa, termasuk dalam bidang bioteknologi dan kedokteran.
-
Protein misfolding (kesalahan pelipatan protein) yang disebabkan oleh mutasi atau gangguan ikatan peptida dapat menyebabkan penyakit seperti Alzheimer, Parkinson, dan prion disease.
-
Prediksi struktur protein menggunakan metode bioinformatika, seperti pemetaan sudut phi dan psi pada plot Ramachandran, berguna dalam desain enzim dan terapi berbasis protein.
Kesimpulan
Slide ini menunjukkan bagaimana ikatan peptida membentuk struktur yang planar dan kaku, yang sangat menentukan konformasi protein dan stabilitas strukturalnya. Pemahaman ini penting dalam biokimia struktural, biofisika, dan rekayasa protein untuk pengembangan terapi berbasis biomolekul.
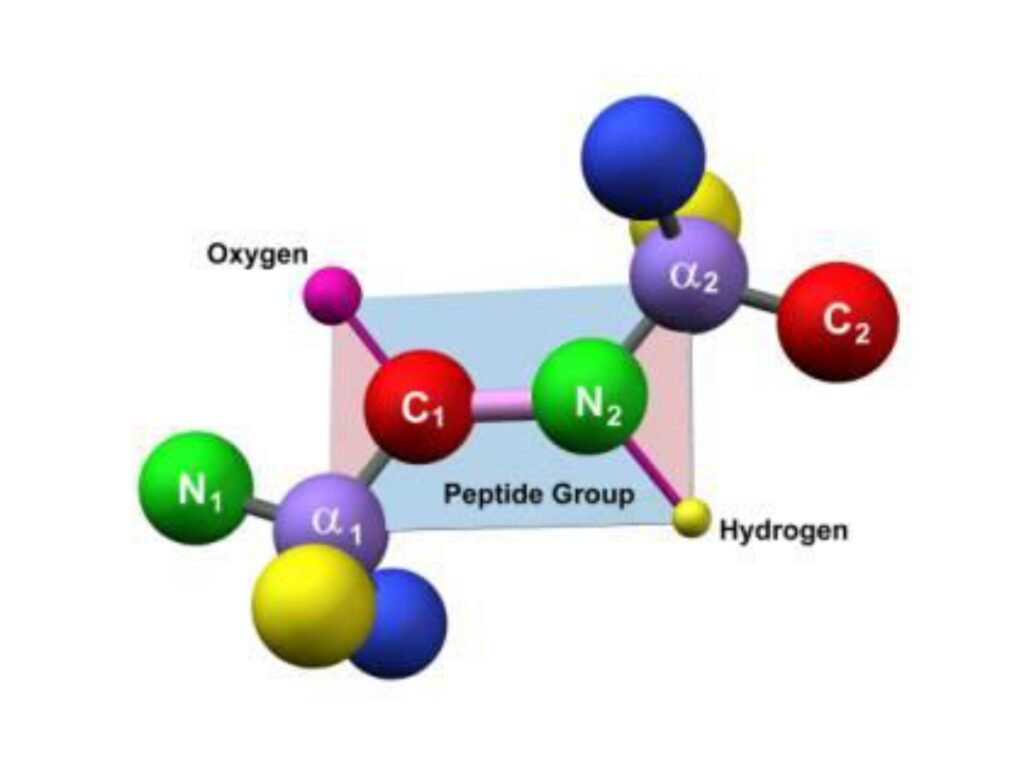
40 Syarah (Penjelasan) Slide ke-20
Slide ini menyajikan model tiga dimensi (3D) dari ikatan peptida, menyoroti bagaimana ikatan peptida terbentuk dan bagaimana ia mempengaruhi struktur protein. Model ini memperlihatkan interaksi antara atom karbon (C), nitrogen (N), oksigen (O), dan hidrogen (H) dalam ikatan peptida serta keterlibatan karbon α (Cα) dari masing-masing asam amino.
1. Struktur dan Komponen Ikatan Peptida
-
Atom-atom utama yang membentuk ikatan peptida:
-
C₁ (karbon karbonil) – bagian dari gugus karbonil (-CO) yang berperan dalam pembentukan ikatan peptida.
-
N₂ (nitrogen amida) – berasal dari gugus amino (-NH₂) asam amino berikutnya dan membentuk ikatan dengan C₁.
-
Oksigen (O) – berkontribusi dalam interaksi hidrogen dan pembentukan struktur sekunder protein.
-
Hidrogen (H) – sering berperan dalam interaksi hidrogen dan stabilisasi struktur protein.
-
Cα₁ dan Cα₂ – karbon alfa dari masing-masing asam amino, yang menjadi titik rotasi utama dalam struktur protein.
-
2. Kekakuan Planaritas Ikatan Peptida
-
Wilayah yang diarsir sebagai “Peptide Group” menunjukkan bahwa ikatan peptida memiliki struktur planar.
-
Ikatan antara C₁ dan N₂ bersifat parsial rangkap, menyebabkan rotasi terbatas di sepanjang ikatan peptida.
-
Oleh karena itu, ikatan peptida bersifat kaku dan membentuk bidang planar, yang menentukan cara protein melipat dalam ruang tiga dimensi.
3. Implikasi dalam Struktur Protein
-
Karena keterbatasan rotasi ikatan peptida, fleksibilitas protein hanya bergantung pada rotasi di sekitar Cα (karbon alfa).
-
Sudut rotasi phi (ϕ) dan psi (ψ) menentukan bagaimana protein melipat menjadi struktur sekunder seperti α-heliks dan β-sheet.
-
Interaksi hidrogen antara oksigen (O) dan hidrogen (H) dari gugus amida juga berkontribusi dalam pembentukan struktur sekunder protein.
4. Relevansi Biologis dan Aplikasi dalam Bioteknologi
-
Pemahaman tentang kekakuan dan planaritas ikatan peptida sangat penting dalam prediksi struktur protein, seperti yang digunakan dalam pemodelan bioinformatika dan desain protein rekayasa.
-
Analisis struktur protein menggunakan teknik seperti difraksi sinar-X dan spektroskopi NMR bergantung pada prinsip kekakuan ikatan peptida ini.
-
Kesalahan dalam pelipatan protein (misfolding) yang terkait dengan interaksi ikatan peptida dapat menyebabkan penyakit neurodegeneratif seperti Alzheimer dan Parkinson.
Kesimpulan
Slide ini menunjukkan bagaimana ikatan peptida membentuk struktur planar yang kaku, yang sangat memengaruhi cara protein melipat dan berfungsi dalam sistem biologis. Pemahaman ini krusial dalam biokimia struktural, bioinformatika, dan desain obat berbasis protein.
42 Syarah (Penjelasan) Slide ke-21
Slide ini menjelaskan konsep dasar ikatan peptida, polipeptida, dan protein, yang merupakan hierarki struktur dasar dalam sintesis protein.
1. Ikatan Peptida
-
Definisi: Ikatan peptida adalah ikatan kovalen yang terbentuk antara gugus karboksil (-COOH) dari satu asam amino dan gugus amino (-NH₂) dari asam amino lainnya melalui reaksi kondensasi, menghasilkan dipeptida dan satu molekul air (H₂O).
-
Karakteristik:
-
Ikatan ini bersifat kuat dan stabil karena memiliki karakter parsial rangkap, akibat resonansi elektron antara karbonil (-C=O) dan nitrogen (-NH-).
-
Planaritas dari ikatan ini membatasi rotasi bebas, yang berpengaruh terhadap struktur sekunder dan tersier protein.
-
-
Proses pemutusan ikatan peptida terjadi melalui reaksi hidrolisis, yang dikatalisis oleh enzim protease dalam pencernaan protein dan proses degradasi protein seluler.
2. Polipeptida
-
Definisi: Polipeptida adalah rantai panjang asam amino yang dihubungkan oleh ikatan peptida, biasanya terdiri dari lebih dari 100 asam amino.
-
Struktur polipeptida membentuk tulang punggung protein, dengan dua ujung khas:
-
N-terminus – ujung dengan gugus amino bebas (-NH₂).
-
C-terminus – ujung dengan gugus karboksil bebas (-COOH).
-
-
Polipeptida belum tentu merupakan protein fungsional, karena masih perlu mengalami pelipatan struktur dan modifikasi pascatranslasi agar memiliki aktivitas biologis.
3. Protein
-
Definisi: Protein terdiri dari satu atau lebih polipeptida yang telah mengalami pelipatan dan modifikasi spesifik untuk menjalankan fungsi biologis tertentu.
-
Perbedaan utama antara polipeptida dan protein adalah bahwa protein memiliki struktur tersier dan kuartener yang stabil, sehingga dapat berfungsi sebagai enzim, hormon, antibodi, atau komponen struktural dalam sel.
-
Contoh protein fungsional:
-
Enzim (misalnya, katalase, amilase, DNA polimerase) – Memfasilitasi reaksi biokimia.
-
Protein struktural (misalnya, kolagen, keratin, aktin) – Memberikan bentuk dan kekuatan mekanis pada jaringan.
-
Protein transport (misalnya, hemoglobin, albumin) – Mengangkut molekul dalam tubuh.
-
Hormon berbasis protein (misalnya, insulin, glukagon) – Mengatur proses fisiologis.
-
4. Relevansi Biologi dan Aplikasi dalam Bioteknologi
-
Sintesis protein melalui rekayasa genetika, seperti produksi protein rekombinan dalam bakteri atau sel mamalia, memungkinkan pembuatan obat berbasis protein (insulin rekombinan, antibodi monoklonal, dll.).
-
Pemahaman tentang struktur polipeptida dan protein sangat penting dalam penelitian biomedis, termasuk terapi berbasis protein untuk penyakit genetik dan neurodegeneratif.
-
Desain protein menggunakan bioinformatika, termasuk AlphaFold, membantu dalam prediksi struktur dan desain protein baru untuk aplikasi medis dan industri.
Kesimpulan
Slide ini menunjukkan bagaimana ikatan peptida membentuk polipeptida, yang kemudian berkembang menjadi protein fungsional. Memahami hubungan ini sangat penting dalam biokimia, bioteknologi, dan ilmu kedokteran, terutama dalam bidang rekayasa protein, enzimologi, dan pengobatan berbasis protein.
44 Syarah (Penjelasan) Slide ke-22
Slide ini menjelaskan dua jenis utama protein, yaitu protein sederhana (simple protein) dan protein gabungan (konjugasi/conjugated protein), berdasarkan komposisi monomernya.
1. Protein Sederhana (Simple Protein)
-
Definisi:
-
Protein yang hanya terdiri dari rantai asam amino (AA) tanpa tambahan gugus prostetik atau senyawa non-protein lainnya.
-
Protein ini akan terdegradasi menjadi asam amino ketika mengalami hidrolisis.
-
-
Contoh:
-
Ribonuklease (RNase) – Enzim yang menghidrolisis RNA dalam sel, terdiri dari hanya rantai polipeptida tanpa tambahan molekul lain.
-
Albumin – Protein larut dalam air yang ditemukan dalam darah dan putih telur.
-
Keratin – Protein struktural dalam rambut, kuku, dan kulit.
-
2. Protein Gabungan (Konjugasi)
-
Definisi:
-
Protein yang terdiri dari rantai polipeptida (bagian protein) yang terikat dengan komponen non-protein (gugus prostetik).
-
Gugus prostetik ini memberikan fungsi tambahan bagi protein, seperti kemampuan mengikat ion logam, lipid, atau karbohidrat.
-
-
Klasifikasi Berdasarkan Gugus Prostetik:
-
Nukleoprotein – Protein yang berikatan dengan asam nukleat (contoh: ribosom, histon).
-
Glikoprotein – Protein yang mengandung gugus karbohidrat (contoh: hormon FSH dan LH, mukus glikoprotein).
-
Lipoprotein – Protein yang mengandung lipid dan berperan dalam transportasi lemak (contoh: HDL dan LDL dalam darah).
-
Metaloprotein – Protein yang mengandung ion logam sebagai kofaktor (contoh: hemoglobin dengan ion Fe²⁺, katalase, sitokrom).
-
3. Relevansi Biologi dan Aplikasi dalam Ilmu Bioteknologi
-
Protein sederhana seperti enzim ribonuklease sangat penting dalam bioteknologi, terutama dalam penelitian ekspresi gen dan terapi berbasis RNA.
-
Protein konjugasi memiliki peran penting dalam sistem biologis, seperti transport oksigen (hemoglobin), pertahanan imun (imunoglobulin), dan komunikasi seluler (reseptor membran glikoprotein).
-
Dalam industri farmasi dan kedokteran, pemahaman tentang protein konjugasi memungkinkan pengembangan obat berbasis protein, seperti antibodi monoklonal dan vaksin berbasis glikoprotein.
Kesimpulan
Slide ini menyoroti dua kategori utama protein berdasarkan komposisi molekulnya, yaitu protein sederhana yang hanya terdiri dari asam amino, serta protein konjugasi yang mengandung gugus prostetik tambahan. Pemahaman ini sangat penting dalam biokimia struktural, bioteknologi, dan pengembangan obat berbasis protein.
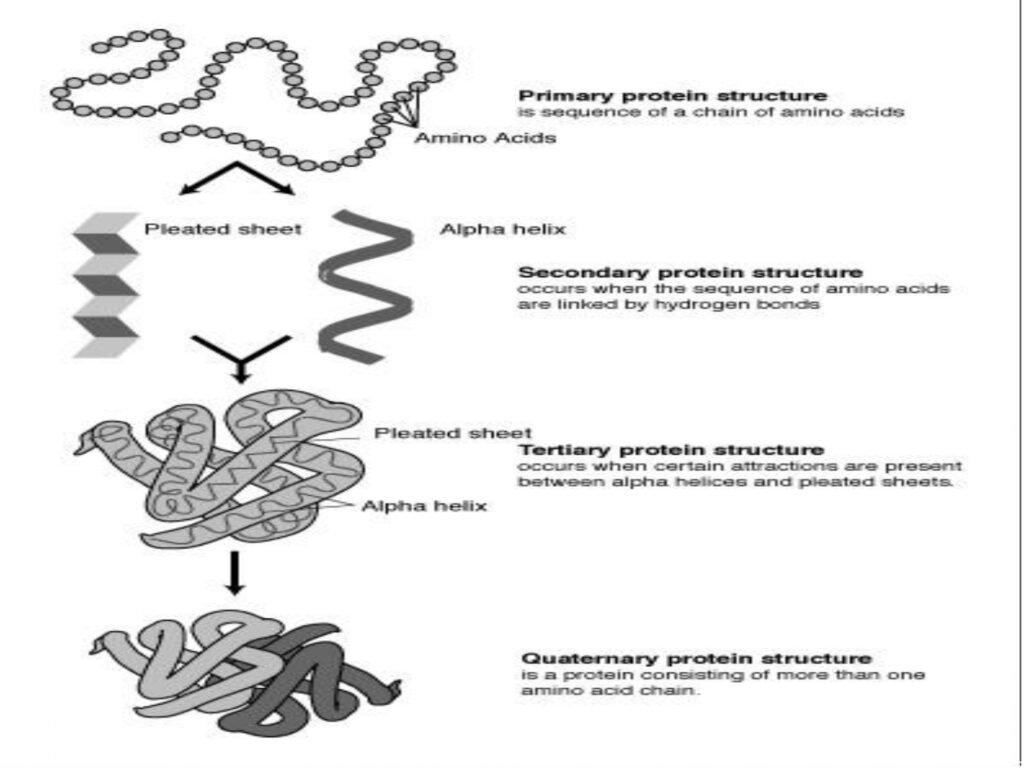
46 Syarah (Penjelasan) Slide ke-23
Slide ini menguraikan empat tingkat organisasi struktur protein, yang sangat penting dalam menentukan fungsi biologis dan stabilitas protein. Setiap tingkat memiliki karakteristik unik yang mempengaruhi interaksi dan aktivitas protein dalam sistem biologis.
1. Struktur Primer
-
Definisi:
-
Urutan linear asam amino dalam rantai polipeptida yang dihubungkan oleh ikatan peptida.
-
-
Signifikansi:
-
Menentukan identitas dan fungsi protein, karena perubahan satu asam amino saja dapat menyebabkan mutasi yang memengaruhi fungsi biologisnya (misalnya, mutasi pada hemoglobin yang menyebabkan anemia sel sabit).
-
-
Contoh:
-
Struktur primer insulin, yang memiliki dua rantai polipeptida (rantai A dan B) yang ditentukan oleh urutan asam amino spesifik.
-
2. Struktur Sekunder
-
Definisi:
-
Konfigurasi lokal dari rantai polipeptida yang distabilkan oleh ikatan hidrogen antar gugus karbonil (-C=O) dan gugus amida (-NH).
-
-
Dua Jenis Utama:
-
α-heliks – Struktur spiral stabil yang ditemukan dalam banyak protein struktural seperti keratin pada rambut dan kuku.
-
β-sheet (lembaran β) – Struktur lembaran yang ditahan oleh ikatan hidrogen antar rantai polipeptida, seperti pada protein fibroin dalam sutra.
-
-
Signifikansi:
-
Struktur sekunder memberikan stabilitas awal pada protein sebelum melipat lebih lanjut ke dalam struktur tersier.
-
3. Struktur Tersier
-
Definisi:
-
Lipatan tiga dimensi dari satu rantai polipeptida yang distabilkan oleh berbagai interaksi non-kovalen dan kovalen.
-
-
Interaksi yang Membentuk Struktur Tersier:
-
Ikatan hidrogen – Menjaga stabilitas antar gugus polar.
-
Interaksi hidrofobik – Asam amino non-polar cenderung berkumpul di bagian dalam protein untuk menghindari kontak dengan air.
-
Ikatan ionik – Interaksi antara asam amino bermuatan positif dan negatif.
-
Ikatan disulfida – Ikatan kovalen antara gugus tiol (-SH) dari dua residu sistein, penting dalam protein seperti insulin dan antibodi.
-
-
Signifikansi:
-
Struktur tersier menentukan fungsi biologis protein, seperti pada enzim, reseptor membran, dan antibodi.
-
4. Struktur Kuartener
-
Definisi:
-
Organisasi protein yang terdiri dari lebih dari satu rantai polipeptida (subunit) yang berinteraksi untuk membentuk kompleks protein fungsional.
-
-
Contoh:
-
Hemoglobin – Terdiri dari empat subunit globin yang bekerja sama dalam transportasi oksigen dalam darah.
-
DNA polimerase – Enzim kompleks yang terdiri dari beberapa subunit untuk replikasi DNA.
-
-
Signifikansi:
-
Struktur kuartener memungkinkan protein untuk berfungsi secara lebih efisien, misalnya dalam kooperativitas pengikatan oksigen oleh hemoglobin.
-
5. Relevansi Biologi dan Aplikasi dalam Bioteknologi
-
Pemahaman tentang struktur protein sangat penting dalam desain obat, terutama dalam pengembangan inhibitor enzim dan antibodi terapeutik.
-
Metode bioinformatika, seperti prediksi struktur protein dengan AlphaFold, membantu dalam rekayasa protein untuk aplikasi medis dan industri.
-
Kesalahan dalam pelipatan protein (protein misfolding) terkait dengan penyakit seperti Alzheimer, Parkinson, dan prion disease, menunjukkan pentingnya memahami struktur protein dalam biomedis.
Kesimpulan
Slide ini menguraikan empat tingkat struktur protein yang menentukan fungsi biologisnya. Pemahaman tentang struktur primer hingga kuartener sangat penting dalam biokimia, bioteknologi, dan desain obat berbasis protein.
48 Syarah (Penjelasan) Slide ke-24
Slide ini menjelaskan struktur primer protein, yang merupakan tingkat organisasi paling dasar dalam hierarki struktur protein. Struktur primer terdiri dari rantai panjang asam amino yang dihubungkan oleh ikatan peptida dan menentukan identitas serta fungsi spesifik suatu protein.
1. Definisi Struktur Primer
-
Struktur primer adalah urutan linier asam amino dalam suatu rantai polipeptida.
-
Setiap asam amino dalam struktur primer terhubung oleh ikatan peptida (-CO-NH-), yang terbentuk melalui reaksi kondensasi antara gugus karboksil (-COOH) dari satu asam amino dan gugus amino (-NH₂) dari asam amino berikutnya, dengan pelepasan satu molekul air (H₂O).
-
Urutan ini ditentukan oleh informasi genetik yang dikodekan dalam DNA dan diterjemahkan melalui proses sintesis protein dalam ribosom.
2. Peran Struktur Primer dalam Fungsi Protein
-
Menentukan bentuk dan fungsi protein → Perbedaan urutan asam amino akan menghasilkan protein dengan struktur tiga dimensi yang berbeda, yang akhirnya menentukan fungsinya dalam sel.
-
Berperan dalam pengenalan enzim dan interaksi spesifik → Misalnya, perubahan satu asam amino dalam enzim dapat menyebabkan hilangnya aktivitas katalitiknya.
-
Memengaruhi stabilitas protein → Urutan asam amino yang berbeda dapat menghasilkan interaksi intra-molekuler yang berbeda, memengaruhi stabilitas dan ketahanan protein terhadap denaturasi.
3. Contoh Struktur Primer Protein
-
Insulin → Hormon yang mengatur kadar glukosa darah. Struktur primernya terdiri dari dua rantai polipeptida (rantai A dan B) yang dihubungkan oleh ikatan disulfida.
-
Hemoglobin → Protein pengangkut oksigen dalam darah, terdiri dari empat rantai polipeptida (dua rantai α dan dua rantai β). Mutasi dalam struktur primernya dapat menyebabkan penyakit anemia sel sabit.
-
Enzim Lisozim → Berfungsi dalam sistem imun untuk menghancurkan dinding sel bakteri dengan struktur primer yang sangat konservatif di berbagai organisme.
4. Hubungan Struktur Primer dengan Mutasi Genetik
-
Perubahan dalam satu asam amino akibat mutasi dapat mengubah sifat dan fungsi protein secara drastis.
-
Mutasi missense → Mengubah satu asam amino dalam urutan protein (contoh: anemia sel sabit disebabkan oleh mutasi pada gen β-globin, mengubah glutamat menjadi valin).
-
Mutasi nonsense → Mengubah kodon asam amino menjadi kodon stop, menyebabkan pemendekan rantai polipeptida dan hilangnya fungsi protein.
5. Relevansi dalam Bioteknologi dan Kedokteran
-
Teknik sekuensing protein digunakan untuk menentukan urutan asam amino dalam protein dan memahami mutasi yang menyebabkan penyakit.
-
Protein rekombinan seperti insulin buatan diproduksi dengan cara mereplikasi struktur primer insulin manusia dalam bakteri atau sel mamalia untuk terapi diabetes.
-
Desain obat berbasis protein menggunakan informasi struktur primer untuk mengembangkan inhibitor spesifik terhadap enzim patogen.
Kesimpulan
Struktur primer adalah pondasi utama dalam organisasi protein, menentukan bentuk tiga dimensi dan fungsinya dalam sel. Perubahan kecil dalam urutan asam amino dapat menyebabkan perubahan besar dalam fungsi biologis, menjadikannya kunci utama dalam studi biokimia, bioteknologi, dan kedokteran molekuler.
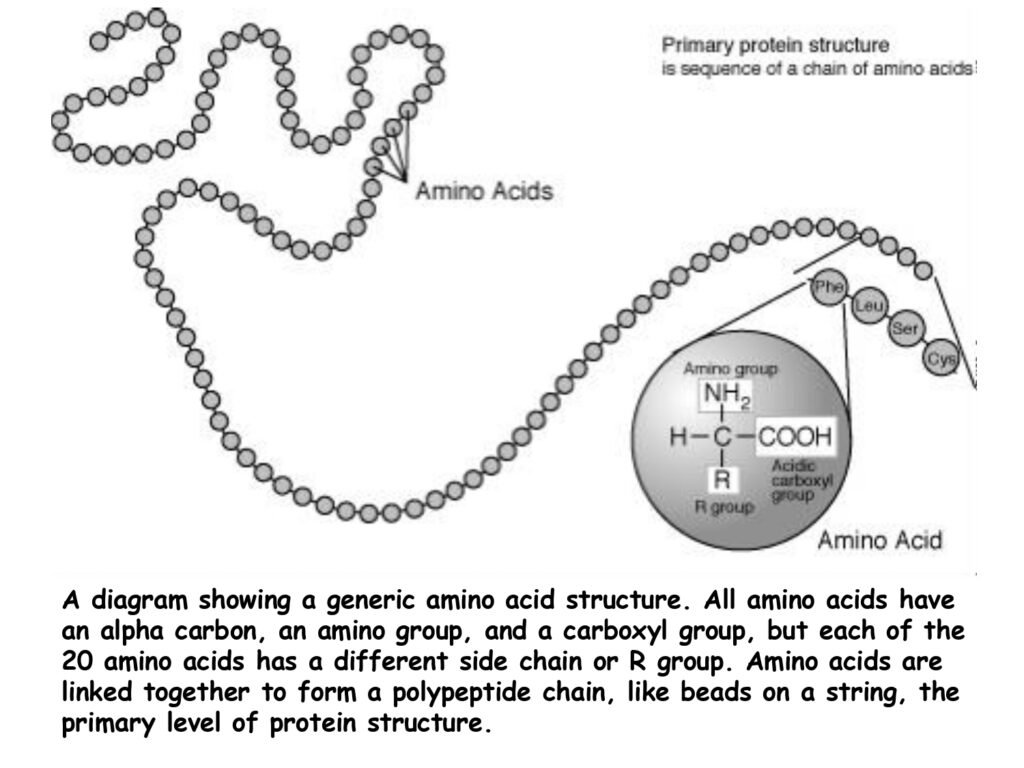
50 Syarah (Penjelasan) Slide ke-25
Slide ini menggambarkan struktur primer protein dengan representasi rantai polipeptida yang tersusun dari asam amino. Setiap asam amino memiliki tiga bagian utama: atom karbon alfa (Cα), gugus amino (-NH₂), dan gugus karboksil (-COOH). Perbedaan utama antar asam amino terletak pada rantai samping (gugus R), yang menentukan sifat kimia dan peran biologisnya.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Primary protein structure → Struktur primer protein
-
Primary → Primer (tingkat pertama dalam hierarki struktur)
-
Protein → Protein
-
Structure → Struktur
-
-
Sequence of a chain of amino acids → Urutan rantai asam amino
-
Sequence → Urutan
-
Chain → Rantai
-
Amino acids → Asam amino
-
-
A diagram showing a generic amino acid structure → Diagram yang menunjukkan struktur umum asam amino
-
Diagram → Diagram/gambar skematis
-
Showing → Menunjukkan
-
Generic → Umum (tidak spesifik untuk satu jenis asam amino tertentu)
-
Structure → Struktur
-
-
All amino acids have an alpha carbon, an amino group, and a carboxyl group
→ Semua asam amino memiliki karbon alfa, gugus amino, dan gugus karboksil -
Each of the 20 amino acids has a different side chain or R group
→ Setiap dari 20 asam amino memiliki rantai samping atau gugus R yang berbeda -
Amino acids are linked together to form a polypeptide chain
→ Asam amino saling terhubung untuk membentuk rantai polipeptida -
Like beads on a string → Seperti manik-manik pada tali
-
The primary level of protein structure → Tingkat primer dalam struktur protein
2. Penjelasan Struktur Primer dalam Konteks Biokimia
Struktur primer protein ditentukan oleh urutan asam amino yang spesifik dan dikodekan dalam DNA. Informasi ini diterjemahkan dalam ribosom melalui proses translasi, membentuk rantai polipeptida. Setiap asam amino dihubungkan oleh ikatan peptida, yang merupakan ikatan kovalen kuat antara gugus karboksil (-COOH) satu asam amino dan gugus amino (-NH₂) asam amino berikutnya.
Gugus R (rantai samping) memberikan sifat kimia unik pada setiap asam amino, seperti sifat hidrofobik, hidrofilik, asam, atau basa. Sifat ini nantinya menentukan bagaimana protein akan melipat dan berfungsi dalam tingkat struktur lebih tinggi.
3. Analogi Rantai Polipeptida: "Seperti Manik-Manik pada Tali"
Analogi ini menggambarkan bagaimana setiap asam amino dalam rantai polipeptida tersusun berurutan, seperti manik-manik yang diuntai pada seutas tali. Urutan asam amino bersifat spesifik dan penting dalam menentukan struktur tiga dimensi protein yang fungsional.
Sebagai contoh:
-
Hemoglobin memiliki struktur primer tertentu yang memungkinkan fungsinya dalam mengikat oksigen.
-
Enzim lisozim memiliki struktur primer yang spesifik sehingga dapat menghancurkan dinding sel bakteri.
Perubahan kecil dalam urutan asam amino (mutasi) dapat mengganggu fungsi protein, seperti yang terjadi pada anemia sel sabit, di mana hanya satu asam amino dalam rantai hemoglobin berubah tetapi menyebabkan kelainan yang signifikan.
4. Kesimpulan
Struktur primer protein adalah dasar dari fungsi dan stabilitas protein. Setiap perubahan dalam urutan asam amino dapat memengaruhi struktur dan aktivitas protein secara keseluruhan, menjadikannya elemen fundamental dalam biokimia dan genetika molekuler.
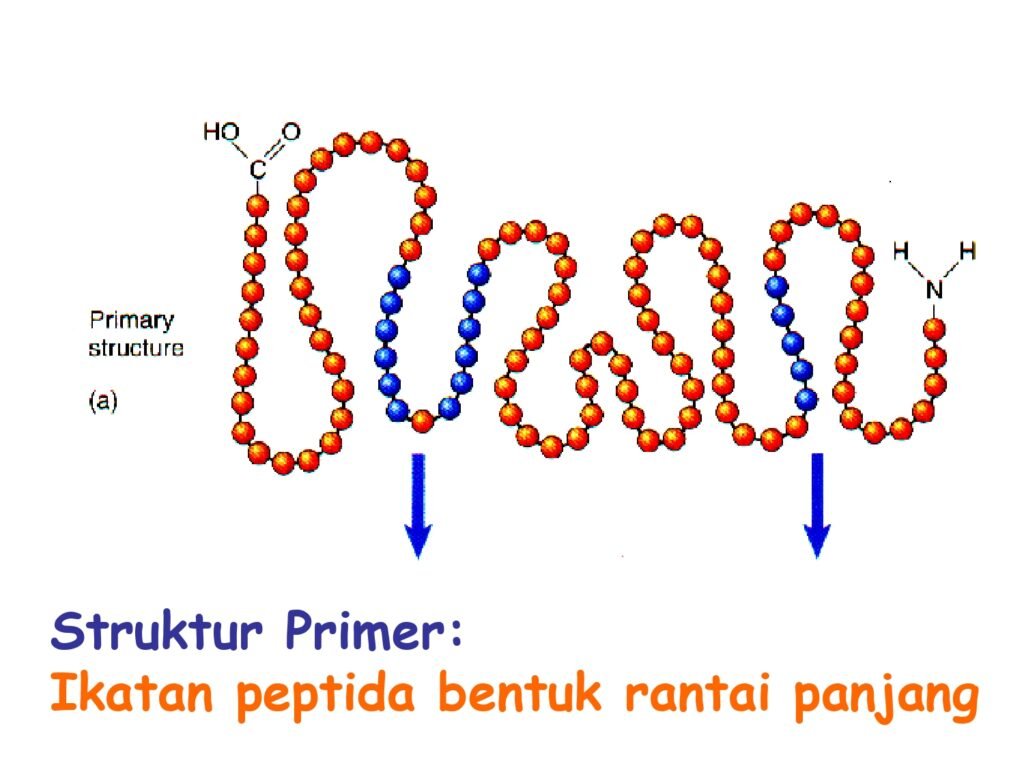
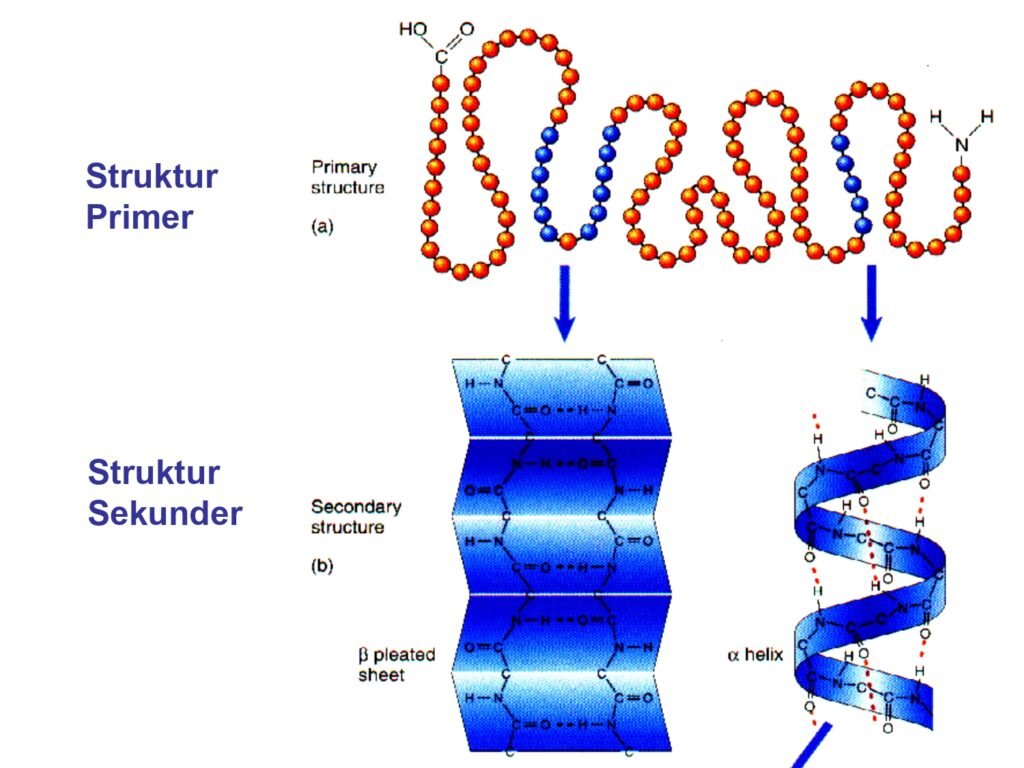
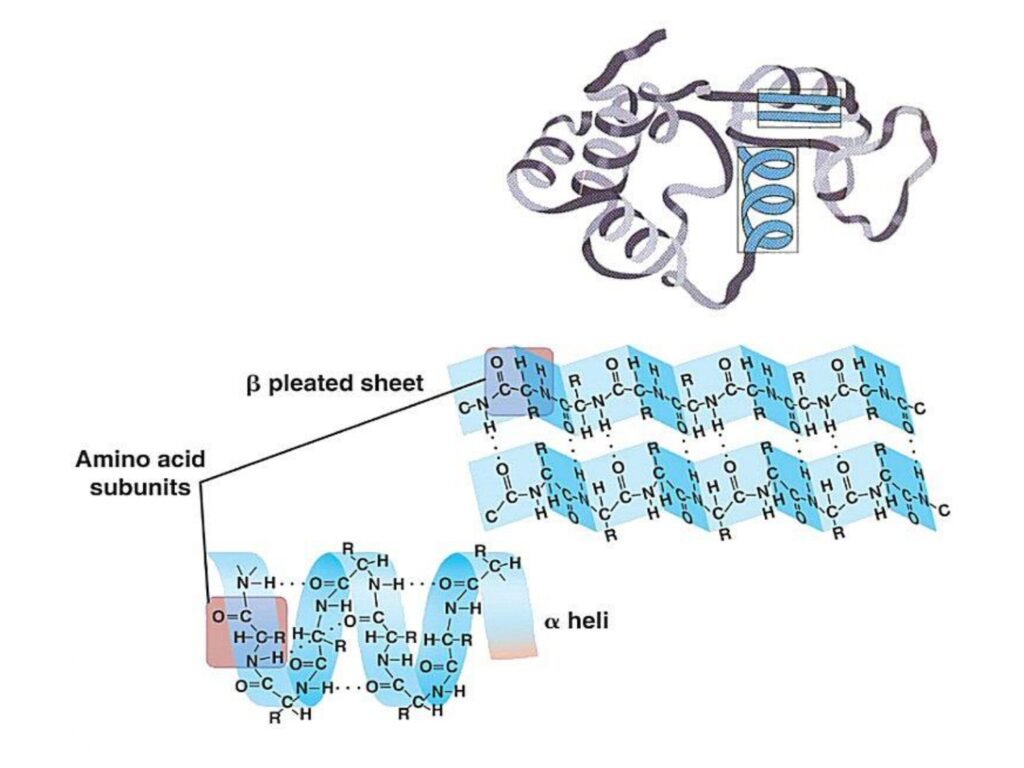
52 Syarah (Penjelasan) Slide ke-26
Slide ini menjelaskan perbedaan antara struktur primer dan struktur sekunder protein.
-
Struktur Primer: Ditampilkan sebagai rantai asam amino linier yang disusun secara spesifik berdasarkan informasi genetik. Ikatan yang membentuk struktur ini adalah ikatan peptida.
-
Struktur Sekunder: Ditampilkan dalam dua bentuk utama:
-
α-Heliks (alpha-helix)
-
β-Lembar Lipat (beta-pleated sheet)
-
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Primary structure → Struktur primer
-
Primary → Primer (tingkat pertama dalam hierarki struktur)
-
Structure → Struktur
-
-
Secondary structure → Struktur sekunder
-
Secondary → Sekunder (tingkat kedua dalam hierarki struktur)
-
-
α-Helix → Struktur heliks α (spiral protein)
-
β-Pleated sheet → Lembar lipat β (struktur lembaran berlipat-lipat)
2. Penjelasan Struktur Sekunder dalam Konteks Biokimia
Setelah struktur primer terbentuk, rantai polipeptida mulai melipat membentuk struktur sekunder.
-
α-Heliks
-
Bentuknya seperti spiral yang distabilkan oleh ikatan hidrogen antara gugus karbonil (-C=O) dan gugus amino (-NH) dalam rantai utama polipeptida.
-
Struktur ini banyak ditemukan dalam protein serat seperti keratin (pada rambut dan kuku).
-
-
β-Lembar Lipat (β-Pleated Sheet)
-
Dibentuk oleh dua atau lebih rantai polipeptida yang berinteraksi membentuk lembaran berlipat.
-
Ikatan hidrogen antara gugus karbonil dan gugus amino mempertahankan bentuk lipatan ini.
-
Struktur ini banyak ditemukan dalam protein struktural seperti fibroin (sutra laba-laba).
-
3. Peran Struktur Sekunder dalam Stabilitas Protein
Struktur sekunder sangat penting karena:
✅ Memberikan kestabilan melalui ikatan hidrogen antara residu asam amino.
✅ Mempengaruhi fungsi biologis protein.
✅ Menjadi dasar untuk struktur tersier dan kuartener yang lebih kompleks.
4. Kesimpulan
🔹 Struktur sekunder terbentuk dari lipatan rantai polipeptida yang distabilkan oleh ikatan hidrogen.
🔹 Ada dua bentuk utama: α-Heliks (spiral) dan β-Pleated Sheet (lembaran lipat-lipat).
🔹 Pola lipatan ini menentukan fleksibilitas dan kekuatan protein dalam berbagai fungsi biologis.
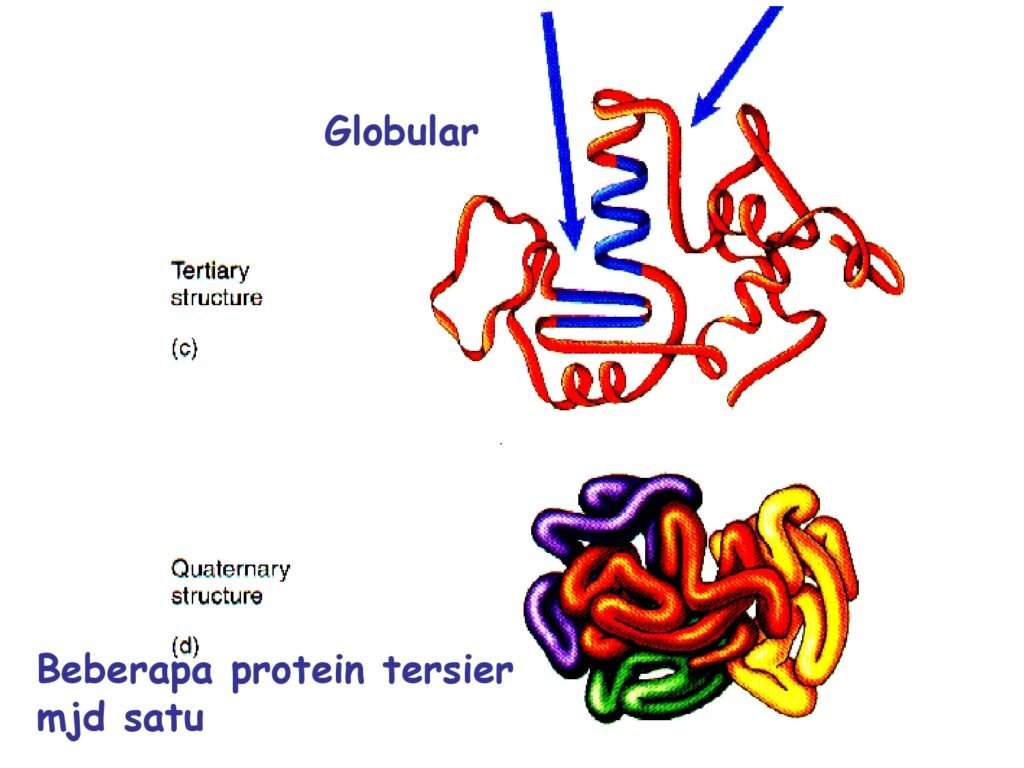
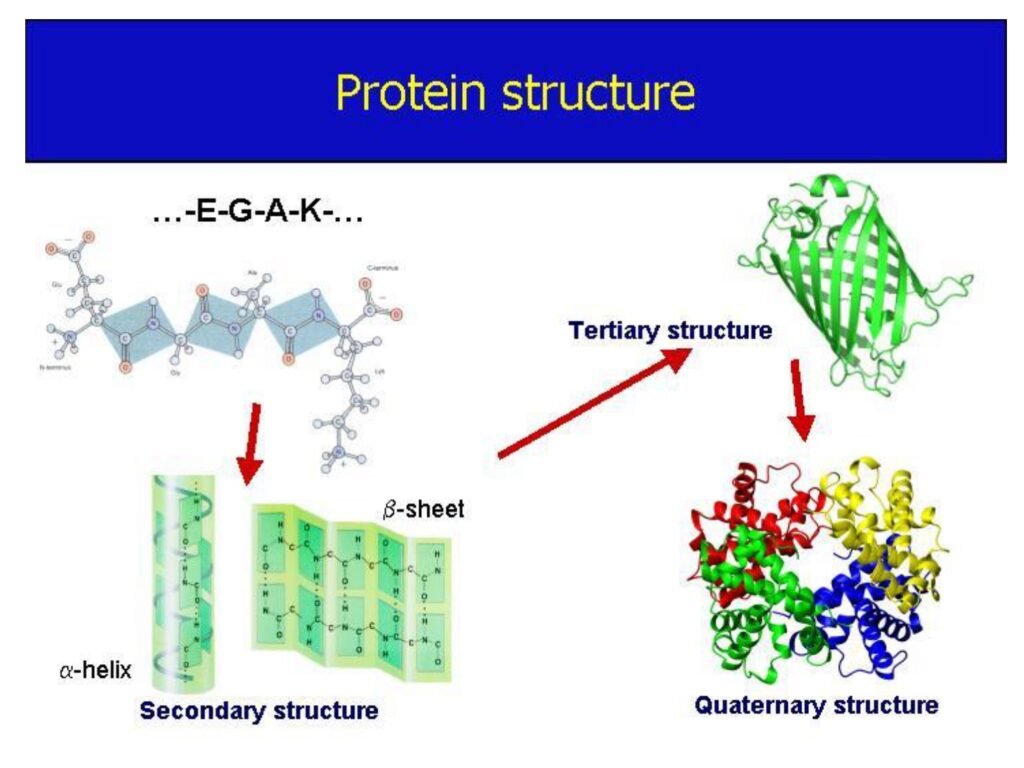
54 Syarah (Penjelasan) Slide ke-27
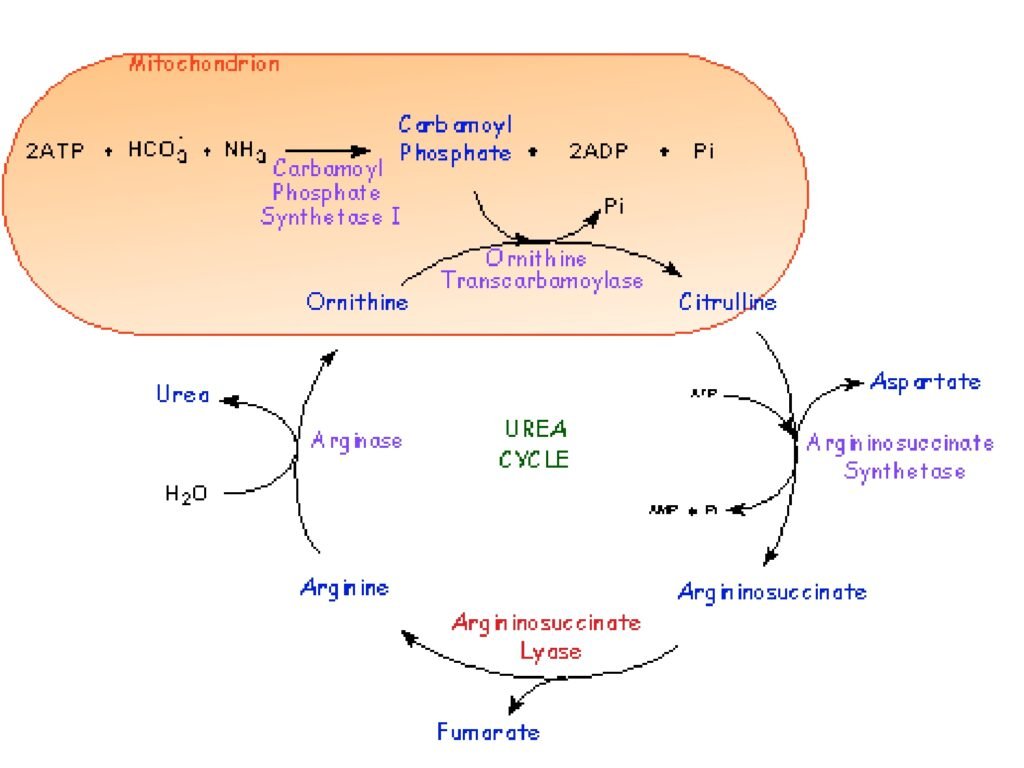
Slide ini menjelaskan struktur tersier dan kuartener protein, yang merupakan tahap lebih lanjut dari lipatan polipeptida setelah struktur primer dan sekunder terbentuk.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Tertiary structure → Struktur tersier
-
Tertiary → Tersier (tingkat ketiga dalam hierarki struktur)
-
Structure → Struktur
-
-
Quaternary structure → Struktur kuartener
-
Quaternary → Kuartener (tingkat keempat dalam hierarki struktur)
-
-
Globular → Bentuk globular (bulat, menggumpal)
-
Beberapa protein tersier menjadi satu → Gabungan beberapa subunit protein tersier membentuk struktur kuartener
2. Penjelasan Struktur Tersier dan Kuartener dalam Konteks Biokimia
A. Struktur Tersier
🔹 Struktur tersier terbentuk dari interaksi antara gugus R (rantai samping) dari asam amino.
🔹 Interaksi ini mencakup:
-
Ikatan hidrogen (antara gugus polar)
-
Ikatan disulfida (antara residu sistein, membentuk jembatan disulfida -S-S-)
-
Interaksi hidrofobik (mengelompoknya asam amino non-polar ke dalam)
-
Ikatan ionik (antara gugus bermuatan positif dan negatif)
🔹 Protein globular adalah contoh struktur tersier yang kompak dan berfungsi dalam enzim, hormon, dan protein transport seperti hemoglobin dan enzim katalase.
B. Struktur Kuartener
🔹 Struktur kuartener terbentuk dari lebih dari satu rantai polipeptida tersier yang berikatan menjadi satu kesatuan fungsional.
🔹 Contohnya:
-
Hemoglobin (terdiri dari 4 subunit protein globular)
-
DNA polimerase (enzim dengan beberapa subunit yang bekerja bersama)
-
Kolagen (protein struktural dengan tiga rantai polipeptida berpilin)
🔹 Struktur ini membantu meningkatkan stabilitas protein dan efisiensi fungsinya dalam sel.
3. Kesimpulan
✅ Struktur tersier menentukan bentuk tiga dimensi protein dan sangat bergantung pada interaksi antar gugus R.
✅ Struktur kuartener terdiri dari beberapa protein tersier yang bekerja sebagai kompleks fungsional.
✅ Protein dengan struktur ini memiliki fungsi spesifik dalam tubuh, mulai dari katalisator reaksi hingga transport molekul penting.
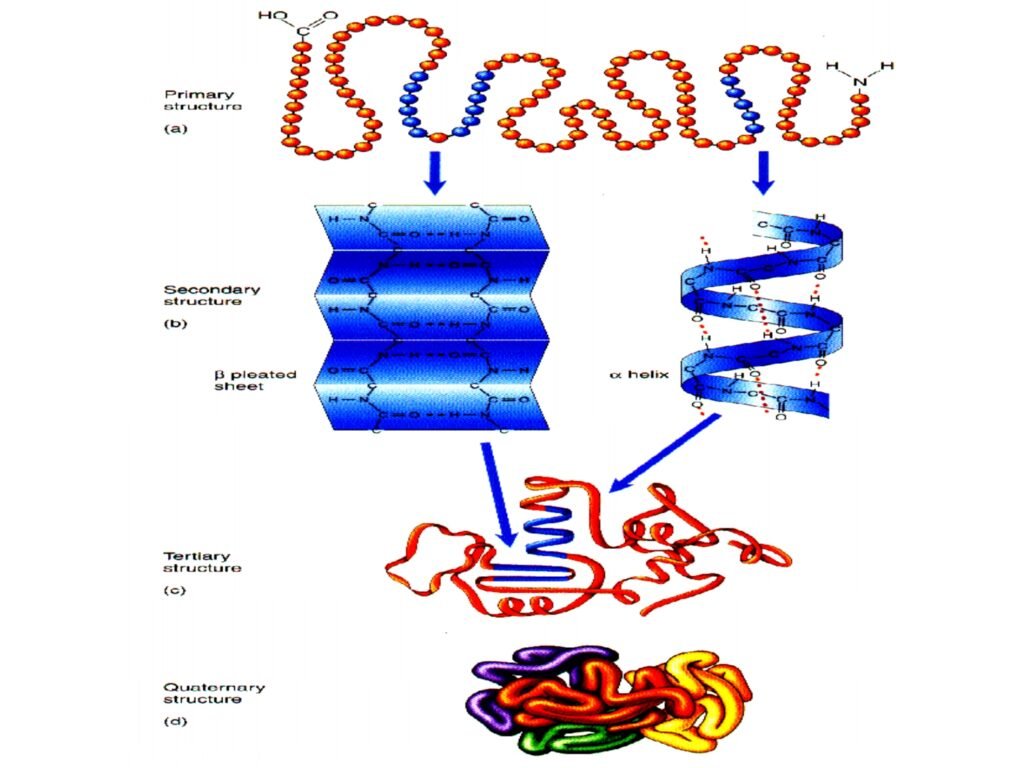
56 Syarah (Penjelasan) Slide ke-28
Slide ini memberikan visualisasi hierarki struktur protein mulai dari struktur primer hingga struktur kuartener, yang merupakan tingkatan organisasi protein berdasarkan interaksi antar asam amino dalam rantai polipeptida.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Primary structure (a) → Struktur primer
-
Primary → Primer (pertama, dasar)
-
Structure → Struktur
-
-
Secondary structure (b) → Struktur sekunder
-
Secondary → Sekunder (kedua, tingkat lanjut)
-
-
β pleated sheet → Lembar β-lipit
-
Pleated sheet → Lembaran berlipat
-
-
α helix → Heliks α
-
Tertiary structure (c) → Struktur tersier
-
Tertiary → Tersier (tingkat ketiga)
-
-
Quaternary structure (d) → Struktur kuartener
-
Quaternary → Kuartener (tingkat keempat)
-
2. Penjelasan Konseptual tentang Struktur Protein
A. Struktur Primer
🧬 Struktur primer merupakan urutan linier asam amino dalam rantai polipeptida, yang ditentukan oleh kode genetik (mRNA).
🧬 Setiap asam amino dalam rantai ini dihubungkan oleh ikatan peptida.
🧬 Contoh protein dengan struktur primer yang sederhana adalah insulin.
B. Struktur Sekunder
🔄 Struktur sekunder terbentuk akibat ikatan hidrogen antara gugus karbonil (-C=O) dan gugus amina (-N-H) dalam rantai utama polipeptida.
🔄 Ada dua bentuk utama struktur sekunder:
-
α-heliks → Spiral berpilin yang distabilkan oleh ikatan hidrogen intramolekuler. Contohnya: keratin pada rambut.
-
β-pleated sheet → Lembaran berlipat yang ditahan oleh ikatan hidrogen antarmolekul. Contohnya: sutra fibroin.
C. Struktur Tersier
🔹 Struktur tersier merupakan konformasi tiga dimensi dari satu rantai polipeptida yang terbentuk melalui interaksi:
-
Ikatan hidrogen (antara gugus polar)
-
Ikatan disulfida (-S-S-) (antara residu sistein)
-
Interaksi hidrofobik (penyusunan asam amino non-polar ke bagian dalam protein)
-
Ikatan ionik (antara residu bermuatan positif dan negatif)
🔹 Contoh protein dengan struktur tersier:
-
Miosin dalam otot
-
Enzim katalase dalam sel
D. Struktur Kuartener
🔗 Struktur kuartener terbentuk ketika dua atau lebih rantai polipeptida tersier berasosiasi menjadi satu kesatuan fungsional.
🔗 Interaksi ini dikendalikan oleh ikatan hidrogen, ikatan ionik, dan interaksi hidrofobik.
🔗 Contoh protein dengan struktur kuartener:
-
Hemoglobin (terdiri dari 4 rantai polipeptida)
-
DNA polimerase (enzim dengan banyak subunit)
3. Kesimpulan
✅ Struktur primer menentukan urutan asam amino dalam protein.
✅ Struktur sekunder membentuk pola heliks α atau lembar β-lipit melalui ikatan hidrogen.
✅ Struktur tersier merupakan bentuk lipatan tiga dimensi dari rantai polipeptida akibat interaksi gugus R.
✅ Struktur kuartener adalah gabungan beberapa polipeptida untuk membentuk protein fungsional.
Slide ini menjelaskan hierarki organisasi protein, yang sangat penting dalam memahami fungsi biologis protein dalam sel. 🚀
58 Syarah (Penjelasan) Slide ke-29
Slide ini menyajikan gambaran tahapan hierarki struktur protein dari struktur primer hingga struktur kuartener, dengan ilustrasi yang memperjelas perbedaan masing-masing tingkat organisasi.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Primary protein structure → Struktur protein primer
-
Primary → Primer (pertama, dasar)
-
Protein structure → Struktur protein
-
-
Amino Acids → Asam amino
-
Secondary protein structure → Struktur protein sekunder
-
Secondary → Sekunder (kedua, tingkat lanjut)
-
-
Pleated sheet → Lembar berlipat (β-sheet)
-
Alpha helix → Heliks alfa (α-helix)
-
Tertiary protein structure → Struktur protein tersier
-
Tertiary → Tersier (tingkat ketiga)
-
-
Quaternary protein structure → Struktur protein kuartener
-
Quaternary → Kuartener (tingkat keempat)
-
-
Certain attractions are present → Interaksi spesifik terjadi
-
More than one amino acid chain → Lebih dari satu rantai asam amino
2. Penjelasan Konseptual tentang Struktur Protein
A. Struktur Primer (Primary Structure)
🧬 Struktur primer adalah urutan linear asam amino dalam rantai polipeptida yang disusun oleh ikatan peptida.
🧬 Urutan ini menentukan fungsi akhir protein, seperti pada insulin dan hemoglobin.
🧬 Penyusunan urutan ini dikodekan oleh DNA dan diekspresikan melalui mRNA.
B. Struktur Sekunder (Secondary Structure)
🔄 Struktur sekunder terbentuk akibat ikatan hidrogen antara gugus karbonil (-C=O) dan gugus amina (-N-H) dalam rantai utama polipeptida.
🔄 Dua pola utama struktur sekunder:
-
α-heliks → Spiral berpilin yang stabil oleh ikatan hidrogen intramolekul. Contoh: keratin dalam rambut.
-
β-pleated sheet → Lembaran berlipat yang stabil oleh ikatan hidrogen antarmolekul. Contoh: sutra fibroin.
C. Struktur Tersier (Tertiary Structure)
🔹 Struktur tersier adalah konformasi tiga dimensi dari polipeptida yang distabilkan oleh berbagai interaksi:
-
Ikatan hidrogen (antara gugus polar)
-
Ikatan disulfida (-S-S-) (antara residu sistein)
-
Interaksi hidrofobik (penyusunan asam amino non-polar ke bagian dalam protein)
-
Ikatan ionik (antara residu bermuatan positif dan negatif)
🔹 Contoh: Enzim katalase, miosin dalam otot.
D. Struktur Kuartener (Quaternary Structure)
🔗 Struktur kuartener terbentuk dari lebih dari satu rantai polipeptida yang bergabung melalui interaksi hidrofobik, ikatan hidrogen, dan interaksi ionik.
🔗 Contoh:
-
Hemoglobin (terdiri dari 4 rantai polipeptida)
-
Enzim DNA polimerase (memiliki banyak subunit)
3. Kesimpulan
✅ Struktur primer menentukan urutan asam amino.
✅ Struktur sekunder membentuk pola heliks α atau lembar β-lipit melalui ikatan hidrogen.
✅ Struktur tersier menciptakan bentuk tiga dimensi protein melalui ikatan hidrogen, disulfida, dan hidrofobik.
✅ Struktur kuartener adalah gabungan beberapa polipeptida untuk membentuk protein fungsional.
Struktur protein ini sangat penting dalam memahami biokimia molekuler, terutama dalam bidang enzimologi, bioinformatika, dan desain obat berbasis protein. 🚀
60 Syarah (Penjelasan) Slide ke-30
Slide ini memberikan representasi skematis dari hierarki struktur protein, mulai dari struktur primer hingga struktur kuartener.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Protein structure → Struktur protein
-
α-helix → Heliks alfa
-
β-sheet → Lembar β (Beta-pleated sheet)
-
Secondary structure → Struktur sekunder
-
Tertiary structure → Struktur tersier
-
Quaternary structure → Struktur kuartener
-
E-G-A-K → Urutan asam amino dalam struktur primer
2. Penjelasan Ilmiah tentang Hierarki Struktur Protein
A. Struktur Primer
🧬 Struktur primer adalah urutan linear asam amino yang disusun oleh ikatan peptida.
🧬 Urutan ini menentukan sifat dan fungsi protein, seperti dalam enzim, hormon, dan antibodi.
🧬 Contoh: Urutan asam amino dalam insulin menentukan bagaimana protein tersebut dapat mengontrol kadar glukosa darah.
B. Struktur Sekunder
🔄 Struktur sekunder dibentuk oleh ikatan hidrogen antara gugus karbonil (-C=O) dan gugus amina (-N-H) dalam rantai utama polipeptida.
🔄 Terdiri dari:
-
α-heliks → Bentuk spiral yang distabilkan oleh ikatan hidrogen intramolekul.
✅ Contoh: Keratin dalam rambut. -
β-pleated sheet → Lembaran berlipat yang distabilkan oleh ikatan hidrogen antarmolekul.
✅ Contoh: Protein sutra fibroin.
C. Struktur Tersier
🔹 Struktur tersier adalah bentuk tiga dimensi dari polipeptida yang stabil karena berbagai interaksi:
-
Ikatan hidrogen (antara gugus polar)
-
Ikatan disulfida (-S-S-) (antara residu sistein)
-
Interaksi hidrofobik (menyusun asam amino non-polar ke bagian dalam protein)
-
Ikatan ionik (antara asam amino bermuatan positif dan negatif)
🔹 Contoh: -
Enzim katalase
-
Miosin dalam otot
D. Struktur Kuartener
🔗 Struktur kuartener terbentuk dari lebih dari satu rantai polipeptida yang berikatan melalui interaksi hidrofobik, ikatan hidrogen, dan ikatan ionik.
🔗 Contoh:
-
Hemoglobin (memiliki 4 subunit polipeptida yang bekerja sama dalam mengikat oksigen).
-
DNA polimerase (enzim dengan berbagai subunit untuk replikasi DNA).
3. Kesimpulan
✅ Struktur primer adalah urutan linear asam amino yang menentukan sifat protein.
✅ Struktur sekunder membentuk pola α-heliks dan β-sheet melalui ikatan hidrogen.
✅ Struktur tersier menciptakan bentuk tiga dimensi melalui interaksi hidrofobik, disulfida, dan ionik.
✅ Struktur kuartener terdiri dari beberapa polipeptida yang bekerja sama membentuk protein fungsional.
Struktur protein ini sangat penting dalam memahami fungsi biologis dan interaksi molekuler dalam sistem kehidupan, terutama dalam enzimologi, bioinformatika, dan desain obat berbasis protein. 🚀
62 Syarah (Penjelasan) Slide ke-31
Slide ini menggambarkan struktur sekunder protein, yang terdiri dari α-heliks dan β-pleated sheet, sebagai hasil interaksi ikatan hidrogen antar subunit asam amino.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Amino acid subunits → Subunit asam amino
-
β pleated sheet → Lembar β (Beta-pleated sheet)
-
α heli (α-helix) → Heliks alfa
2. Penjelasan Ilmiah tentang Struktur Sekunder Protein
A. Apa Itu Struktur Sekunder?
🔬 Struktur sekunder protein adalah pola lipatan awal dari rantai polipeptida yang terjadi akibat ikatan hidrogen antara gugus karbonil (-C=O) dan gugus amina (-N-H).
⚛ Ikatan hidrogen terbentuk antara asam amino yang berdekatan dalam rantai polipeptida, menghasilkan dua struktur utama:
1️⃣ α-Heliks (Alpha-helix)
2️⃣ β-Sheet (Beta-pleated sheet)
B. α-Heliks (Alpha-helix)
🌀 α-Heliks adalah struktur berbentuk spiral yang distabilkan oleh ikatan hidrogen intramolekul antara setiap residu asam amino ke empat residu di atasnya.
🌀 Ciri-ciri utama:
-
Struktur kompak dan silindris.
-
Ikatan hidrogen sejajar dengan sumbu heliks.
-
Terdapat pada keratin rambut, kuku, dan enzim tertentu.
-
Residu prolin jarang ditemukan dalam α-heliks karena menyebabkan tekukan (bending).
✅ Contoh protein dengan α-heliks:
-
Keratin (pada rambut, kulit, kuku).
-
Miosin (pada otot).
-
Hemoglobin (struktur sebagian terdiri dari α-heliks).
C. β-Sheet (Beta-pleated sheet)
📄 β-Sheet adalah struktur yang terdiri dari lembaran polipeptida yang berlipat-lipat, distabilkan oleh ikatan hidrogen antara rantai polipeptida yang sejajar atau antiparalel.
📄 Ciri-ciri utama:
-
Struktur datar dan melipat seperti lipatan kertas.
-
Ikatan hidrogen terjadi antara rantai polipeptida yang berdekatan.
-
Lebih stabil dibanding α-heliks.
-
Terdapat pada fibroin sutra dan enzim tertentu.
✅ Contoh protein dengan β-sheet:
-
Fibroin (sutra laba-laba dan ulat sutra).
-
Protein enzimatik tertentu (misalnya enzim dalam sistem metabolisme).
3. Kesimpulan
✅ Struktur sekunder protein dibentuk oleh ikatan hidrogen, menciptakan pola α-heliks atau β-sheet.
✅ α-Heliks memiliki bentuk spiral kompak, ditemukan dalam keratin dan miosin.
✅ β-Sheet memiliki struktur berlipat-lipat seperti lembaran, ditemukan dalam fibroin sutra.
✅ Kedua struktur ini stabil dan membentuk dasar dari struktur tersier dan kuartener protein.
Struktur sekunder ini mempengaruhi fleksibilitas dan kekuatan protein, berperan dalam fungsi biologis seperti enzim, hormon, dan protein struktural. 🔬
64 Syarah (Penjelasan) Slide ke-32
Slide ini menjelaskan denaturasi protein, yaitu perubahan struktur tiga dimensi protein akibat faktor lingkungan seperti panas, pH, tekanan mekanik, dan bahan kimia.
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Denaturasi → Denaturation
-
Bila susunan ruang/rantai polipeptida suatu molekul protein berubah
→ If the spatial arrangement/polypeptide chain of a protein molecule changes. -
Penyebab → Causes
-
Panas, pH, mekanik, bahan kimia
→ Heat, pH, mechanical forces, chemicals
2. Penjelasan Ilmiah tentang Denaturasi Protein
A. Apa Itu Denaturasi Protein?
⚠ Denaturasi protein adalah perubahan struktur sekunder, tersier, atau kuartener akibat gangguan pada ikatan non-kovalen dalam protein, sehingga protein kehilangan fungsinya.
🔬 Denaturasi tidak memutuskan ikatan peptida dalam struktur primer, tetapi mengganggu ikatan hidrogen, interaksi hidrofobik, dan ikatan disulfida yang menjaga bentuk protein.
B. Penyebab Denaturasi Protein
1️⃣ Panas (Heat)🔥
-
Suhu tinggi merusak ikatan hidrogen, menyebabkan protein menggumpal atau terurai.
-
Contoh: Putih telur yang dipanaskan berubah dari cair menjadi padat akibat denaturasi albumin.
2️⃣ Perubahan pH 🧪
-
Ionisasi gugus karboksil (-COO⁻) dan amina (-NH₃⁺) terganggu, menyebabkan perubahan ikatan elektrostatik dalam protein.
-
Contoh: Enzim pepsin aktif pada pH asam (pH 2), tetapi kehilangan fungsi di pH netral.
3️⃣ Faktor Mekanik (Mechanical forces)⚙️
-
Goncangan, gesekan, atau pencampuran kuat dapat mengganggu struktur protein.
-
Contoh: Membuihkan putih telur menyebabkan perubahan struktur albumin.
4️⃣ Bahan Kimia (Chemical Agents)☠️
-
Urea, deterjen, logam berat (Hg²⁺, Pb²⁺), atau alkohol dapat menghancurkan ikatan hidrogen dalam protein.
-
Contoh: Etanol 70% digunakan untuk membunuh bakteri dengan mendestabilisasi membran protein seluler.
C. Contoh Denaturasi Protein dalam Kehidupan Sehari-hari
✅ Memasak daging dan telur → Denaturasi protein akibat panas.
✅ Susu basi → Protein susu mengalami denaturasi karena perubahan pH.
✅ Racun logam berat (misalnya merkuri, timbal) → Menghambat enzim dengan mendestabilisasi strukturnya.
✅ Pemakaian alkohol untuk sterilisasi → Alkohol menghancurkan struktur protein mikroorganisme.
3. Kesimpulan
✅ Denaturasi protein menyebabkan kehilangan fungsi protein.
✅ Penyebab utama: suhu tinggi, pH ekstrem, tekanan mekanik, dan bahan kimia.
✅ Struktur primer tetap utuh, tetapi bentuk tiga dimensi protein terganggu.
✅ Fenomena ini banyak terjadi dalam proses biologis, industri makanan, dan sterilisasi.
Slide ini menunjukkan perubahan dari struktur tersier protein menjadi rantai polipeptida akibat denaturasi. Fenomena ini tidak selalu dapat dikembalikan (irreversible denaturation), tetapi dalam beberapa kasus bisa pulih (reversible denaturation). 🔬
66 Syarah (Penjelasan) Slide ke-33
Slide ini menunjukkan denaturasi protein sebagai perubahan dari struktur asli (native form) menjadi random coil (struktur acak) serta kemungkinan renaturasi (pemulihan struktur asli).
1. Makna Per Kata atau Frasa dalam Bahasa Inggris
-
Native Form → Bentuk Asli
-
Denature → Denaturasi (Perubahan bentuk struktur protein)
-
Renature → Renaturasi (Pemulihan bentuk asli protein)
-
Random Coil → Struktur Acak
2. Penjelasan Ilmiah tentang Denaturasi dan Renaturasi Protein
A. Denaturasi: Kehilangan Struktur Protein
🔬 Denaturasi adalah proses di mana protein kehilangan struktur tiga dimensinya akibat gangguan pada ikatan hidrogen, interaksi hidrofobik, dan ikatan disulfida.
💡 Ciri utama denaturasi protein:
✅ Struktur tersier dan kuartener terurai → Membentuk rantai polipeptida acak (random coil)
✅ Protein kehilangan fungsinya → Tidak bisa lagi bekerja sebagai enzim, hormon, atau transporter
🛑 Contoh denaturasi protein:
-
Telur yang dimasak → Albumin berubah dari cair menjadi padat.
-
Demam tinggi merusak enzim dalam tubuh.
-
Sterilisasi dengan alkohol → Menghancurkan struktur protein bakteri.
B. Renaturasi: Apakah Protein Bisa Kembali ke Bentuk Asli?
🔄 Renaturasi protein adalah proses pemulihan kembali struktur asli setelah mengalami denaturasi, tetapi hanya mungkin jika ikatan non-kovalen tidak rusak permanen.
✅ Contoh protein yang bisa mengalami renaturasi:
-
Ribonulease A → Bisa kembali ke struktur asli setelah penghilangan urea dan β-merkaptoetanol.
-
Protein chaperone → Membantu beberapa protein untuk kembali ke bentuk fungsionalnya.
🛑 Namun, banyak protein yang mengalami denaturasi tidak dapat kembali ke bentuk semula karena ikatan yang rusak terlalu kompleks untuk dipulihkan.
3. Kesimpulan
✅ Denaturasi mengubah protein dari bentuk terlipat menjadi rantai acak, menghilangkan fungsinya.
✅ Penyebab utama denaturasi: suhu tinggi, perubahan pH, tekanan mekanik, dan bahan kimia.
✅ Renaturasi hanya terjadi pada beberapa protein yang tidak mengalami kerusakan permanen.
✅ Dalam banyak kasus, denaturasi bersifat irreversible (tidak dapat kembali).
Slide ini menggambarkan proses denaturasi dan kemungkinan renaturasi protein, menunjukkan bahwa dalam kondisi tertentu, struktur protein dapat pulih, tetapi sering kali kehilangan fungsi secara permanen. 🔬
68 Syarah (Penjelasan) Slide ke-34
Slide ini membahas klasifikasi protein berdasarkan fungsi biologisnya dalam sistem kehidupan.
1. Makna dan Penjelasan Ilmiah
1️⃣ ENZIM
🔬 Fungsi: Protein yang bertindak sebagai katalis biologis dalam reaksi kimia.
✅ Mempercepat reaksi tanpa ikut habis dalam reaksi tersebut.
✅ Menurunkan energi aktivasi, sehingga reaksi berlangsung lebih cepat.
📌 Contoh:
-
Ribonuklease → Menghidrolisis RNA menjadi nukleotida.
-
Tripsin → Enzim pencernaan yang memecah protein di usus halus.
2️⃣ PROTEIN NUTRIEN DAN PENYIMPAN
🔬 Fungsi: Menyimpan zat gizi dan ion penting bagi tubuh.
✅ Sebagai cadangan energi dan zat penting untuk pertumbuhan.
📌 Contoh:
-
Ovalbumin → Protein utama dalam putih telur, sebagai cadangan asam amino untuk embrio.
-
Kasein → Protein dalam susu yang menyediakan nutrisi bagi bayi mamalia.
-
Ferritin → Menyimpan zat besi dalam tubuh untuk mencegah defisiensi.
3️⃣ PROTEIN TRANSPORT
🔬 Fungsi: Membantu pergerakan zat dalam tubuh, baik dalam darah maupun membran sel.
✅ Mengikat dan membawa molekul penting seperti oksigen, ion, dan nutrisi.
📌 Contoh:
-
Hemoglobin → Mengangkut oksigen dari paru-paru ke seluruh tubuh.
-
Albumin → Mengangkut asam lemak dan hormon dalam darah.
4️⃣ PROTEIN KONTRAKTIL
🔬 Fungsi: Memungkinkan pergerakan otot dengan cara kontraksi dan relaksasi.
✅ Menghasilkan gaya mekanik untuk gerakan tubuh.
📌 Contoh:
-
Aktin & Miosin → Protein utama dalam otot yang memungkinkan kontraksi.
2. Kesimpulan
✅ Protein memiliki berbagai fungsi esensial dalam tubuh, tidak hanya sebagai sumber energi tetapi juga dalam katalisis reaksi, penyimpanan, transportasi, dan gerakan.
✅ Enzim mempercepat reaksi, protein nutrien menyimpan zat penting, protein transport mengangkut molekul, dan protein kontraktil memungkinkan gerakan.
🔬 Pemahaman tentang fungsi protein penting dalam biokimia, farmasi, dan bioteknologi, terutama dalam pengembangan obat dan terapi penyakit.
70 Syarah (Penjelasan) Slide ke-35
Slide ini membahas beberapa jenis protein berdasarkan fungsi spesifiknya dalam tubuh manusia dan organisme lainnya.
1. Makna dan Penjelasan Ilmiah
1️⃣ PROTEIN STRUKTURAL
🔬 Fungsi:
✅ Memberikan dukungan mekanik dan kekuatan pada sel dan jaringan.
✅ Berperan dalam pembentukan dan stabilitas jaringan tubuh.
📌 Contoh:
-
Kolagen → Protein utama dalam kulit, tulang, tendon, dan ligamen.
-
Elastin → Memberikan elastisitas pada jaringan seperti pembuluh darah dan paru-paru.
-
Keratina → Protein utama pada rambut, kuku, dan lapisan luar kulit.
2️⃣ PROTEIN PERTAHANAN
🔬 Fungsi:
✅ Melindungi tubuh dari infeksi virus, bakteri, dan patogen lainnya.
✅ Berperan dalam respon imun adaptif dan bawaan.
📌 Contoh:
-
Antibodi (Imunoglobulin) → Protein yang diproduksi oleh sel B untuk mengenali dan menetralkan patogen.
-
Komplemen → Sekumpulan protein yang membantu dalam penghancuran patogen melalui lisis sel.
3️⃣ PROTEIN PENGATUR
🔬 Fungsi:
✅ Mengontrol proses fisiologis dan metabolisme tubuh.
✅ Berperan dalam pengaturan kadar zat dalam darah dan komunikasi antar sel.
📌 Contoh:
-
Hormon Insulin → Mengatur kadar glukosa dalam darah dengan merangsang penyerapan glukosa oleh sel.
-
Hormon Pertumbuhan (GH) → Mengontrol pertumbuhan dan regenerasi sel.
4️⃣ PROTEIN GENETIK
🔬 Fungsi:
✅ Berperan dalam pengemasan dan ekspresi informasi genetik.
✅ Membantu dalam replikasi, transkripsi, dan regulasi DNA.
📌 Contoh:
-
Nukleoprotein → Protein yang berikatan dengan asam nukleat (DNA/RNA), misalnya histon.
-
Histon → Protein utama dalam kromatin yang membantu pengemasan DNA dalam inti sel.
2. Kesimpulan
✅ Protein memiliki peran penting dalam berbagai aspek kehidupan, mulai dari struktur tubuh, sistem imun, regulasi metabolisme, hingga ekspresi genetik.
✅ Keberagaman fungsi protein ini menunjukkan kompleksitas dan pentingnya protein dalam keberlangsungan kehidupan.
🔬 Pemahaman tentang fungsi protein ini sangat relevan dalam bidang biomedis, farmasi, dan bioteknologi, terutama dalam penelitian terapi penyakit dan pengembangan obat.
72 Syarah (Penjelasan) Slide ke-36
Slide ini menjelaskan berbagai protein struktural yang memiliki peran utama dalam membentuk, menopang, dan menjaga kekuatan jaringan tubuh.
1. Makna dan Penjelasan Ilmiah
🔬 Structural Proteins adalah kelompok protein yang berfungsi sebagai kerangka utama dalam tubuh, memberikan dukungan mekanik dan elastisitas pada berbagai jaringan.
📌 Contoh dan Fungsinya:
1️⃣ Keratin
✅ Terdapat pada:
-
Rambut
-
Kuku
-
Lapisan luar kulit
✅ Fungsi: -
Memberikan kekakuan dan perlindungan dari kerusakan mekanik.
-
Mencegah dehidrasi dengan membentuk lapisan tahan air pada kulit.
2️⃣ Kolagen
✅ Terdapat pada:
-
Kulit
-
Ligamen
-
Tendon
-
Kornea mata
✅ Fungsi: -
Memberikan kekuatan dan fleksibilitas pada jaringan.
-
Berperan dalam proses penyembuhan luka dan regenerasi sel.
3️⃣ Miosin (Myosin) dan Protein Otot Lainnya
✅ Terdapat pada:
-
Otot rangka dan otot polos
✅ Fungsi: -
Berperan dalam kontraksi otot melalui interaksi dengan aktin.
4️⃣ Glikoprotein pada Kartilago
✅ Terdapat pada:
-
Tulang rawan (cartilage)
✅ Fungsi: -
Memberikan elastisitas dan fleksibilitas pada sendi.
-
Berperan dalam menjaga bantalan sendi untuk mengurangi gesekan antar tulang.
5️⃣ Ligamen (Collagen + Glycoproteins)
✅ Terdapat pada:
-
Ligamen (penghubung antar tulang)
✅ Fungsi: -
Memungkinkan gerakan sendi yang stabil.
-
Mengurangi risiko cedera akibat pergerakan ekstrem.
6️⃣ Kornea Mata (Collagen + Keratin)
✅ Fungsi:
-
Membantu menjaga bentuk kornea sehingga cahaya dapat dibiaskan dengan benar ke retina.
-
Berperan dalam kejernihan dan kekuatan kornea mata.
2. Hubungan dengan Gambar Anak dalam Slide
👦 Gambar anak yang terlihat lesu dan mengalami malnutrisi dalam slide ini kemungkinan merujuk pada defisiensi protein, yang dapat menyebabkan:
✅ Pertumbuhan rambut dan kuku yang buruk.
✅ Kulit kering dan kurang elastis akibat kurangnya kolagen.
✅ Gangguan otot dan tulang karena kurangnya protein struktural dalam kartilago dan ligamen.
3. Kesimpulan
✅ Protein struktural sangat penting dalam membangun dan menopang jaringan tubuh.
✅ Defisiensi protein dapat menyebabkan berbagai gangguan kesehatan, termasuk kelemahan otot, kulit rapuh, dan pertumbuhan rambut serta kuku yang tidak optimal.
74 Syarah (Penjelasan) Slide ke-37
Slide ini membahas Protein Serabut (Fibrous Proteins) yang merupakan kategori protein berdasarkan bentuk atau konformasi molekulnya.
1. Makna dan Penjelasan Ilmiah
🧬 Protein serabut (fibrous proteins) adalah protein yang memiliki struktur panjang dan tidak berlipat-lipat, berbeda dengan protein globular yang berbentuk bola atau globular.
📌 Karakteristik utama protein serabut:
1️⃣ Bentuk
✅ Memanjang dalam satu sumbu tanpa struktur tersusun rumit.
✅ Tidak berlipat-lipat seperti protein globular.
2️⃣ Kelompok Protein Struktural
✅ Berperan dalam menyusun struktur tubuh seperti rambut, kulit, dan tendon.
✅ Tidak larut dalam air atau pelarut encer karena strukturnya yang kaku dan padat.
3️⃣ Fungsi Umum
✅ Memberikan kekuatan dan perlindungan pada jaringan tubuh.
✅ Menjaga stabilitas mekanik jaringan tubuh.
2. Contoh Protein Serabut
🧪 α-Keratin
✅ Terdapat pada:
-
Rambut
-
Kuku
-
Epidermis kulit
✅ Fungsi: -
Memberikan kekerasan dan perlindungan.
-
Mencegah kerusakan fisik dan dehidrasi pada jaringan luar tubuh.
🧪 Kolagen
✅ Terdapat pada:
-
Kulit
-
Ligamen
-
Tendon
✅ Fungsi: -
Memberikan elastisitas dan ketahanan pada jaringan ikat.
-
Berperan dalam proses penyembuhan luka dan regenerasi sel.
3. Perbedaan Protein Serabut dan Protein Globular
| Protein Serabut | Protein Globular |
|---|---|
| Memanjang & tidak berlipat | Bentuk bulat/lipatan kompleks |
| Tidak larut dalam air | Larut dalam air |
| Fungsi struktural & mekanik | Fungsi metabolik & katalitik |
| Contoh: Kolagen, α-Keratin | Contoh: Enzim, Hemoglobin, Antibodi |
4. Kesimpulan
✅ Protein serabut memiliki peran utama sebagai protein struktural dalam tubuh.
✅ Strukturnya yang panjang dan tidak berlipat membuatnya kuat serta tidak larut dalam air.
✅ Contoh utama: α-Keratin dalam rambut/kuku dan Kolagen dalam kulit/ligamen.
76 Syarah (Penjelasan) Slide ke-38
Slide ini menjelaskan tentang Protein Globular, jenis protein yang memiliki struktur lipatan kompleks dan fungsi metabolik yang luas.
1. Makna dan Penjelasan Ilmiah
🧬 Protein globular adalah protein dengan rantai polipeptida yang terlipat rapat membentuk struktur bulat atau elipsoid.
📌 Karakteristik utama protein globular:
1️⃣ Bentuk
✅ Struktur tiga dimensi yang kompak dan tidak memanjang seperti protein serabut.
✅ Terlipat rapat karena interaksi hidrofobik di dalamnya.
2️⃣ Kelompok Protein Fungsional
✅ Berperan dalam metabolisme seluler, katalisis reaksi kimia, transportasi, hingga pertahanan tubuh.
✅ Mudah larut dalam air atau cairan biologis, sehingga dapat bersirkulasi dalam tubuh.
3️⃣ Sifat Kimia
✅ Mudah mengalami denaturasi, kehilangan bentuk dan fungsi akibat perubahan suhu, pH, atau zat kimia tertentu.
2. Contoh Protein Globular
🧪 Antibodi (Imunoglobulin)
✅ Fungsi:
-
Melawan patogen dan toksin dalam sistem kekebalan tubuh.
-
Mengidentifikasi antigen dan menandainya untuk dihancurkan oleh sel imun.
🧪 Protein Penyimpan (Ferritin, Ovalbumin)
✅ Fungsi:
-
Ferritin: Menyimpan zat besi dalam tubuh.
-
Ovalbumin: Protein utama dalam putih telur yang berfungsi sebagai cadangan nutrisi.
🧪 Protein Transport (Hemoglobin, Albumin)
✅ Fungsi:
-
Hemoglobin: Mengangkut oksigen dalam darah.
-
Albumin: Mengangkut molekul dalam plasma darah, seperti hormon dan asam lemak.
🧪 Protein dalam Bahan Makanan (Susu, Telur)
✅ Fungsi:
-
Menyediakan sumber asam amino esensial.
-
Berperan dalam pertumbuhan dan pemeliharaan jaringan tubuh.
3. Perbedaan Protein Globular dan Protein Serabut
| Protein Globular | Protein Serabut |
|---|---|
| Bentuk bulat/lipatan kompleks | Memanjang & tidak berlipat |
| Larut dalam air | Tidak larut dalam air |
| Fungsi metabolik, enzimatik, transportasi | Fungsi struktural & mekanik |
| Contoh: Hemoglobin, Enzim, Antibodi | Contoh: Kolagen, α-Keratin |
4. Kesimpulan
✅ Protein globular memiliki fungsi metabolik penting dalam tubuh, seperti enzim, transportasi, dan pertahanan tubuh.
✅ Strukturnya yang kompak dan larut dalam air memungkinkannya berperan dalam banyak reaksi biologis.
✅ Contoh utama: Hemoglobin (transportasi oksigen), Antibodi (imunitas), dan Ovalbumin (penyimpanan nutrisi dalam telur).
78 Syarah (Penjelasan) Slide ke-39
Slide ini membahas klasifikasi protein berdasarkan kelarutannya, yang sangat penting dalam memahami sifat fisikokimia protein dalam berbagai sistem biologis dan industri pangan.
1. Makna dan Penjelasan Ilmiah
🧪 Kelarutan protein ditentukan oleh interaksi antar molekul protein dengan pelarut, seperti air, alkohol, larutan garam, atau larutan asam/basa.
📌 Faktor yang memengaruhi kelarutan protein:
✅ Struktur molekul protein
✅ Kandungan asam amino polar dan nonpolar
✅ pH larutan
✅ Konsentrasi garam, alkohol, atau zat lain dalam larutan
2. Jenis-Jenis Protein Berdasarkan Kelarutan
A. Albumin
📌 Ciri-ciri:
-
Larut dalam air.
-
Terkoagulasi oleh panas (akan menggumpal saat dipanaskan).
-
Dapat diendapkan dengan amonium sulfat [(NH₄)₂SO₄] jenuh.
📌 Contoh:
-
Laktalbumin (dalam susu).
-
Serum albumin (dalam darah).
-
Albumin telur (ovalbumin dalam putih telur).
B. Globulin
📌 Ciri-ciri:
-
Tidak larut dalam air, tetapi larut dalam larutan garam encer.
-
Terkoagulasi oleh panas.
📌 Contoh:
-
Globulin dalam plasma darah.
C. Glutelin
📌 Ciri-ciri:
-
Tidak larut dalam pelarut netral.
-
Larut dalam larutan asam atau basa encer.
📌 Contoh:
-
Glutenin (dalam gandum).
-
Oryzenin (dalam beras).
D. Prolamin/Gliadin
📌 Ciri-ciri:
-
Larut dalam alkohol 70%-80%.
📌 Contoh:
-
Gliadin dalam gandum (komponen gluten).
E. Histon
📌 Ciri-ciri:
-
Larut dalam air, tetapi tidak larut dalam amonia encer.
📌 Contoh:
-
Globin dalam hemoglobin.
F. Protamin
📌 Ciri-ciri:
-
Larut dalam air.
-
Tidak terkoagulasi oleh panas.
-
Membentuk garam dengan asam pekat.
3. Perbandingan Jenis Protein Kelarutan
| Jenis Protein | Kelarutan | Terkoagulasi Panas | Contoh |
|---|---|---|---|
| Albumin | Larut dalam air | Ya | Albumin telur |
| Globulin | Larut dalam larutan garam encer | Ya | Globulin darah |
| Glutelin | Larut dalam asam/basa encer | Ya | Glutenin (gandum) |
| Prolamin | Larut dalam alkohol 70-80% | Ya | Gliadin (gandum) |
| Histon | Larut dalam air | Tidak | Globin dalam hemoglobin |
| Protamin | Larut dalam air | Tidak | Protein sperma ikan |
4. Kesimpulan
✅ Protein dapat dikelompokkan berdasarkan sifat kelarutannya dalam air, alkohol, garam, atau asam/basa.
✅ Kelarutan ini berhubungan dengan struktur protein dan kandungan asam aminonya.
✅ Contoh aplikasi:
-
Albumin telur digunakan dalam industri makanan.
-
Gliadin dan glutenin penting dalam pembentukan tekstur roti.
-
Histon berperan dalam pembungkusan DNA dalam sel.
80 Syarah (Penjelasan) Slide ke-40
Slide ini membahas molekul hibrid, yaitu kombinasi antara karbohidrat dan protein atau peptida dan polisakarida dalam berbagai bentuk. Pemahaman mengenai molekul hibrid sangat penting dalam biologi sel, imunologi, dan biokimia struktural.
1. Definisi dan Karakteristik
🔹 Molekul hibrid adalah senyawa yang terbentuk dari dua komponen utama dengan karakteristik yang berbeda, yaitu protein dan karbohidrat atau peptida dan polisakarida.
🔹 Molekul ini berperan dalam berbagai fungsi biologis, seperti struktur sel, komunikasi antar sel, dan perlindungan organisme.
2. Jenis-Jenis Molekul Hibrid
A. Glikoprotein
🧪 Ciri-ciri:
-
Terdiri dari 1-30% karbohidrat (KH) dan 70% protein.
-
Mengandung oligosakarida linier atau bercabang yang melekat pada protein.
-
Banyak ditemukan pada permukaan luar sel hewan dan berperan dalam plasma darah, sistem imun, dan enzim.
📌 Contoh:
-
Imunoglobulin (antibodi)
-
Hormon eritropoietin
-
Protein membran sel
🧐 Fungsi:
✅ Interaksi seluler (misalnya, pada reseptor hormon).
✅ Mekanisme pertahanan tubuh (antibodi).
✅ Komunikasi antar sel.
B. Proteoglikan
🧪 Ciri-ciri:
-
Mengandung 95% polisakarida (karbohidrat) dan 5% protein.
-
Karbohidrat berupa unit disakarida berulang.
-
Banyak ditemukan dalam matriks ekstraseluler dan jaringan ikat.
📌 Contoh:
-
Aggrecan di tulang rawan.
-
Decorin dalam jaringan ikat.
🧐 Fungsi:
✅ Memberikan kekuatan mekanis pada jaringan ikat.
✅ Menjaga kelembaban dan fleksibilitas sel dan jaringan.
✅ Berperan dalam komunikasi seluler.
C. Peptidoglikan
🧪 Ciri-ciri:
-
Terdiri dari peptida yang terikat dengan polisakarida.
-
Merupakan komponen utama dinding sel bakteri.
📌 Contoh:
-
Lapisan peptidoglikan dalam dinding sel bakteri Gram-positif dan Gram-negatif.
🧐 Fungsi:
✅ Melindungi bakteri dari tekanan osmotik.
✅ Memberikan kekakuan dan bentuk pada sel bakteri.
✅ Menjadi target antibiotik (misalnya, penisilin menghambat sintesis peptidoglikan, menyebabkan lisis bakteri).
3. Kesimpulan
✅ Glikoprotein berperan dalam komunikasi sel dan sistem imun.
✅ Proteoglikan mendukung kekuatan dan fleksibilitas jaringan.
✅ Peptidoglikan merupakan penyusun utama dinding sel bakteri dan menjadi target antibiotik.
82 Syarah (Penjelasan) Slide ke-41
Slide ini berjudul "Metabolisme Asam Amino", yang merupakan topik dalam biokimia yang membahas bagaimana asam amino diolah dalam tubuh. Berikut adalah syarah dari topik ini:
Metabolisme berasal dari bahasa Yunani metabolē, yang berarti "perubahan". Dalam konteks biokimia, metabolisme merujuk pada semua reaksi kimia yang terjadi dalam sel untuk mempertahankan kehidupan. Reaksi metabolisme dapat dikategorikan menjadi anabolisme (reaksi yang membangun molekul kompleks dari molekul sederhana) dan katabolisme (reaksi yang memecah molekul kompleks menjadi molekul yang lebih sederhana untuk menghasilkan energi).
Asam amino adalah unit penyusun protein yang mengandung gugus amino (-NH₂) dan gugus karboksil (-COOH). Asam amino berperan penting dalam sintesis protein, sebagai prekursor senyawa biologis penting, serta dalam siklus metabolisme energi. Terdapat dua kategori utama asam amino: asam amino esensial, yang harus diperoleh dari makanan karena tubuh tidak dapat mensintesisnya, dan asam amino non-esensial, yang dapat diproduksi dalam tubuh.
Metabolisme asam amino mencakup berbagai jalur, termasuk:
-
Katabolisme asam amino, yang melibatkan reaksi deaminasi, transaminasi, dan dekarboksilasi, yang bertujuan untuk menghasilkan energi atau bahan baku metabolisme lain.
-
Sintesis asam amino, di mana beberapa asam amino non-esensial dapat dibentuk dari prekursor sederhana.
-
Konversi asam amino menjadi senyawa biologis lainnya, seperti neurotransmiter (misalnya dopamin dari tirosin) dan hormon (misalnya tiroksin dari tirosin).
-
Ekskresi nitrogen berlebih, yang melibatkan konversi amonia beracun menjadi urea melalui siklus urea.
Metabolisme asam amino memiliki peran krusial dalam keseimbangan nitrogen tubuh. Gangguan dalam jalur metabolisme ini dapat menyebabkan penyakit seperti fenilketonuria (PKU) dan alkaptonuria, yang merupakan akibat dari mutasi genetik yang mempengaruhi enzim tertentu dalam metabolisme asam amino.
84 Syarah (Penjelasan) Slide ke-42
Slide ini berjudul "Biosintesis Asam Amino", dengan fokus pada asam amino non-esensial. Berikut adalah syarah dari isi slide ini:
Biosintesis berasal dari kata bio (hidup) dan synthesis (pembentukan), yang berarti proses pembentukan molekul dalam sistem biologis. Dalam konteks ini, biosintesis asam amino mengacu pada serangkaian reaksi biokimia yang menghasilkan asam amino dari prekursor metabolik.
Asam amino non-esensial adalah jenis asam amino yang dapat disintesis oleh tubuh tanpa perlu diperoleh dari makanan. Proses biosintesisnya memanfaatkan berbagai senyawa antara yang berasal dari jalur metabolisme utama, seperti glikolisis dan siklus asam sitrat (siklus Krebs).
1. Senyawa antara dalam biosintesis asam amino non-esensial
Slide ini menyebutkan beberapa senyawa antara yang berperan dalam biosintesis asam amino non-esensial:
-
Piruvat → merupakan hasil akhir glikolisis yang dapat digunakan untuk sintesis alanin melalui reaksi transaminasi.
-
Glutamat → memainkan peran penting sebagai donor gugus amino dalam banyak reaksi transaminasi.
-
Oksaloasetat → merupakan perantara dalam siklus Krebs yang dapat dikonversi menjadi aspartat.
-
α-Ketoglutarat → merupakan prekursor utama dalam sintesis glutamat dan turunannya seperti glutamin, prolin, dan arginin.
-
Aspartat → dapat berperan sebagai prekursor untuk sintesis asparagin dan beberapa senyawa biologis lainnya.
2. Asam amino non-esensial dapat disintesis dari:
-
Asam amino non-esensial lainnya
Beberapa asam amino non-esensial dapat dibuat dari asam amino non-esensial lainnya. Misalnya, glutamat dapat dikonversi menjadi glutamin dengan tambahan gugus amida, sementara serin dapat diubah menjadi glisin melalui reaksi transfer gugus hidroksimetil. -
Asam amino esensial
Beberapa asam amino non-esensial dapat disintesis dari asam amino esensial. Contohnya, tirosin disintesis dari fenilalanin melalui reaksi hidroksilasi yang dikatalisis oleh enzim fenilalanin hidroksilase. Jika enzim ini mengalami mutasi atau defisiensi, akan terjadi gangguan metabolik seperti fenilketonuria (PKU).
Dengan memahami biosintesis asam amino non-esensial, kita dapat lebih memahami bagaimana tubuh menjaga keseimbangan asam amino untuk mendukung sintesis protein dan fungsi fisiologis lainnya.
86 Syarah (Penjelasan) Slide ke-43
Slide ini menampilkan diagram jalur biosintesis asam amino yang menunjukkan hubungan metabolik antara berbagai asam amino dalam tubuh. Diagram ini mengelompokkan asam amino berdasarkan jalur metaboliknya dan prekursor utama yang digunakan dalam biosintesisnya. Berikut adalah syarah dari slide ini:
1. Kelompok Asam Amino Berdasarkan Jalur Biosintesisnya
Asam amino dapat diklasifikasikan berdasarkan prekursor metabolik yang digunakan dalam biosintesisnya:
a. Keluarga Aspartat (Aspartate Family)
Prekursor utama: Oksaloasetat
-
Aspartat → disintesis langsung dari oksaloasetat melalui reaksi transaminasi.
-
Asparagin → dibuat dari aspartat dengan penambahan gugus amida dari glutamin.
-
Lisin → disintesis melalui jalur yang melibatkan aspartat β-semialdehida dan diaminopimelate.
-
Metionin → berasal dari homoserin melalui jalur yang melibatkan S-adenosilmetionin (SAM), yang berperan dalam transfer gugus metil.
-
Treonin → dibentuk dari aspartat β-semialdehida dan menjadi prekursor untuk sintesis isoleusin.
-
Isoleusin → dapat disintesis dari treonin atau piruvat.
b. Keluarga Glutamat (Glutamate Family)
Prekursor utama: α-Ketoglutarat
-
Glutamat → dibentuk dari α-ketoglutarat melalui transaminasi atau reaksi deaminasi glutamat dehidrogenase.
-
Glutamin → dibuat dari glutamat dengan enzim glutamin sintetase.
-
Prolin → berasal dari glutamat melalui pembentukan glutamat semialdehida.
-
Arginin → dibentuk melalui jalur urea yang melibatkan siklus ornitin.
-
Lisin (pada fungi) → disintesis melalui jalur α-ketoglutarat.
c. Keluarga Serin (Serine Family)
Prekursor utama: 3-Fosfogliserat
-
Serin → berasal dari 3-fosfogliserat, suatu perantara dalam jalur glikolisis.
-
Glicin → disintesis dari serin melalui reaksi yang dikatalisis oleh serin hidroksimetiltransferase.
-
Sistein → dibuat dari serin dengan bantuan homosistein sebagai donor gugus sulfur.
d. Keluarga Piruvat (Pyruvate Family)
Prekursor utama: Piruvat
-
Alanin → dihasilkan langsung dari piruvat melalui reaksi transaminasi.
-
Valin → berasal dari α-ketoisovalerat, yang merupakan turunan dari piruvat.
-
Leusin → disintesis melalui jalur yang mirip dengan valin tetapi melibatkan prekursor tambahan seperti α-ketoisokaproat.
e. Keluarga Asam Amino Aromatik (Aromatic Amino Acid Family)
Prekursor utama: Fosfoenolpiruvat dan Erythrose-4-fosfat
-
Fenilalanin → berasal dari prekursor prephenate, yang kemudian dikonversi menjadi fenilalanin.
-
Tirosin → dapat diperoleh dari fenilalanin melalui enzim fenilalanin hidroksilase atau langsung dari jalur biosintesis tirosin.
-
Triptofan → dibuat dari chorismate melalui jalur biosintesis yang lebih kompleks.
f. Keluarga Histidin (Histidine Family)
Prekursor utama: Fosforibosil pirofosfat (PRPP)
-
Histidin → disintesis dari ribosa-5-fosfat melalui jalur metabolisme yang kompleks.
2. Hubungan dengan Siklus TCA
Jalur biosintesis asam amino sangat terkait dengan siklus asam trikarboksilat (TCA cycle). Banyak prekursor biosintesis asam amino berasal dari senyawa perantara dalam siklus ini, seperti oksaloasetat dan α-ketoglutarat. Oleh karena itu, metabolisme energi dan sintesis asam amino saling berhubungan erat.
3. Implikasi Biologis dan Klinis
-
Gangguan metabolisme asam amino seperti fenilketonuria (PKU) terjadi akibat defisiensi enzim yang terlibat dalam biosintesis atau degradasi asam amino tertentu.
-
Peran biosintesis asam amino dalam kesehatan sangat penting, terutama dalam diet. Asam amino esensial harus diperoleh dari makanan karena tubuh tidak dapat mensintesisnya.
-
Aplikasi dalam rekayasa genetika dan bioteknologi: Pemahaman jalur biosintesis ini memungkinkan manipulasi metabolik untuk produksi asam amino dalam industri farmasi dan makanan.
Slide ini menunjukkan hubungan metabolik yang kompleks antara berbagai keluarga asam amino, menekankan bagaimana biosintesis mereka bergantung pada jalur metabolisme utama dalam tubuh.
88 Syarah (Penjelasan) Slide ke-44
Slide ini menampilkan jalur tahapan glikolisis, yaitu proses metabolisme yang mengubah glukosa menjadi energi dalam bentuk ATP. Berikut adalah syarah PPT untuk slide ini:
1. Definisi Glikolisis
Glikolisis berasal dari kata Yunani glycos (gula) dan lysis (pemecahan), yang berarti proses pemecahan glukosa. Ini adalah jalur metabolik utama yang terjadi di sitoplasma sel dan berfungsi untuk menghasilkan energi dalam kondisi aerobik maupun anaerobik.
Secara umum, glikolisis terdiri dari 10 tahapan reaksi enzimatik yang dapat dibagi menjadi dua fase utama:
-
Fase Investasi Energi (Preparatory Phase) – membutuhkan ATP untuk memfosforilasi glukosa.
-
Fase Penghasilan Energi (Payoff Phase) – menghasilkan ATP dan NADH.
2. Tahapan Glikolisis Berdasarkan Slide
Fase Investasi Energi
-
Glukosa → Glukosa-6-fosfat
-
Enzim: Heksokinase
-
ATP digunakan untuk menambahkan gugus fosfat ke glukosa, membentuk glukosa-6-fosfat.
-
Tujuan: Memerangkap glukosa di dalam sel agar tidak keluar melalui transporter.
-
-
Glukosa-6-fosfat → Fruktosa-6-fosfat
-
Enzim: Fosfoheksoisomerase
-
Reaksi ini mengubah glukosa-6-fosfat menjadi fruktosa-6-fosfat melalui isomerisasi.
-
-
Fruktosa-6-fosfat → Fruktosa-1,6-bifosfat
-
Enzim: Fosfofruktokinase-1 (PFK-1)
-
ATP digunakan untuk menambahkan gugus fosfat kedua.
-
Ini adalah tahap paling terkontrol dalam glikolisis karena PFK-1 adalah enzim regulator utama.
-
-
Fruktosa-1,6-bifosfat → Fosfogliseraldehid dan Dihidroksiaseton Fosfat
-
Enzim: Aldolase
-
Molekul ini terpecah menjadi dua senyawa 3-karbon yang berpotensi menghasilkan energi.
-
Dihidroksiaseton fosfat (DHAP) diubah menjadi fosfogliseraldehid (G3P) oleh enzim triosa fosfat isomerase, sehingga kedua molekul siap masuk ke fase berikutnya.
-
Fase Penghasilan Energi
-
Fosfogliseraldehid → 1,3-bifosfogliserat
-
Enzim: Gliseraldehid-3-fosfat dehidrogenase
-
NAD⁺ direduksi menjadi NADH, yang akan digunakan dalam rantai transpor elektron untuk produksi ATP dalam kondisi aerobik.
-
-
1,3-bifosfogliserat → 3-fosfogliserat
-
Enzim: Fosfogliserat kinase
-
ATP pertama dihasilkan melalui fosforilasi tingkat substrat (substrate-level phosphorylation).
-
-
3-fosfogliserat → 2-fosfogliserat
-
Enzim: Fosfogliserat mutase
-
Gugus fosfat dipindahkan ke posisi yang lebih reaktif.
-
-
2-fosfogliserat → Fosfoenolpiruvat (PEP)
-
Enzim: Enolase
-
Air dilepaskan dalam reaksi dehidrasi untuk membentuk PEP, yang sangat kaya energi.
-
-
Fosfoenolpiruvat → Asam Piruvat
-
Enzim: Piruvat Kinase
-
ATP kedua dihasilkan melalui fosforilasi tingkat substrat.
-
Produk akhir adalah piruvat, yang menjadi titik cabang metabolisme.
-
3. Nasib Piruvat Setelah Glikolisis
Piruvat dapat diproses lebih lanjut berdasarkan kondisi oksigen dalam sel:
-
Kondisi Aerobik (dengan O₂):
Piruvat masuk ke mitokondria dan diubah menjadi asetil-KoA oleh enzim piruvat dehidrogenase untuk masuk ke siklus Krebs. -
Kondisi Anaerobik (tanpa O₂):
Piruvat diubah menjadi laktat oleh enzim laktat dehidrogenase (fermentasi laktat) atau menjadi etanol dan CO₂ pada organisme tertentu (fermentasi alkohol).
4. Signifikansi Biologis dan Klinis
-
Glikolisis adalah jalur utama produksi energi dalam sel, terutama dalam kondisi anaerobik.
-
Sel kanker sering mengalami glikolisis yang lebih tinggi (Efek Warburg), meskipun ada cukup oksigen, karena kebutuhan metaboliknya yang unik.
-
Gangguan metabolik seperti defisiensi enzim glikolisis dapat menyebabkan penyakit seperti defisiensi piruvat kinase, yang mengganggu produksi energi dalam sel darah merah dan menyebabkan anemia hemolitik.
Slide ini memberikan visualisasi yang jelas mengenai jalur glikolisis dan peran pentingnya dalam metabolisme energi.
90 Syarah (Penjelasan) Slide ke-45
Slide ini menampilkan siklus asam sitrat atau yang dikenal sebagai siklus Krebs atau siklus TCA (tricarboxylic acid cycle). Siklus ini merupakan jalur metabolik utama dalam respirasi seluler yang terjadi di mitokondria dan berperan dalam produksi energi melalui oksidasi asetil-KoA. Berikut adalah syarah PPT untuk slide ini:
1. Definisi dan Fungsi Siklus Asam Sitrat
Siklus asam sitrat adalah serangkaian reaksi biokimia yang mengubah asetil-KoA menjadi CO₂, sambil menghasilkan NADH, FADH₂, dan ATP/GTP. Senyawa hasil siklus ini berperan dalam menyediakan energi dan intermediat metabolik untuk biosintesis berbagai molekul.
Siklus ini berfungsi untuk:
-
Menghasilkan ATP/GTP sebagai sumber energi utama sel.
-
Menghasilkan NADH dan FADH₂ yang digunakan dalam rantai transpor elektron untuk produksi ATP lebih lanjut.
-
Menyediakan prekursor metabolik untuk sintesis asam amino, nukleotida, dan biomolekul lainnya.
2. Tahapan Siklus Asam Sitrat Berdasarkan Slide
1. Pembentukan Asetil-KoA
-
Piruvat → Asetil-KoA
-
Enzim: Piruvat dehidrogenase
-
Piruvat yang dihasilkan dari glikolisis mengalami dekarboksilasi oksidatif menjadi asetil-KoA dengan pelepasan CO₂ dan reduksi NAD⁺ menjadi NADH.
-
Asetil-KoA ini masuk ke siklus asam sitrat.
-
2. Kondensasi Asetil-KoA dengan Oksaloasetat
-
Asetil-KoA + Oksaloasetat → Sitrat
-
Enzim: Sitrat sintase
-
Asetil-KoA bergabung dengan oksaloasetat untuk membentuk sitrat (asam sitrat).
-
3. Isomerisasi Sitrat
-
Sitrat → cis-Akonitat → Isositrat
-
Enzim: Akonitase
-
Sitrat diisomerisasi menjadi isositrat melalui perantara cis-akonitat.
-
4. Dekarboksilasi Oksidatif Isositrat
-
Isositrat → α-Ketoglutarat
-
Enzim: Isositrat dehidrogenase
-
NAD⁺ direduksi menjadi NADH, dan satu molekul CO₂ dilepaskan.
-
5. Dekarboksilasi Oksidatif α-Ketoglutarat
-
α-Ketoglutarat → Suksinil-KoA
-
Enzim: α-Ketoglutarat dehidrogenase
-
NADH terbentuk dan satu molekul CO₂ dilepaskan.
-
6. Konversi Suksinil-KoA menjadi Suksinat
-
Suksinil-KoA → Suksinat
-
Enzim: Suksinil-KoA sintetase
-
GDP + Pᵢ → GTP (atau ATP) dalam fosforilasi tingkat substrat.
-
7. Oksidasi Suksinat
-
Suksinat → Fumarat
-
Enzim: Suksinat dehidrogenase
-
FAD⁺ direduksi menjadi FADH₂, yang nantinya akan masuk ke rantai transpor elektron.
-
8. Hidrasi Fumarat
-
Fumarat → Malat
-
Enzim: Fumarase
-
Penambahan molekul air membentuk malat.
-
9. Regenerasi Oksaloasetat
-
Malat → Oksaloasetat
-
Enzim: Malat dehidrogenase
-
NAD⁺ direduksi menjadi NADH, dan oksaloasetat yang terbentuk siap digunakan kembali dalam siklus berikutnya.
-
3. Hasil dan Signifikansi Energetik
Satu siklus asam sitrat menghasilkan:
-
3 NADH → menghasilkan 7.5 ATP (jika dikonversi di rantai transpor elektron).
-
1 FADH₂ → menghasilkan 1.5 ATP.
-
1 GTP (setara ATP).
-
2 CO₂ sebagai produk sampingan.
Total produksi energi dari satu molekul asetil-KoA adalah sekitar 10 ATP, dan dari satu molekul glukosa (dua asetil-KoA) adalah sekitar 20 ATP (belum termasuk ATP dari glikolisis dan rantai transpor elektron).
4. Kaitan Siklus Asam Sitrat dengan Metabolisme Lain
-
Hubungan dengan Rantai Transpor Elektron
-
NADH dan FADH₂ yang dihasilkan digunakan dalam mitokondria untuk menghasilkan lebih banyak ATP.
-
-
Hubungan dengan Biosintesis
-
Oksaloasetat → Prekursor asam amino aspartat.
-
α-Ketoglutarat → Prekursor glutamat, yang penting dalam sintesis protein.
-
Suksinil-KoA → Dapat digunakan untuk sintesis heme dalam eritrosit.
-
-
Gangguan Metabolisme
-
Defisiensi enzim piruvat dehidrogenase dapat menyebabkan laktat asidosis, karena piruvat akan dialihkan ke fermentasi laktat.
-
Disfungsi mitokondria akan menghambat siklus ini, yang dapat menyebabkan penyakit metabolik seperti gangguan energi mitokondria.
-
Kesimpulan
Siklus asam sitrat merupakan jalur metabolik pusat dalam produksi energi yang menghubungkan glikolisis dengan oksidasi asam lemak dan metabolisme asam amino. Jalur ini tidak hanya menghasilkan ATP tetapi juga menyediakan prekursor penting untuk biosintesis berbagai senyawa. Disfungsi dalam jalur ini dapat menyebabkan gangguan metabolik yang serius.
92 Syarah (Penjelasan) Slide ke-46
Slide ini menjelaskan struktur hemoglobin, yaitu protein utama dalam eritrosit yang berfungsi sebagai pengangkut oksigen dalam darah. Berikut adalah syarah PPT berdasarkan gambar yang ditampilkan:
1. Definisi Hemoglobin
Hemoglobin (Hb) adalah protein globular yang terdapat dalam sel darah merah (erythrocytes) dan bertanggung jawab atas transportasi oksigen (O₂) dari paru-paru ke jaringan, serta pengangkutan karbon dioksida (CO₂) kembali ke paru-paru untuk dikeluarkan. Hemoglobin terdiri dari empat rantai polipeptida yang masing-masing mengandung gugus heme, suatu struktur yang berperan dalam pengikatan oksigen.
2. Struktur Hemoglobin Berdasarkan Slide
Gambar pada slide ini menunjukkan tiga tingkatan struktur hemoglobin:
-
Sel darah merah (Erythrocyte)
-
Sel darah merah berbentuk cakram bikonkaf yang memungkinkan fleksibilitas dan efisiensi dalam pertukaran gas.
-
Di dalamnya terdapat hemoglobin dalam jumlah besar, yang memberikan warna merah pada darah.
-
-
Molekul Hemoglobin
-
Hemoglobin terdiri dari empat rantai polipeptida, yaitu dua rantai α (alfa) dan dua rantai β (beta) pada hemoglobin dewasa (HbA).
-
Setiap rantai polipeptida memiliki satu gugus heme, yang memungkinkan hemoglobin mengikat empat molekul oksigen per molekulnya.
-
-
Struktur Gugus Heme (Heme b group)
-
Gugus heme adalah cincin porfirin yang mengandung atom besi (Fe²⁺) di pusatnya.
-
Atom Fe²⁺ berfungsi sebagai situs pengikatan oksigen, di mana satu molekul O₂ dapat berikatan dengan setiap gugus heme.
-
3. Mekanisme Pengikatan dan Pelepasan Oksigen
Hemoglobin berinteraksi dengan oksigen melalui mekanisme kooperatif, yang dikenal sebagai efek alosterik:
-
Di paru-paru: Konsentrasi oksigen tinggi → O₂ berikatan dengan Fe²⁺ → Hemoglobin berada dalam bentuk oksigenasi (oksihemoglobin, HbO₂).
-
Di jaringan tubuh: Konsentrasi oksigen rendah → O₂ dilepaskan → Hemoglobin kembali ke bentuk deoksigenasi.
Selain itu, hemoglobin juga berperan dalam transportasi karbon dioksida (CO₂) dan ion hidrogen (H⁺), yang berkontribusi pada keseimbangan pH darah melalui efek Bohr.
4. Gangguan Terkait Hemoglobin
Beberapa kelainan genetik atau gangguan kesehatan yang mempengaruhi hemoglobin meliputi:
-
Anemia defisiensi besi: Kekurangan Fe²⁺ menyebabkan produksi hemoglobin yang rendah, mengurangi kapasitas pengangkutan oksigen.
-
Sickle cell anemia (Anemia sel sabit): Mutasi pada gen β-globin menyebabkan hemoglobin membentuk serat yang mengubah bentuk eritrosit menjadi bulan sabit, yang dapat menyumbat pembuluh darah.
-
Talasemia: Gangguan genetik yang menghambat produksi rantai globin, menyebabkan ketidakseimbangan dalam struktur hemoglobin.
5. Kesimpulan
Slide ini menunjukkan struktur hemoglobin sebagai protein utama dalam eritrosit yang bertanggung jawab atas transportasi oksigen dan karbon dioksida. Fungsinya yang bergantung pada Fe²⁺ dalam gugus heme sangat penting untuk kehidupan. Gangguan pada hemoglobin dapat menyebabkan berbagai penyakit darah yang mempengaruhi distribusi oksigen dalam tubuh.
94 Syarah (Penjelasan) Slide ke-47
Slide ini menampilkan metabolisme asam amino, hubungan dengan siklus TCA, serta berbagai penyakit metabolik yang terkait dengan gangguan enzim dalam jalur ini. Berikut adalah syarah PPT untuk slide ini:
1. Metabolisme Asam Amino dan Jalur Utama
Asam amino merupakan komponen utama dalam sintesis protein dan memiliki jalur metabolisme yang beragam. Setelah deaminasi, kerangka karbon dari asam amino dapat masuk ke jalur metabolisme berikut:
-
Glikolisis → menghasilkan energi dalam bentuk ATP.
-
Siklus Asam Sitrat (TCA cycle) → untuk produksi energi dan pembentukan prekursor metabolik.
-
Siklus Urea → membuang nitrogen berlebih dalam bentuk urea.
-
Sintesis senyawa biologis penting → neurotransmiter, hormon, dan pigmen.
Dalam diagram ini, setiap asam amino dikaitkan dengan jalur degradasi dan fungsi fisiologisnya, serta beberapa gangguan metabolisme yang terjadi akibat defisiensi enzim.
2. Klasifikasi Asam Amino Berdasarkan Jalur Metabolisme
-
Asam Amino Esensial (Essential Amino Acids)
-
Tidak dapat disintesis oleh tubuh dan harus diperoleh dari makanan.
-
Termasuk Val, Ile, Leu, Thr, Met, Phe, Trp, Lys, His, Arg.
-
-
Asam Amino Glukogenik vs Ketogenik
-
Asam Amino Glukogenik → menghasilkan prekursor glukosa melalui siklus TCA (misalnya Ala, Asp, Asn, Glu, Gln, Ser, Gly).
-
Asam Amino Ketogenik → menghasilkan asetoasetat atau asetil-KoA, yang tidak dapat digunakan untuk sintesis glukosa (misalnya Leu, Lys).
-
Asam Amino Campuran → bisa menjadi glukogenik dan ketogenik (Phe, Tyr, Trp, Ile, Thr).
-
3. Gangguan Metabolisme Asam Amino
Gangguan yang ditandai dengan tanda "X" dalam diagram ini adalah akibat mutasi genetik yang menyebabkan defisiensi enzim tertentu, menghambat jalur metabolisme asam amino.
a. Fenilketonuria (PKU)
-
Disebabkan oleh defisiensi enzim fenilalanin hidroksilase, yang mencegah konversi fenilalanin (Phe) → tirosin (Tyr).
-
Akumulasi fenilalanin menyebabkan kerusakan neurologis dan retardasi mental jika tidak ditangani.
-
Terapi: Diet rendah fenilalanin.
b. Alkaptonuria
-
Disebabkan oleh defisiensi enzim homogentisat oksidase, yang menyebabkan akumulasi homogentisat dalam urin.
-
Gejala utama: Urin berwarna gelap ketika terkena udara, artritis degeneratif.
-
Terapi: Diet rendah tirosin dan fenilalanin.
c. Albinisme
-
Disebabkan oleh defisiensi enzim tirosinase, yang menghambat sintesis melanin dari DOPA.
-
Gejala: Kulit dan rambut berwarna pucat, sensitivitas terhadap sinar matahari.
d. Maple Syrup Urine Disease (MSUD)
-
Disebabkan oleh defisiensi enzim dehidrogenase α-ketoasam bercabang, yang menghambat metabolisme Val, Leu, Ile.
-
Gejala: Urine berbau seperti sirup maple, keterbelakangan mental.
-
Terapi: Diet rendah Val, Leu, Ile.
e. Homosistinuria
-
Disebabkan oleh defisiensi enzim sistationin β-sintase, yang menghambat konversi homosistein → sistationin → sistein.
-
Gejala: Gangguan kardiovaskular, osteoporosis, kelainan mata.
-
Terapi: Suplemen vitamin B6, B12, dan folat.
f. Methylmalonic Acidemia
-
Disebabkan oleh defisiensi enzim metilmalonil-KoA mutase atau defisiensi vitamin B12.
-
Menghambat metabolisme asam amino rantai cabang dan asam lemak, menyebabkan asidosis metabolik.
4. Siklus Urea dan Detoksifikasi Nitrogen
Siklus urea adalah mekanisme utama tubuh untuk membuang nitrogen berlebih dari metabolisme asam amino. Proses ini terjadi di mitokondria dan sitoplasma hepatosit, dengan langkah-langkah utama:
-
Amonia (NH₃) + CO₂ → Karbamoil fosfat (enzim: karbamoil fosfat sintetase I).
-
Karbamoil fosfat + Ornitin → Sitrulin (enzim: ornitin transkarbamilase).
-
Sitrulin + Aspartat → Argininosuksinat (enzim: argininosuksinat sintetase).
-
Argininosuksinat → Arginin + Fumarat (enzim: argininosuksinat liase).
-
Arginin → Urea + Ornitin (enzim: arginase).
Gangguan dalam siklus urea menyebabkan hiperamonemia, yang dapat menyebabkan gangguan neurologis dan koma.
5. Hubungan dengan Neurotransmitter dan Hormon
Beberapa asam amino bertindak sebagai prekursor neurotransmiter dan hormon penting:
-
Tirosin (Tyr) → Dopamin, Norepinefrin, Epinefrin (katekolamin).
-
Tirosin → Melanin (pigmen kulit).
-
Triptofan (Trp) → Serotonin dan Melatonin (regulasi suasana hati dan tidur).
-
Histidin (His) → Histamin (reaksi alergi).
-
Arginin (Arg) → Nitric Oxide (NO) (vasodilator).
Gangguan dalam biosintesis neurotransmiter ini dapat menyebabkan gangguan neurologis dan psikiatri.
6. Kesimpulan
Slide ini mengilustrasikan bagaimana asam amino dimetabolisme dalam tubuh, bagaimana jalur ini terhubung dengan siklus TCA, dan bagaimana mutasi enzim spesifik dapat menyebabkan penyakit metabolik yang serius. Dengan memahami hubungan antara asam amino dan metabolisme, kita dapat lebih memahami peran biokimia dalam kesehatan dan penyakit.
96 Syarah (Penjelasan) Slide ke-48
Slide ini membahas sintesis asam amino non-esensial dari asam amino non-esensial lainnya, dengan contoh utama yaitu prolin yang disintesis dari glutamat. Berikut adalah syarah PPT untuk slide ini:
1. Definisi Sintesis Asam Amino Non-Esensial
Asam amino non-esensial adalah asam amino yang dapat disintesis oleh tubuh tanpa perlu diperoleh dari makanan. Salah satu mekanisme sintesisnya adalah melalui konversi dari asam amino non-esensial lainnya, seperti glutamat menjadi prolin.
Proses ini merupakan bagian dari jalur metabolisme interkoneksi, di mana asam amino dapat mengalami transaminasi, reduksi, atau reaksi siklis untuk membentuk asam amino baru.
2. Contoh: Sintesis Prolin dari Glutamat
Prolin merupakan asam amino non-esensial yang dapat disintesis dari glutamat dalam beberapa organisme, termasuk mamalia. Proses ini terjadi melalui serangkaian reaksi sebagai berikut:
-
Reduksi Glutamat → Glutamat Semialdehida
-
Enzim: Glutamat 5-kinase
-
Glutamat mengalami fosforilasi menggunakan ATP dan kemudian direduksi menjadi glutamat semialdehida.
-
-
Siklisasi Glutamat Semialdehida → Δ¹-Pirolin-5-Karboksilat (P5C)
-
Glutamat semialdehida mengalami spontaneous cyclization, membentuk Δ¹-Pirolin-5-Karboksilat (P5C).
-
-
Reduksi P5C → Prolin
-
Enzim: P5C Reduktase
-
P5C direduksi menggunakan NADPH menjadi prolin.
-
Jalur ini merupakan kebalikan dari jalur katabolisme prolin, di mana prolin dapat dikonversi kembali menjadi glutamat jika diperlukan.
3. Signifikansi Biologis Prolin
Prolin memiliki beberapa peran penting dalam fisiologi tubuh:
-
Penyusun Protein Kolagen → Prolin banyak ditemukan dalam kolagen, protein utama dalam jaringan ikat.
-
Metabolisme Energi → Prolin dapat dikonversi kembali menjadi glutamat untuk masuk ke siklus asam sitrat (TCA cycle).
-
Regulasi Osmotik → Prolin berperan dalam stres osmotik pada beberapa organisme, terutama tumbuhan, untuk mempertahankan keseimbangan air.
-
Sintesis Neurotransmiter → Berperan dalam neurotransmisi melalui jalur glutamat-prolin.
4. Kesimpulan
Slide ini menyoroti hubungan metabolik antar asam amino non-esensial, khususnya sintesis prolin dari glutamat melalui jalur reduksi dan siklisasi. Proses ini menunjukkan fleksibilitas metabolisme tubuh dalam mempertahankan keseimbangan asam amino, yang penting untuk fungsi struktural dan metabolik.
98 Syarah (Penjelasan) Slide ke-49
Slide ini membahas sintesis asam amino non-esensial dari asam amino esensial, dengan contoh utama yaitu tirosin yang disintesis dari fenilalanin. Berikut adalah syarah PPT untuk slide ini:
1. Definisi Sintesis Asam Amino Non-Esensial dari Asam Amino Esensial
Beberapa asam amino non-esensial dapat disintesis dari asam amino esensial melalui reaksi enzimatik spesifik. Salah satu contoh yang paling penting dalam biokimia adalah konversi fenilalanin menjadi tirosin, yang terjadi melalui reaksi hidroksilasi.
2. Sintesis Tirosin dari Fenilalanin
Tirosin adalah asam amino non-esensial yang disintesis dari fenilalanin melalui reaksi berikut:
-
Fenilalanin → Tirosin
-
Enzim: Fenilalanin hidroksilase (PAH)
-
Koenzim: Tetrahidrobiopterin (BH₄) sebagai donor elektron
-
Produk sampingan: Dihidrobiopterin (BH₂), yang kemudian direduksi kembali menjadi BH₄ oleh NADPH.
-
Reaksi ini irreversible, artinya tubuh tidak dapat mengubah tirosin kembali menjadi fenilalanin.
-
3. Peran Biologis Tirosin
Tirosin memiliki beberapa fungsi penting dalam tubuh:
-
Prekursor neurotransmiter → Dopamin, Norepinefrin, dan Epinefrin (katekolamin).
-
Sintesis hormon tiroid → Tirosin digunakan dalam pembentukan T₃ (triiodotironin) dan T₄ (tiroksin).
-
Sintesis melanin → Pigmen kulit dan rambut berasal dari metabolisme tirosin.
-
Konversi menjadi fumarat dan asetoasetat → Masuk ke jalur metabolisme energi.
4. Gangguan Metabolisme yang Terkait
Jika enzim fenilalanin hidroksilase (PAH) tidak berfungsi dengan baik, maka fenilalanin tidak dapat dikonversi menjadi tirosin, menyebabkan fenilketonuria (PKU):
-
PKU disebabkan oleh mutasi pada gen PAH, yang menyebabkan akumulasi fenilalanin dalam darah.
-
Fenilalanin yang berlebih dikonversi menjadi fenilpiruvat, yang bersifat toksik bagi sistem saraf.
-
Gejala: Retardasi mental, kejang, hipopigmentasi (karena gangguan produksi melanin).
-
Terapi: Diet rendah fenilalanin dan suplementasi tirosin.
Sebaliknya, gangguan dalam metabolisme tirosin dapat menyebabkan alkaptonuria, yang terjadi akibat defisiensi enzim homogentisat oksidase, menyebabkan penumpukan homogentisat yang dapat mengakibatkan arthritis dan urin yang menghitam saat terkena udara.
5. Kesimpulan
Slide ini menjelaskan bagaimana tirosin disintesis dari fenilalanin melalui reaksi hidroksilasi yang melibatkan fenilalanin hidroksilase dan tetrahidrobiopterin (BH₄) sebagai kofaktor. Proses ini esensial untuk sintesis neurotransmiter, hormon tiroid, dan melanin. Gangguan dalam jalur ini dapat menyebabkan fenilketonuria (PKU) atau alkaptonuria, yang berimplikasi pada kesehatan manusia.
100 Syarah (Penjelasan) Slide ke-50
Slide ini membahas asam amino esensial, khususnya arginin, lisin, metionin, treonin, dan isoleusin, serta hubungannya dengan asam aspartat sebagai prekursor biosintesis. Berikut adalah syarah PPT untuk slide ini:
1. Definisi Asam Amino Esensial
Asam amino esensial adalah asam amino yang tidak dapat disintesis oleh tubuh dalam jumlah yang cukup dan harus diperoleh dari makanan. Asam amino ini berperan dalam sintesis protein dan berbagai jalur metabolisme penting.
Dalam slide ini, disebutkan bahwa lisin, metionin, treonin, dan isoleusin berasal dari asam aspartat, yang menunjukkan bahwa mereka berbagi jalur biosintesis yang sama pada organisme yang dapat mensintesisnya (misalnya bakteri dan tumbuhan). Namun, pada manusia, asam amino ini tidak dapat disintesis sehingga dikategorikan sebagai esensial.
2. Biosintesis Asam Amino dari Asam Aspartat
Beberapa asam amino esensial yang disebutkan dalam slide memiliki jalur biosintesis yang berasal dari asam aspartat:
-
Lisin (Lys) → Disintesis melalui jalur diaminopimelate pada bakteri dan tumbuhan. Pada manusia, lisin harus diperoleh dari makanan.
-
Metionin (Met) → Dibentuk dari homosistein, yang berasal dari asam aspartat. Berperan sebagai donor gugus metil dalam reaksi S-adenosilmetionin (SAM).
-
Treonin (Thr) → Disintesis melalui aspartat semialdehida, yang merupakan perantara dalam jalur biosintesis asam amino.
-
Isoleusin (Ile) → Dibentuk dari treonin melalui jalur enzimatis yang melibatkan treonin deaminase.
Pada manusia, arginin (Arg) dianggap semi-esensial, karena dapat disintesis melalui siklus urea, tetapi tidak dalam jumlah yang cukup untuk kebutuhan tertentu, terutama selama masa pertumbuhan atau kondisi tertentu seperti trauma dan penyakit.
3. Fungsi Biologis Asam Amino Esensial
Setiap asam amino yang disebutkan memiliki peran fisiologis yang penting:
-
Lisin → Komponen penting dalam sintesis protein dan berperan dalam penyerapan kalsium serta produksi hormon.
-
Metionin → Sumber utama gugus metil dalam reaksi metilasi, esensial untuk sintesis kreatin, epinefrin, dan fosfolipid.
-
Treonin → Diperlukan dalam pembentukan kolagen, elastin, dan metabolisme lemak di hati.
-
Isoleusin → Berperan dalam regulasi kadar gula darah dan metabolisme energi.
-
Arginin → Penting dalam sintesis nitric oxide (NO), yang berperan dalam vasodilatasi, sistem kekebalan tubuh, dan penyembuhan luka.
4. Kesimpulan
Slide ini menyoroti bahwa lisin, metionin, treonin, dan isoleusin berasal dari jalur biosintesis asam aspartat, meskipun pada manusia asam amino ini tidak dapat disintesis sendiri sehingga harus diperoleh dari makanan. Arginin, meskipun dapat disintesis dalam tubuh melalui siklus urea, tetap dikategorikan sebagai semi-esensial, terutama dalam kondisi tertentu yang membutuhkan asupan tambahan.
102 Syarah (Penjelasan) Slide ke-51
Slide ini menampilkan tabel klasifikasi asam amino, berdasarkan beberapa parameter penting seperti prekursor pembentuknya (made from), produk degradasinya (degraded to), sifat glukogenik atau ketogenik (glyco/keto), serta komentar tambahan. Berikut adalah syarah PPT untuk slide ini:
1. Klasifikasi Asam Amino Berdasarkan Prekursor dan Jalur Metabolisme
Setiap asam amino dapat diklasifikasikan berdasarkan jalur biosintesis dan degradasinya:
-
Asam Amino Non-Esensial
-
Dapat disintesis oleh tubuh dari prekursor metabolik yang tersedia.
-
Contoh:
-
Alanine berasal dari piruvat.
-
Glutamat berasal dari α-ketoglutarat.
-
Serin berasal dari 3-fosfogliserat.
-
-
-
Asam Amino Esensial
-
Tidak dapat disintesis oleh tubuh dalam jumlah cukup sehingga harus diperoleh dari makanan.
-
Contoh:
-
Lisin, Metionin, Treonin, Isoleusin, Leusin, Fenilalanin, Tirosin, Triptofan.
-
-
-
Asam Amino Semi-Esensial
-
Dapat disintesis dalam tubuh tetapi terbatas dalam kondisi tertentu seperti masa pertumbuhan atau penyakit.
-
Contoh: Arginin dan Histidin.
-
2. Klasifikasi Asam Amino Berdasarkan Produk Degradasi
Setelah mengalami metabolisme, asam amino diubah menjadi senyawa yang berbeda:
-
Asam Amino Glukogenik
-
Dapat didegradasi menjadi prekursor glukoneogenesis seperti piruvat atau senyawa siklus TCA.
-
Contoh: Alanine, Aspartate, Glutamate, Serine, Proline, Histidine.
-
-
Asam Amino Ketogenik
-
Dapat didegradasi menjadi asetoasetat atau asetil-KoA, yang tidak bisa digunakan dalam sintesis glukosa.
-
Contoh: Leusin.
-
-
Asam Amino Campuran (Mixed)
-
Dapat berperan sebagai glukogenik dan ketogenik.
-
Contoh: Fenilalanin, Isoleusin, Tirosin, Triptofan, Lisin.
-
3. Keterangan Tambahan dalam Tabel
Bagian komentar dalam tabel memberikan informasi tambahan tentang sifat masing-masing asam amino:
-
Cysteine berasal dari Metionin → Menunjukkan bahwa sintesis sistein bergantung pada ketersediaan metionin.
-
Fenilalanin adalah prekursor tirosin → Gangguan dalam metabolisme fenilalanin dapat menyebabkan fenilketonuria (PKU).
-
Asam amino rantai cabang (BCAA: Leusin, Isoleusin, Valin) → Berperan penting dalam metabolisme energi otot.
-
Glisin sebagai komponen kolagen → Glisin berperan besar dalam struktur protein kolagen.
4. Kesimpulan
Slide ini memberikan gambaran komprehensif tentang asal-usul, degradasi, serta sifat metabolik asam amino, yang berguna dalam memahami peran biokimiawi mereka dalam tubuh. Klasifikasi ini penting dalam konteks metabolisme energi, sintesis protein, serta gangguan metabolik seperti fenilketonuria, homosistinuria, dan maple syrup urine disease (MSUD).
104 Syarah (Penjelasan) Slide ke-52
Slide ini membahas katabolisme asam amino, khususnya proses penghilangan gugus amino dan sistem ekskresi nitrogen pada berbagai kelompok hewan. Berikut adalah syarah PPT untuk slide ini:
1. Definisi Katabolisme Asam Amino
Katabolisme asam amino adalah proses pemecahan asam amino yang terjadi saat tubuh tidak memerlukan sintesis protein lebih lanjut atau ketika ada kelebihan asam amino yang tidak dapat disimpan. Proses ini melibatkan dua tahap utama:
-
Penghilangan gugus amino melalui transaminasi dan deaminasi oksidatif, yang menghasilkan amonia (NH₃).
-
Ekskresi nitrogen berlebih, yang bervariasi tergantung pada organisme.
2. Klasifikasi Ekskresi Nitrogen Berdasarkan Organisme
Ekskresi nitrogen dari metabolisme asam amino bervariasi pada hewan dan dikelompokkan menjadi tiga jenis utama, yaitu:
a. Ureolitik (Ekskresi Urea)
-
Hewan: Mamalia, amfibi, beberapa ikan air tawar.
-
Bentuk nitrogen yang diekskresikan: Urea (CO(NH₂)₂).
-
Jalur utama: Siklus Urea yang berlangsung di hati, kemudian urea dibuang melalui ginjal dalam urin.
-
Keunggulan: Urea lebih tidak beracun dibanding amonia dan larut dalam air.
-
Kelemahan: Proses pembentukannya membutuhkan energi.
b. Urikotelik (Ekskresi Asam Urat)
-
Hewan: Burung (Aves), reptil (termasuk kadal dan ular), dan serangga.
-
Bentuk nitrogen yang diekskresikan: Asam urat.
-
Keunggulan: Asam urat tidak larut dalam air, sehingga ekskresi dilakukan dalam bentuk pasta atau kristal padat yang menghemat air.
-
Kelemahan: Sintesis asam urat memerlukan lebih banyak energi dibanding ekskresi urea.
c. Ammonotelik (Ekskresi Amonia)
-
Hewan: Ikan bertulang belakang (teleostei), amfibi akuatik, dan invertebrata air.
-
Bentuk nitrogen yang diekskresikan: Amonia (NH₃) langsung ke lingkungan air.
-
Keunggulan: Tidak memerlukan energi untuk pembentukan urea atau asam urat.
-
Kelemahan: Amonia sangat toksik, sehingga hanya dapat dibuang oleh hewan yang hidup di air karena harus segera diencerkan.
3. Signifikansi Biologis dan Evolusi Ekskresi Nitrogen
-
Hewan darat cenderung menggunakan ekskresi urea atau asam urat karena mereka harus menghemat air.
-
Hewan air menggunakan ekskresi amonia karena mereka memiliki akses konstan ke air untuk mengencerkan toksisitas amonia.
-
Reptil dan burung memiliki ekskresi urikotelik yang lebih efisien dalam menghemat air, karena mereka hidup di lingkungan yang lebih kering.
4. Kesimpulan
Slide ini menjelaskan bagaimana organisme beradaptasi dalam membuang nitrogen berlebih dari metabolisme asam amino melalui sistem ekskresi ureolitik, urikotelik, dan ammonotelik. Adaptasi ini mencerminkan evolusi metabolisme berdasarkan lingkungan hidup, dengan perbedaan utama dalam toksisitas produk ekskresi dan efisiensi penggunaan energi dan air.
106 Syarah (Penjelasan) Slide ke-53
Slide ini menjelaskan katabolisme asam amino, dengan fokus pada transaminasi, deaminasi, dan siklus urea. Berikut adalah syarah PPT untuk slide ini:
1. Katabolisme Asam Amino: Pemecahan Protein
Katabolisme asam amino terjadi ketika protein dalam tubuh dipecah menjadi unit-unit penyusunnya, yaitu asam amino. Proses ini terjadi dalam beberapa kondisi:
-
Kelebihan asupan protein.
-
Kelaparan atau defisit energi, ketika tubuh menggunakan protein sebagai sumber energi.
-
Perombakan protein yang tidak diperlukan dalam perbaikan jaringan.
Setelah protein dipecah, asam amino yang dihasilkan mengalami dua jalur utama:
-
Penghilangan gugus amina untuk dibuang sebagai nitrogen.
-
Pemanfaatan kerangka karbon untuk metabolisme energi atau biosintesis.
2. Transaminasi dan Deaminasi: Penghilangan Gugus Amino
Proses ini bertujuan untuk menghilangkan gugus amina (-NH₂) dari asam amino, karena tubuh tidak dapat menyimpan nitrogen dalam bentuk amonia yang bersifat toksik.
a. Transaminasi
-
Gugus amino dipindahkan dari satu asam amino ke α-ketoglutarat untuk membentuk glutamat.
-
Enzim utama: Aminotransferase (Transaminase).
-
Produk: Asam amino baru dan glutamat.
b. Deaminasi Oksidatif
-
Glutamat diubah menjadi α-ketoglutarat, melepaskan NH₃ (amonia).
-
Enzim utama: Glutamat dehidrogenase.
-
Produk: NH₃, yang masuk ke siklus urea.
3. Siklus Urea: Pembuangan Nitrogen
Amonia yang dihasilkan dari deaminasi sangat toksik bagi sel dan harus dibuang melalui siklus urea, yang terjadi di hati. Langkah-langkah utama:
-
Karbamoil fosfat sintetase I mengubah NH₃ + CO₂ menjadi karbamoil fosfat (mitokondria).
-
Ornitin transkarbamilase mengubah karbamoil fosfat menjadi sitrulin.
-
Sitrulin + Aspartat → Argininosuksinat (enzim: argininosuksinat sintetase).
-
Argininosuksinat dipecah menjadi arginin + fumarat.
-
Arginin → Ornitin + Urea (enzim: arginase).
-
Urea dikeluarkan melalui ginjal dalam urin.
4. Pemanfaatan Kerangka Karbon Asam Amino
Setelah gugus amino dihilangkan, sisa kerangka karbon dapat masuk ke berbagai jalur metabolisme:
-
Siklus TCA → untuk energi.
-
Glikoneogenesis → untuk sintesis glukosa (asam amino glukogenik).
-
Ketogenesis → untuk sintesis badan keton (asam amino ketogenik).
5. Kesimpulan
Slide ini menggambarkan bagaimana asam amino dikatabolisme dalam tubuh melalui transaminasi dan deaminasi, lalu produknya masuk ke siklus urea untuk pembuangan nitrogen dan siklus TCA untuk metabolisme energi. Proses ini sangat penting untuk detoksifikasi nitrogen dan pemanfaatan asam amino sebagai sumber energi.
108 Syarah (Penjelasan) Slide ke-54
Slide ini menggambarkan katabolisme asam amino di hati, yang melibatkan tiga proses utama: transaminasi, deaminasi, dan siklus urea. Berikut adalah syarah PPT untuk slide ini:
1. Katabolisme Asam Amino di Hati
Hati merupakan organ utama dalam metabolisme protein, termasuk pemecahan asam amino yang berlebihan. Ketika asam amino tidak digunakan untuk sintesis protein, mereka dipecah dalam proses katabolisme, yang terdiri dari:
-
Transaminasi → Transfer gugus amino untuk membentuk glutamat.
-
Deaminasi → Penghilangan gugus amino dari glutamat, menghasilkan amonia (NH₃).
-
Siklus Urea → Detoksifikasi amonia menjadi urea untuk diekskresikan.
2. Transaminasi: Transfer Gugus Amino ke Glutamat
-
Transaminasi adalah proses pemindahan gugus amino (-NH₂) dari asam amino ke α-ketoglutarat, membentuk glutamat.
-
Enzim utama: Aminotransferase (Transaminase).
-
Hasil: Asam amino baru + Glutamat sebagai penampung utama gugus amino.
Setiap asam amino memiliki enzim transaminase spesifik, misalnya:
-
Alanine aminotransferase (ALT) → Alanin + α-ketoglutarat → Glutamat + Piruvat.
-
Aspartate aminotransferase (AST) → Aspartat + α-ketoglutarat → Glutamat + Oksaloasetat.
Glutamat kemudian berperan sebagai pool nitrogen, yang akan diproses lebih lanjut melalui deaminasi oksidatif.
3. Deaminasi: Pengubahan Glutamat Menjadi Amonia
-
Deaminasi terjadi untuk menghilangkan gugus amino dari glutamat, menghasilkan amonium (NH₄⁺).
-
Enzim utama: Glutamat dehidrogenase.
-
Lokasi: Mitokondria hepatosit.
-
Hasil: Amonia (NH₃), yang merupakan senyawa toksik dan harus segera dikeluarkan dari tubuh.
Amonia ini akan segera masuk ke siklus urea untuk dikonversi menjadi bentuk yang lebih aman, yaitu urea.
4. Siklus Urea: Detoksifikasi Amonia
-
Amonia yang terbentuk dari deaminasi tidak dapat dibuang langsung karena sangat toksik.
-
Di hati, amonia masuk ke siklus urea, yang mengubahnya menjadi urea (CO(NH₂)₂), yang larut dalam air dan dapat diekskresikan melalui urin.
-
Siklus ini terjadi di mitokondria dan sitoplasma hepatosit, dan melibatkan beberapa langkah:
-
Amonia + CO₂ → Karbamoil fosfat (enzim: karbamoil fosfat sintetase I).
-
Karbamoil fosfat + Ornitin → Sitrulin (enzim: ornitin transkarbamilase).
-
Sitrulin + Aspartat → Argininosuksinat (enzim: argininosuksinat sintetase).
-
Argininosuksinat → Arginin + Fumarat (enzim: argininosuksinat liase).
-
Arginin → Ornitin + Urea (enzim: arginase).
-
Urea yang terbentuk kemudian dikirim ke ginjal untuk dikeluarkan dalam urin.
5. Signifikansi Biologis
-
Hati adalah pusat metabolisme nitrogen, memastikan bahwa amonia beracun tidak menumpuk dalam darah.
-
Gangguan dalam siklus urea dapat menyebabkan hiperamonemia, yang berdampak buruk pada sistem saraf pusat, menyebabkan koma atau kematian.
-
Uji klinis ALT dan AST digunakan sebagai indikator kesehatan hati, karena kadar enzim ini meningkat dalam darah jika terjadi kerusakan hati (misalnya pada hepatitis atau sirosis).
6. Kesimpulan
Slide ini menunjukkan bagaimana asam amino dikatabolisme di hati melalui transaminasi, deaminasi, dan siklus urea. Proses ini sangat penting untuk detoksifikasi amonia dan ekskresi nitrogen dalam bentuk urea. Gangguan pada jalur ini dapat menyebabkan akumulasi amonia yang berbahaya bagi tubuh.
110 Syarah (Penjelasan) Slide ke-55
Slide ini menjelaskan tahapan katabolisme gugus amino, yang mencakup transaminasi, deaminasi oksidatif, transport amonia, dan siklus urea. Berikut adalah syarah PPT untuk slide ini:
1. Katabolisme Gugus Amino
Katabolisme asam amino terutama berfokus pada pemecahan gugus amino (-NH₂), karena tubuh tidak dapat menyimpan nitrogen dalam bentuk amonia yang bersifat toksik. Oleh karena itu, nitrogen harus dibuang atau digunakan dalam jalur metabolik lain. Tahapan utama dalam katabolisme gugus amino adalah:
-
Transaminasi → Pemindahan gugus amino ke α-ketoglutarat, membentuk glutamat.
-
Deaminasi Oksidatif → Pelepasan gugus amino dari glutamat sebagai amonia bebas (NH₃).
-
Transport Amonia → Pengangkutan amonia ke hati dalam bentuk yang lebih aman.
-
Siklus Urea → Detoksifikasi amonia menjadi urea untuk diekskresikan melalui urin (hanya pada mamalia dan manusia).
2. Transaminasi: Transfer Gugus Amino
-
Transaminasi adalah langkah pertama dalam pemecahan asam amino, di mana gugus amino dipindahkan ke α-ketoglutarat untuk membentuk glutamat.
-
Enzim utama: Aminotransferase (Transaminase).
-
Contoh reaksi transaminasi:
-
Alanine + α-ketoglutarat → Piruvat + Glutamat (Enzim: Alanine aminotransferase / ALT).
-
Aspartat + α-ketoglutarat → Oksaloasetat + Glutamat (Enzim: Aspartate aminotransferase / AST).
-
Glutamat berfungsi sebagai penyimpan sementara gugus amino, yang akan diproses lebih lanjut dalam deaminasi oksidatif.
3. Deaminasi Oksidatif: Pelepasan Amonia
-
Glutamat mengalami deaminasi oksidatif, di mana gugus aminonya dilepaskan dalam bentuk amonium (NH₄⁺).
-
Enzim utama: Glutamat dehidrogenase.
-
Produk: Amonia (NH₃) dan α-ketoglutarat, yang dapat masuk kembali ke siklus TCA.
Proses ini terjadi di mitokondria hepatosit untuk memastikan bahwa amonia yang terbentuk langsung masuk ke jalur detoksifikasi.
4. Transport Amonia ke Hati
Amonia yang dihasilkan dari berbagai jaringan tubuh harus diangkut ke hati dalam bentuk yang lebih aman, mengingat amonia bersifat sangat toksik. Ada dua mekanisme transport utama:
-
Melalui Glutamin (pada otot dan jaringan lain)
-
Glutamat + NH₃ → Glutamin (Enzim: Glutamin sintetase).
-
Glutamin kemudian dikirim ke hati, di mana NH₃ dilepaskan kembali oleh glutaminase.
-
-
Melalui Alanin (pada otot)
-
Piruvat + NH₃ → Alanin (Enzim: Alanine aminotransferase).
-
Alanin dikirim ke hati, di mana ia dikonversi kembali menjadi piruvat dan NH₃.
-
Setelah sampai di hati, amonia ini langsung masuk ke siklus urea untuk diekskresikan.
5. Siklus Urea: Pembuangan Nitrogen Berlebih
Siklus urea adalah jalur metabolik utama dalam tubuh mamalia untuk mengubah amonia menjadi urea, yang larut dalam air dan dapat dibuang melalui urin. Tahapan utama dalam siklus ini meliputi:
-
Amonia + CO₂ → Karbamoil fosfat (Enzim: Karbamoil fosfat sintetase I).
-
Karbamoil fosfat + Ornitin → Sitrulin (Enzim: Ornitin transkarbamilase).
-
Sitrulin + Aspartat → Argininosuksinat (Enzim: Argininosuksinat sintetase).
-
Argininosuksinat → Arginin + Fumarat (Enzim: Argininosuksinat liase).
-
Arginin → Ornitin + Urea (Enzim: Arginase).
Urea yang dihasilkan kemudian masuk ke aliran darah dan diekskresikan melalui ginjal dalam urin.
6. Kesimpulan
Slide ini menjelaskan bagaimana katabolisme gugus amino terjadi dalam tubuh, yang mencakup:
-
Transaminasi → Transfer gugus amino ke α-ketoglutarat.
-
Deaminasi Oksidatif → Pengubahan glutamat menjadi amonia.
-
Transport Amonia → Pengangkutan nitrogen ke hati dalam bentuk glutamin atau alanin.
-
Siklus Urea → Pembuangan nitrogen dalam bentuk urea (hanya pada mamalia dan manusia).
Proses ini sangat penting untuk menghindari toksisitas amonia dalam tubuh, serta memastikan bahwa nitrogen berlebih dapat dibuang secara aman.
112 Syarah (Penjelasan) Slide ke-56
Slide ini membahas reaksi transaminasi, yang merupakan langkah utama dalam metabolisme asam amino. Berikut adalah syarah PPT untuk slide ini:
1. Definisi Reaksi Transaminasi
Reaksi transaminasi adalah proses pemindahan gugus amino (-NH₂) dari satu asam amino ke asam keto, membentuk asam amino baru dan asam keto baru. Reaksi ini sangat penting dalam metabolisme karena:
-
Menghubungkan metabolisme asam amino dengan metabolisme energi.
-
Memungkinkan tubuh untuk menyeimbangkan jumlah asam amino sesuai kebutuhan.
-
Mempersiapkan asam amino untuk degradasi lebih lanjut melalui deaminasi oksidatif.
Reaksi ini tidak menyebabkan hilangnya nitrogen dari sistem, karena hanya terjadi pertukaran antara gugus amino dan gugus karbonil.
2. Mekanisme Transaminasi
Reaksi transaminasi dikatalisis oleh enzim aminotransferase (transaminase), dengan piridoksal fosfat (PLP, turunan vitamin B6) sebagai kofaktor. Proses ini dapat digambarkan sebagai:
-
Asam amino + α-ketoglutarat → Asam keto + Glutamat
-
Gugus amino dari asam amino dipindahkan ke α-ketoglutarat, membentuk glutamat dan asam keto baru.
-
-
Glutamat sebagai reservoir nitrogen
-
Glutamat menyimpan nitrogen yang nantinya akan mengalami deaminasi oksidatif untuk menghasilkan amonia (NH₃), yang kemudian masuk ke siklus urea.
-
Contoh reaksi transaminasi spesifik:
-
Alanine + α-ketoglutarat → Piruvat + Glutamat (Enzim: Alanine aminotransferase / ALT).
-
Aspartat + α-ketoglutarat → Oksaloasetat + Glutamat (Enzim: Aspartate aminotransferase / AST).
3. Signifikansi Biologis Transaminasi
-
Menjaga keseimbangan asam amino di dalam tubuh.
-
Menghasilkan prekursor metabolik untuk siklus TCA dan glukoneogenesis.
-
Langkah awal dalam katabolisme nitrogen, mempersiapkan nitrogen untuk dibuang melalui siklus urea.
-
Indikator klinis untuk fungsi hati → Enzim ALT dan AST sering digunakan sebagai penanda kerusakan hati, karena kadar mereka meningkat dalam darah saat terjadi penyakit hati seperti hepatitis atau sirosis.
4. Kesimpulan
Reaksi transaminasi memungkinkan pertukaran gugus amino antara asam amino dan asam keto, tanpa menyebabkan kehilangan nitrogen dari sistem. Proses ini memfasilitasi metabolisme asam amino, menghasilkan prekursor metabolik yang dapat masuk ke jalur energi, serta mempersiapkan kelebihan nitrogen untuk ekskresi melalui siklus urea.
114 Syarah (Penjelasan) Slide ke-57
Slide ini menampilkan reaksi umum transaminasi, yaitu reaksi pertukaran gugus amino antara asam amino dan asam keto. Berikut adalah syarah PPT untuk slide ini:
1. Reaksi Umum Transaminasi
Transaminasi adalah proses di mana gugus amino (-NH₂) dari satu asam amino dipindahkan ke asam keto, menghasilkan asam amino baru dan asam keto baru. Reaksi ini terjadi tanpa kehilangan nitrogen dari sistem, karena hanya terjadi pertukaran antara gugus amino dan gugus karbonil.
Reaksi umum transaminasi dapat ditulis sebagai:
Asam Amino1+Asam Keto2→Asam Keto1+Asam Amino2\text{Asam Amino}_1 + \text{Asam Keto}_2 \rightarrow \text{Asam Keto}_1 + \text{Asam Amino}_2Asam Amino1+Asam Keto2→Asam Keto1+Asam Amino2
Di mana:
-
R1 adalah gugus samping dari asam amino pertama.
-
R2 adalah gugus samping dari asam keto kedua.
-
Asam amino 1 mentransfer gugus aminonya ke asam keto 2, menghasilkan asam amino 2 dan asam keto 1.
2. Mekanisme Enzimatik
Reaksi ini dikatalisis oleh enzim aminotransferase (transaminase) dan membutuhkan piridoksal fosfat (PLP, turunan vitamin B6) sebagai kofaktor.
Langkah-langkah reaksi transaminasi:
-
Asam amino pertama mendonorkan gugus aminonya ke PLP, menghasilkan asam keto pertama.
-
PLP kemudian mentransfer gugus amino ke asam keto kedua, mengubahnya menjadi asam amino kedua.
PLP berperan sebagai pembawa sementara gugus amino, memungkinkan pertukaran antara asam amino dan asam keto.
3. Contoh Reaksi Transaminasi
-
Alanine + α-Ketoglutarat → Piruvat + Glutamat
-
Enzim: Alanine aminotransferase (ALT).
-
Piruvat dapat masuk ke jalur glikolisis atau glukoneogenesis.
-
Glutamat menjadi pool nitrogen untuk deaminasi oksidatif.
-
-
Aspartat + α-Ketoglutarat → Oksaloasetat + Glutamat
-
Enzim: Aspartate aminotransferase (AST).
-
Oksaloasetat masuk ke siklus TCA.
-
4. Signifikansi Biologis
-
Menghubungkan metabolisme asam amino dengan metabolisme energi.
-
Menyeimbangkan kadar asam amino di dalam tubuh.
-
Menyiapkan nitrogen untuk ekskresi melalui siklus urea.
-
Digunakan sebagai penanda klinis kesehatan hati → Enzim ALT dan AST meningkat dalam darah pada kondisi kerusakan hati seperti hepatitis.
5. Kesimpulan
Slide ini menunjukkan bahwa reaksi transaminasi adalah proses utama dalam metabolisme asam amino, memungkinkan pertukaran gugus amino antara asam amino dan asam keto. Proses ini penting dalam homeostasis nitrogen, biosintesis asam amino, serta persiapan ekskresi nitrogen.
116 Syarah (Penjelasan) Slide ke-58
Slide ini menggambarkan proses transaminasi dalam hepatosit (sel hati), dengan fokus pada kerja enzim aminotransferase dalam pemindahan gugus amino. Berikut adalah syarah PPT untuk slide ini:
1. Lokasi Transaminasi dalam Hepatosit
-
Transaminasi terjadi di hati, khususnya dalam hepatosit, yang merupakan sel utama dalam metabolisme nitrogen.
-
Struktur yang ditampilkan menunjukkan lobulus hati, unit fungsional hati, yang terdiri dari hepatosit yang mengatur metabolisme protein, karbohidrat, dan lemak.
-
Hepatosit mengubah asam amino menjadi asam keto dengan bantuan enzim aminotransferase, mempersiapkan nitrogen untuk ekskresi dalam bentuk urea.
2. Mekanisme Reaksi Transaminasi
Reaksi transaminasi memindahkan gugus amino (-NH₂) dari asam amino ke asam keto, sehingga menghasilkan asam amino baru dan asam keto baru. Mekanismenya sebagai berikut:
-
Asam Amino + α-Ketoglutarat → Asam Keto + Glutamat
-
Gugus amino dari asam amino dipindahkan ke α-ketoglutarat, menghasilkan glutamat.
-
Asam amino yang kehilangan gugus aminonya berubah menjadi asam keto.
-
-
Enzim Aminotransferase
-
Enzim yang mengkatalisis reaksi ini disebut aminotransferase (transaminase).
-
Contoh enzim spesifik:
-
Alanine aminotransferase (ALT) → Mengubah alanin menjadi piruvat.
-
Aspartate aminotransferase (AST) → Mengubah aspartat menjadi oksaloasetat.
-
-
Piridoksal fosfat (PLP, turunan vitamin B6) diperlukan sebagai kofaktor.
-
-
Peran Glutamat dalam Metabolisme Nitrogen
-
Glutamat yang terbentuk menyimpan nitrogen untuk selanjutnya mengalami deaminasi oksidatif, menghasilkan amonium (NH₄⁺).
-
NH₄⁺ akan masuk ke siklus urea untuk dibuang dalam bentuk urea melalui ginjal.
-
3. Contoh Reaksi Spesifik dalam Transaminasi
Salah satu contoh reaksi transaminasi yang ditampilkan dalam slide ini adalah:
Alanine+α-Ketoglutarat→Piruvat+Glutamat\text{Alanine} + \alpha\text{-Ketoglutarat} \rightarrow \text{Piruvat} + \text{Glutamat}Alanine+α-Ketoglutarat→Piruvat+Glutamat
-
Alanin (asam amino) kehilangan gugus aminonya dan berubah menjadi piruvat (asam keto).
-
α-Ketoglutarat menerima gugus amino dan berubah menjadi glutamat.
Glutamat yang terbentuk kemudian akan masuk ke proses deaminasi oksidatif, di mana gugus aminonya dilepaskan sebagai amonia (NH₃) dan selanjutnya masuk ke siklus urea.
4. Signifikansi Biologis Transaminasi
-
Mengatur kadar asam amino dalam tubuh.
-
Menghubungkan metabolisme protein dengan metabolisme energi, karena produk transaminasi seperti piruvat dan oksaloasetat dapat masuk ke siklus TCA.
-
Mempersiapkan nitrogen untuk ekskresi, karena glutamat yang terbentuk akan menjalani deaminasi oksidatif, menghasilkan amonia yang harus dikeluarkan oleh tubuh.
5. Kesimpulan
Slide ini menampilkan proses transaminasi dalam hepatosit, yang dikatalisis oleh aminotransferase dengan bantuan PLP. Reaksi ini merupakan langkah pertama dalam metabolisme nitrogen, memungkinkan pertukaran gugus amino antara asam amino dan asam keto, serta menjadi langkah awal dalam pembuangan nitrogen berlebih melalui siklus urea.
118 Syarah (Penjelasan) Slide ke-59
Slide ini membahas peran enzim aminotransferase dalam reaksi transaminasi, serta keterlibatan piridoksal fosfat (PLP) sebagai kofaktor esensial. Berikut adalah syarah PPT untuk slide ini:
1. Peran Enzim Aminotransferase dalam Transaminasi
-
Aminotransferase (Transaminase) adalah enzim yang mengkatalisis pemindahan gugus amino dari asam amino ke asam keto.
-
Reaksi ini penting dalam metabolisme nitrogen, karena memungkinkan tubuh untuk:
-
Mengubah satu jenis asam amino menjadi jenis lainnya.
-
Menghasilkan prekursor metabolik yang masuk ke siklus TCA atau glukoneogenesis.
-
Mengarahkan nitrogen ke siklus urea untuk ekskresi.
-
Terdapat dua enzim aminotransferase utama yang sering digunakan sebagai penanda klinis fungsi hati:
-
Alanine Aminotransferase (ALT)
-
Mengubah alanin → piruvat.
-
Banyak ditemukan dalam hepatosit, sehingga ALT meningkat dalam darah jika terjadi kerusakan hati (seperti hepatitis).
-
-
Aspartate Aminotransferase (AST)
-
Mengubah aspartat → oksaloasetat.
-
Ditemukan di hati, jantung, dan otot rangka, sehingga peningkatan AST dapat mengindikasikan kerusakan hati atau otot.
-
2. Peran Piridoksal Fosfat (PLP) sebagai Kofaktor
-
Piridoksal fosfat (PLP) adalah turunan vitamin B6 yang berfungsi sebagai kofaktor esensial dalam reaksi transaminasi.
-
PLP bertindak sebagai pembawa sementara gugus amino selama transaminasi, memungkinkan pertukaran antara asam amino dan asam keto.
-
Struktur PLP yang ditampilkan dalam slide menunjukkan cincin piridin, yang memungkinkan interaksi dengan gugus amino.
Mekanisme PLP dalam transaminasi:
-
PLP menerima gugus amino dari asam amino, membentuk piridoksamin fosfat (PMP).
-
PMP kemudian mentransfer gugus amino ke asam keto, membentuk asam amino baru.
3. Signifikansi Biologis PLP dan Aminotransferase
-
PLP penting untuk sintesis neurotransmiter, seperti serotonin dan dopamin.
-
Defisiensi vitamin B6 dapat mengganggu transaminasi, menyebabkan gangguan metabolisme asam amino.
-
ALT dan AST sering digunakan sebagai uji klinis fungsi hati, karena peningkatan kadar enzim ini dalam darah dapat menandakan penyakit hati.
4. Kesimpulan
Slide ini menunjukkan bahwa aminotransferase berperan penting dalam metabolisme nitrogen, dengan bantuan piridoksal fosfat (PLP) sebagai kofaktor utama. Reaksi transaminasi yang dikatalisis enzim ini menghubungkan metabolisme asam amino dengan jalur energi, serta mempersiapkan nitrogen untuk ekskresi melalui siklus urea.
120 Syarah (Penjelasan) Slide ke-60
Slide ini menjelaskan dua jenis utama enzim transaminase dalam jaringan mamalia, yaitu alanin transaminase (ALT) dan glutamat transaminase (AST). Berikut adalah syarah PPT untuk slide ini:
1. Peran Enzim Transaminase dalam Metabolisme Nitrogen
Enzim transaminase berperan dalam pemindahan gugus amino (-NH₂) dari satu asam amino ke asam keto, sehingga memungkinkan pertukaran nitrogen tanpa kehilangan gugus amino dari sistem.
Terdapat dua jenis utama enzim transaminase yang bekerja dalam semua jaringan mamalia, terutama di hati, otot, dan ginjal:
-
Alanin Transaminase (ALT)
-
Glutamat Transaminase (AST)
2. Alanin Transaminase (ALT)
-
Mengatalisis transfer gugus amino dari asam amino ke piruvat, membentuk alanin.
-
Reaksi utama yang dikatalisis oleh ALT:
Asam amino+Piruvat→Asam keto+Alanin\text{Asam amino} + \text{Piruvat} \rightarrow \text{Asam keto} + \text{Alanin}Asam amino+Piruvat→Asam keto+Alanin
-
Alanin yang dihasilkan kemudian dapat masuk ke siklus alanin-glukosa untuk mengangkut nitrogen dari otot ke hati.
-
ALT banyak ditemukan dalam hati, sehingga digunakan sebagai penanda klinis untuk menilai kerusakan hati. Jika ALT meningkat dalam darah, ini bisa mengindikasikan kerusakan hepatosit, seperti pada hepatitis.
3. Glutamat Transaminase (AST)
-
Juga dikenal sebagai Aspartate Aminotransferase (AST).
-
Memindahkan gugus amino dari hampir semua asam amino ke α-ketoglutarat, menghasilkan glutamat.
-
Reaksi utama yang dikatalisis oleh AST:
Asam amino+α-Ketoglutarat→Asam keto+Glutamat\text{Asam amino} + \alpha\text{-Ketoglutarat} \rightarrow \text{Asam keto} + \text{Glutamat}Asam amino+α-Ketoglutarat→Asam keto+Glutamat
-
Glutamat berperan sebagai reservoir nitrogen utama dalam tubuh, yang dapat:
-
Mengalami deaminasi oksidatif untuk menghasilkan amonium (NH₄⁺) yang masuk ke siklus urea.
-
Digunakan kembali dalam transaminasi dengan asam keto lain.
-
-
AST banyak ditemukan di hati, jantung, otot rangka, dan ginjal. Peningkatan kadar AST dalam darah bisa menjadi indikator kerusakan jaringan hati, jantung, atau otot.
4. Signifikansi Klinis ALT dan AST
-
Kedua enzim ini digunakan dalam uji fungsi hati, tetapi ALT lebih spesifik untuk kerusakan hati, sementara AST juga meningkat pada gangguan otot atau jantung.
-
Rasio AST/ALT (Rasio De Ritis) sering digunakan untuk membantu diagnosis penyakit hati:
-
Jika ALT > AST → Mengindikasikan hepatitis virus atau penyakit hati akut.
-
Jika AST > ALT → Mengindikasikan kerusakan hati akibat alkohol atau sirosis.
-
5. Kesimpulan
Slide ini menunjukkan bahwa alanin transaminase (ALT) dan glutamat transaminase (AST) adalah dua enzim utama dalam metabolisme nitrogen, yang memungkinkan pertukaran gugus amino antara asam amino dan asam keto. Proses ini menghubungkan metabolisme protein dengan siklus energi, serta mempersiapkan nitrogen untuk ekskresi melalui siklus urea. ALT dan AST juga memiliki nilai diagnostik dalam menilai fungsi hati dan jaringan lain.
122 Syarah (Penjelasan) Slide ke-61
Slide ini membahas biosintesis rantai samping asam amino, yang merupakan bagian penting dalam sintesis berbagai asam amino esensial dan non-esensial. Berikut adalah syarah PPT untuk slide ini:
1. Apa Itu Rantai Samping Asam Amino?
-
Rantai samping (side chain) asam amino adalah gugus tambahan yang melekat pada kerangka dasar asam amino (gugus amina, karbon α, gugus karboksil).
-
Variasi dalam rantai samping menentukan sifat fisikokimia asam amino, seperti hidrofilisitas, hidrofobisitas, dan reaktivitasnya dalam reaksi biokimia.
Asam amino dapat dikelompokkan berdasarkan struktur dan sifat rantai sampingnya, misalnya:
-
Asam amino rantai bercabang (Branched-Chain Amino Acids/BCAAs) → Leusin, Isoleusin, dan Valin.
-
Asam amino aromatik → Fenilalanin, Tirosin, dan Triptofan.
-
Asam amino bermuatan (positif/negatif) → Arginin, Histidin, dan Asam Aspartat.
-
Asam amino dengan gugus sulfur → Sistein dan Metionin.
2. Biosintesis Rantai Samping Asam Amino
Sintesis rantai samping asam amino sangat bergantung pada jalur metabolisme utama dalam sel, terutama jalur glikolisis, siklus asam sitrat (TCA), dan jalur pentosa fosfat. Berikut adalah beberapa contoh biosintesis rantai samping asam amino:
-
Biosintesis Asam Amino Rantai Bercabang (Leusin, Isoleusin, Valin)
-
Berasal dari piruvat sebagai prekursor utama.
-
Memerlukan enzim branched-chain aminotransferase (BCAT).
-
Proses ini terjadi terutama di otot dan hati.
-
-
Biosintesis Asam Amino Aromatik (Fenilalanin, Tirosin, Triptofan)
-
Menggunakan jalur sikimat (hanya terjadi pada tumbuhan dan bakteri).
-
Fenilalanin dapat dikonversi menjadi tirosin melalui enzim fenilalanin hidroksilase.
-
-
Biosintesis Asam Amino Bermuatan
-
Glutamat dan Glutamin berasal dari α-ketoglutarat (intermediat siklus TCA).
-
Aspartat dan Asparagin berasal dari oksaloasetat.
-
Arginin terbentuk melalui siklus urea.
-
-
Biosintesis Asam Amino Sulfur (Sistein dan Metionin)
-
Metionin berasal dari jalur asam aspartat dan memerlukan homosistein sebagai perantara.
-
Sistein dapat terbentuk dari metionin melalui jalur transsulfurasi.
-
3. Signifikansi Biosintesis Rantai Samping Asam Amino
-
Menentukan fungsi biologis protein dalam tubuh.
-
Berperan dalam sintesis neurotransmiter (misalnya, tirosin digunakan dalam sintesis dopamin, epinefrin, dan norepinefrin).
-
Penting dalam metabolisme energi, terutama untuk BCAA yang menjadi sumber energi alternatif dalam otot.
-
Keterkaitan dengan penyakit metabolik, seperti fenilketonuria (PKU) akibat gangguan konversi fenilalanin menjadi tirosin.
4. Kesimpulan
Slide ini memperkenalkan biosintesis rantai samping asam amino, yang melibatkan berbagai jalur metabolisme utama dalam sel. Struktur rantai samping menentukan sifat dan fungsi asam amino, serta memainkan peran penting dalam sintesis protein dan jalur metabolisme lainnya.
124 Syarah (Penjelasan) Slide ke-62
Slide ini menampilkan jalur biosintesis asam amino berdasarkan prekursor metabolik utama. Berikut adalah syarah PPT untuk slide ini:
1. Prekursor Metabolik dalam Biosintesis Asam Amino
Biosintesis asam amino bergantung pada senyawa prekursor yang berasal dari jalur metabolisme utama, seperti:
-
Siklus asam sitrat (TCA)
-
Glikolisis
-
Jalur pentosa fosfat (PPP)
Pada diagram ini, asam amino dikategorikan berdasarkan asal prekursornya.
2. Jalur Biosintesis Berdasarkan Prekursor
a. α-Ketoglutarat → Keluarga Glutamat
Prekursor: α-Ketoglutarat
Produk: Glutamat, Glutamin, Prolin, Arginin
-
Glutamat (Glu) adalah prekursor utama dalam biosintesis asam amino lain.
-
Glutamin (Gln) terbentuk melalui amidasi glutamat dengan bantuan glutamin sintetase.
-
Prolin (Pro) terbentuk dari reduksi glutamat.
-
Arginin (Arg) dihasilkan melalui jalur siklus urea.
b. Oksaloasetat → Keluarga Aspartat
Prekursor: Oksaloasetat
Produk: Aspartat, Asparagin, Metionin, Treonin, Lisin
-
Aspartat (Asp) terbentuk dari transaminasi oksaloasetat.
-
Asparagin (Asn) disintesis dari aspartat melalui amidasi.
-
Metionin (Met), Treonin (Thr), dan Lisin (Lys) adalah asam amino esensial yang tidak dapat disintesis oleh manusia.
c. 3-Phosphoglycerate → Keluarga Serin
Prekursor: 3-Phosphoglycerate (intermediat glikolisis)
Produk: Serin, Sistein, Glisin
-
Serin (Ser) terbentuk dari 3-phosphoglycerate melalui jalur reduksi.
-
Glisin (Gly) dihasilkan dari serin melalui enzim serin hidroksimetiltransferase.
-
Sistein (Cys) berasal dari serin dan membutuhkan sulfur dari metionin.
d. Piruvat → Keluarga Piruvat
Prekursor: Piruvat
Produk: Alanin, Valin, Leusin, Isoleusin
-
Alanin (Ala) terbentuk melalui transaminasi piruvat.
-
Valin (Val), Leusin (Leu), dan Isoleusin (Ile) adalah asam amino rantai bercabang (BCAA) yang penting dalam metabolisme energi.
e. Phosphoenolpyruvate & Erythrose-4-Phosphate → Keluarga Aromatik
Prekursor: Phosphoenolpyruvate (PEP) & Erythrose-4-Phosphate
Produk: Fenilalanin, Tirosin, Triptofan
-
Fenilalanin (Phe) dapat dikonversi menjadi tirosin melalui enzim fenilalanin hidroksilase.
-
Triptofan (Trp) berperan dalam sintesis serotonin dan niasin.
f. Ribose-5-Phosphate → Keluarga Histidin
Prekursor: Ribose-5-Phosphate
Produk: Histidin
-
Histidin (His) adalah asam amino esensial yang berasal dari jalur pentosa fosfat.
3. Signifikansi Biologis
-
Klasifikasi ini membantu memahami hubungan antara metabolisme energi dan sintesis asam amino.
-
Asam amino esensial harus diperoleh dari makanan, sementara asam amino non-esensial dapat disintesis dalam tubuh.
-
Beberapa penyakit metabolik terjadi akibat gangguan dalam jalur biosintesis ini, seperti fenilketonuria (PKU) akibat defisiensi enzim fenilalanin hidroksilase.
4. Kesimpulan
Slide ini menampilkan jalur biosintesis asam amino berdasarkan prekursornya, yang berasal dari glikolisis, siklus TCA, dan jalur pentosa fosfat. Jalur ini memungkinkan konversi metabolit utama menjadi asam amino esensial dan non-esensial, yang berperan penting dalam sintesis protein dan metabolisme sel.
126 Syarah (Penjelasan) Slide ke-63
Slide ini menjelaskan sintesis asam amino aspartat dan alanin melalui reaksi transaminasi, serta keterlibatan oksaloasetat dan piruvat dalam biosintesis rantai samping asam amino. Berikut adalah syarah PPT untuk slide ini:
1. Transaminasi: Reaksi Dasar dalam Biosintesis Asam Amino
Transaminasi adalah proses pemindahan gugus amino (-NH₂) dari satu asam amino ke suatu asam keto, yang memungkinkan sintesis berbagai asam amino dari prekursor metabolik.
Reaksi umum transaminasi dapat dituliskan sebagai:
α-Keto Acid a+α-Amino Acid b→α-Amino Acid a+α-Keto Acid b\alpha\text{-Keto Acid a} + \alpha\text{-Amino Acid b} \rightarrow \alpha\text{-Amino Acid a} + \alpha\text{-Keto Acid b}α-Keto Acid a+α-Amino Acid b→α-Amino Acid a+α-Keto Acid b
Dalam hal ini:
-
Piruvat (α-keto acid) menerima gugus amino dari glutamat, membentuk alanin dan α-ketoglutarat.
-
Oksaloasetat menerima gugus amino dari glutamat, membentuk aspartat dan α-ketoglutarat.
2. Enzim yang Berperan dalam Reaksi Transaminasi
Reaksi transaminasi ini dikatalisis oleh dua enzim utama:
a. Alanin Transaminase (ALT) atau Glutamat-Piruvat Transaminase (GPT)
Piruvat+Glutamat→Alanin+α-Ketoglutarat\text{Piruvat} + \text{Glutamat} \rightarrow \text{Alanin} + \alpha\text{-Ketoglutarat}Piruvat+Glutamat→Alanin+α-Ketoglutarat
-
Alanin transaminase (ALT) berfungsi dalam metabolisme nitrogen dan jalur siklus alanin-glukosa.
-
ALT juga merupakan penanda diagnostik penting untuk fungsi hati, karena peningkatan ALT dalam darah sering dikaitkan dengan kerusakan hati.
b. Aspartat Transaminase (AST) atau Glutamat-Oksaloasetat Transaminase (GOT)
Oksaloasetat+Glutamat→Aspartat+α-Ketoglutarat\text{Oksaloasetat} + \text{Glutamat} \rightarrow \text{Aspartat} + \alpha\text{-Ketoglutarat}Oksaloasetat+Glutamat→Aspartat+α-Ketoglutarat
-
Aspartat transaminase (AST) berperan dalam sintesis asam aspartat, yang penting dalam siklus urea dan sintesis nukleotida.
-
AST juga digunakan sebagai penanda klinis dalam diagnosis penyakit hati dan jantung.
3. Peran Oksaloasetat dan Piruvat dalam Sintesis Rantai Samping Asam Amino
-
Oksaloasetat dan piruvat tidak hanya berperan dalam transaminasi, tetapi juga merupakan prekursor utama dalam sintesis rantai samping asam amino seperti isoleusin, leusin, dan valin.
-
Piruvat → Merupakan prekursor valin, leusin, dan isoleusin, yang merupakan asam amino rantai bercabang (BCAA).
-
Oksaloasetat → Berkontribusi dalam jalur biosintesis asparagin, metionin, treonin, dan lisin.
4. Signifikansi Biologis
-
Transaminasi memungkinkan daur ulang nitrogen dalam tubuh, tanpa harus bergantung pada asupan protein dari makanan.
-
BCAA seperti leusin, isoleusin, dan valin memainkan peran penting dalam metabolisme energi otot, terutama selama kondisi kelaparan atau latihan intens.
-
Gangguan pada transaminasi dapat menyebabkan akumulasi zat toksik, seperti dalam penyakit fenilketonuria (PKU) dan penyakit hati.
5. Kesimpulan
Slide ini menjelaskan bagaimana reaksi transaminasi dari oksaloasetat dan piruvat memungkinkan sintesis asam aspartat dan alanin, serta bagaimana prekursor ini juga berkontribusi dalam biosintesis asam amino rantai bercabang. Reaksi ini penting dalam metabolisme nitrogen, biosintesis protein, dan metabolisme energi.
128 Syarah (Penjelasan) Slide ke-64
Slide ini menjelaskan biosintesis asam amino rantai bercabang (BCAA), yaitu valin, leusin, dan isoleusin, dari prekursor metabolik utama. Berikut adalah syarah PPT untuk slide ini:
1. Jalur Biosintesis Asam Amino Rantai Bercabang (BCAA)
Asam amino valin (Val), leusin (Leu), dan isoleusin (Ile) disebut asam amino rantai bercabang (BCAA) karena memiliki cabang hidrokarbon pada rantai sampingnya. Mereka disintesis dari piruvat dan α-ketobutirat melalui serangkaian reaksi yang melibatkan enzim khusus.
2. Prekursor dan Jalur Biosintesis
a. Prekursor Awal
-
Piruvat (Pyruvate) → prekursor utama untuk valin dan leusin.
-
α-Ketobutirat → prekursor utama untuk isoleusin (dihasilkan dari deaminasi treonin).
b. Tahapan Umum Biosintesis BCAA
-
Kondensasi Prekursor
-
Piruvat dan α-ketobutirat dikondensasikan oleh enzim acetohydroxy acid synthase untuk membentuk α-aceto-α-hydroxybutyrate (prekursor isoleusin) dan α-acetoacetate (prekursor valin dan leusin).
-
-
Reduksi dan Isomerisasi
-
Isomerase dan reduktase mengubah senyawa ini menjadi dihydroxy acid.
-
α,β-Dihydroxy-β-methylvalerate untuk isoleusin.
-
α,β-Dihydroxyisovalerate untuk leusin dan valin.
-
-
Dehidrasi dan Transaminasi
-
Dihydroxy acid dehydrase menghilangkan gugus hidroksil, menghasilkan α-keto acid spesifik.
-
Transaminasi oleh enzim aminotransferase menggunakan glutamat sebagai donor gugus amino untuk menghasilkan asam amino akhir.
-
3. Reaksi Akhir dan Produk Biosintesis
-
α-Keto-β-methylvalerate → L-Isoleusin
-
α-Keto-isovalerate → L-Valin
-
α-Keto-isocaproate → L-Leusin (melalui empat tahap tambahan)
4. Signifikansi Biologis
-
BCAA memainkan peran kunci dalam metabolisme energi otot, terutama selama puasa dan latihan intens.
-
Leusin merangsang sintesis protein dan berperan sebagai sinyal metabolik dalam regulasi mTOR (mechanistic target of rapamycin), yang penting dalam pertumbuhan sel dan metabolisme otot.
-
Defisiensi enzim dalam jalur ini menyebabkan kelainan metabolik, seperti Maple Syrup Urine Disease (MSUD), di mana tubuh tidak dapat memetabolisme BCAA dengan baik, menyebabkan akumulasi metabolit toksik.
5. Kesimpulan
Slide ini menjelaskan bagaimana valin, leusin, dan isoleusin disintesis dari piruvat dan α-ketobutirat melalui jalur biosintesis asam amino rantai bercabang. Reaksi ini penting dalam metabolisme energi, sintesis protein, dan regulasi metabolisme otot.
130 Syarah (Penjelasan) Slide ke-65
Slide ini menjelaskan proses trans-deaminasi, yang merupakan mekanisme utama dalam katabolisme asam amino. Berikut adalah syarah PPT untuk slide ini:
1. Pengertian Trans-Deaminasi
Trans-deaminasi adalah kombinasi dari reaksi transaminasi dan deaminasi oksidatif, yang memungkinkan penghilangan gugus amino (-NH₂) dari asam amino untuk dibuang dalam bentuk amonia (NH₃) atau digunakan kembali dalam metabolisme nitrogen.
-
Transaminasi: Proses di mana gugus amino dari suatu asam amino dipindahkan ke α-ketoglutarat, menghasilkan glutamat dan α-keto acid.
-
Deaminasi Oksidatif: Proses di mana glutamat mengalami deaminasi oleh enzim glutamat dehidrogenase, menghasilkan NH₃ (amonia) dan regenerasi α-ketoglutarat.
2. Jalur Reaksi Trans-Deaminasi
-
Langkah Transaminasi
-
Amino acid + α-ketoglutarate → Keto acid + Glutamate
-
Reaksi ini dikatalisis oleh enzim transaminase.
-
Produk utama: glutamat, yang berperan sebagai pembawa utama gugus amino dalam tubuh.
-
-
Langkah Deaminasi Oksidatif
-
Glutamate + NAD(P)⁺ + H₂O → α-Ketoglutarate + NH₃ + NAD(P)H
-
Reaksi ini dikatalisis oleh enzim glutamat dehidrogenase.
-
Produk utama: α-ketoglutarat (digunakan kembali dalam siklus Krebs) dan amonia (dibuang melalui siklus urea).
-
3. Signifikansi Biologis Trans-Deaminasi
-
Pembuangan Nitrogen: Proses ini penting dalam pengeluaran nitrogen dari tubuh, terutama melalui siklus urea di hati.
-
Regenerasi α-Ketoglutarat: α-Ketoglutarat yang dihasilkan dapat digunakan kembali dalam metabolisme energi (siklus TCA).
-
Detoksifikasi Amonia: NH₃ yang dihasilkan beracun bagi sel dan harus segera dikonversi menjadi urea (pada mamalia) atau asam urat/ammonia (pada organisme lain).
4. Kesimpulan
Trans-deaminasi adalah mekanisme utama dalam katabolisme asam amino, yang menggabungkan transaminasi dan deaminasi oksidatif untuk membuang nitrogen dalam bentuk amonia. Proses ini sangat penting dalam metabolisme nitrogen, homeostasis asam amino, dan detoksifikasi amonia.
132 Syarah (Penjelasan) Slide ke-66
1. Definisi Deaminasi Oksidatif
Deaminasi oksidatif adalah proses pelepasan gugus amino (-NH₂) dari asam amino dalam bentuk amonia (NH₃) melalui reaksi oksidasi, menghasilkan α-keto acid yang dapat digunakan dalam metabolisme energi.
-
Proses ini terjadi terutama di hati dan ginjal untuk membuang nitrogen berlebih.
-
Produk utama: α-keto acid + NH₃ (amonia).
-
NH₃ harus segera dikeluarkan atau diubah menjadi urea melalui siklus urea untuk mencegah toksisitas.
2. Enzim yang Berperan dalam Deaminasi Oksidatif
Proses ini dikatalisis oleh enzim oksidase asam amino, yang terbagi menjadi dua jenis:
-
Oksidase L-asam amino
-
Berfungsi mengkatalisis L-asam amino (bentuk biologis utama asam amino dalam tubuh).
-
Koenzim: FMN (Flavin Mononucleotide).
-
Menghasilkan H₂O₂ (hidrogen peroksida) sebagai produk sampingan.
-
-
Oksidase D-asam amino
-
Berfungsi mengkatalisis D-asam amino (terdapat dalam beberapa bakteri dan jaringan mamalia tertentu).
-
Koenzim: FAD (Flavin Adenine Dinucleotide).
-
Memiliki peran lebih kecil dalam metabolisme mamalia.
-
3. Mekanisme Reaksi Deaminasi Oksidatif
-
L-asam amino + FMN → α-Keto acid + NH₃ + FMNH₂
-
FMNH₂ kemudian diregenerasi kembali menjadi FMN dengan pelepasan H₂O₂.
-
Amonia (NH₃) yang dihasilkan akan masuk ke siklus urea untuk detoksifikasi.
4. Signifikansi Biologis Deaminasi Oksidatif
-
Membuang nitrogen berlebih dari tubuh dengan mengubahnya menjadi urea.
-
Menghasilkan α-keto acid, yang dapat digunakan dalam siklus Krebs atau glukoneogenesis.
-
Menjaga homeostasis nitrogen dalam tubuh.
5. Kesimpulan
Deaminasi oksidatif adalah proses penting dalam katabolisme asam amino, yang terjadi terutama di hati dan ginjal. Oksidase asam amino berperan dalam reaksi ini, dengan koenzim FMN dan FAD yang membantu transfer elektron selama oksidasi. Hasil akhirnya adalah α-keto acid dan amonia, yang kemudian dikeluarkan melalui siklus urea.
134 Syarah (Penjelasan) Slide ke-67
1. Pengantar Sintesis Urea
Sintesis urea adalah proses detoksifikasi amonia (NH₃) dalam tubuh, yang terjadi di hati melalui siklus urea (siklus ornithine). Urea yang dihasilkan kemudian dikeluarkan melalui ginjal dalam urin.
Reaksi utama:
NH₃ + CO₂ + Aspartat → Urea + Fumarat
2. Zat yang Diperlukan dalam Sintesis Urea
Untuk menghasilkan satu molekul urea, diperlukan:
-
1 molekul amonia (NH₃) → berasal dari deaminasi oksidatif glutamat di mitokondria hati.
-
2 molekul karbon dioksida (CO₂) → berasal dari siklus Krebs.
-
1 molekul aspartat → berasal dari transaminasi glutamat atau transaminase aspartat di sitosol.
3. Peran Gugus Amino dalam Sintesis Urea
Terdapat dua gugus amino utama yang berkontribusi dalam pembentukan urea:
-
Gugus amino pertama
-
Berasal dari NH₃ bebas, yang dilepaskan melalui deaminasi oksidatif glutamat di mitokondria hati.
-
NH₃ ini bereaksi dengan karbon dioksida (CO₂) untuk membentuk karbamoil fosfat, yang merupakan langkah awal dalam siklus urea.
-
-
Gugus amino kedua
-
Berasal dari asam amino aspartat, yang diperoleh melalui reaksi transaminasi antara glutamat dan oksaloasetat.
-
Aspartat berperan dalam pembentukan argininosuksinat, yang kemudian dipecah menjadi arginin dan fumarat.
-
4. Mekanisme Kondensasi dalam Sintesis Urea
-
Gugus amino dari aspartat akan berkondensasi dengan karbamoil fosfat.
-
Proses ini membentuk argininosuksinat, yang kemudian dipecah menjadi arginin dan fumarat.
-
Arginin akan mengalami hidrolisis menjadi urea dan ornithine.
-
Ornithine akan diregenerasi dan kembali ke mitokondria untuk memulai siklus urea kembali.
5. Kesimpulan
-
Siklus urea adalah proses utama untuk mengeluarkan nitrogen berlebih dari tubuh.
-
NH₃ dari deaminasi oksidatif glutamat dan aspartat adalah sumber utama nitrogen dalam urea.
-
Siklus ini erat terkait dengan siklus Krebs, karena fumarat yang dihasilkan dalam siklus urea dapat masuk kembali ke siklus Krebs.
-
Defisiensi enzim dalam siklus urea dapat menyebabkan hiperamonemia, yang berbahaya bagi sistem saraf.
136 Syarah (Penjelasan) Slide ke-68
1. Pengantar: Hubungan Glutamat dan Siklus Urea
Pada slide ini ditampilkan hubungan antara glutamat dehidrogenase, amonia (NH₃), dan siklus urea di hati. Proses ini sangat penting untuk metabolisme nitrogen dalam tubuh.
Glutamat adalah molekul kunci dalam regulasi nitrogen, yang berperan dalam:
Transaminasi (pemindahan gugus amino dari satu asam amino ke asam keto).
Deaminasi oksidatif (penghilangan gugus amino untuk menghasilkan amonia bebas).
Siklus urea untuk membuang nitrogen berlebih dalam bentuk urea.
2. Mekanisme Deaminasi Oksidatif Glutamat
Glutamat dehidrogenase (GDH) adalah enzim yang berperan dalam deaminasi oksidatif glutamat untuk menghasilkan amonia (NH₃).
Reaksi utama:
Glutamat + NAD(P)⁺ → α-Ketoglutarat + NH₃ + NAD(P)H
Langkah-langkah:
-
Glutamat mengalami deaminasi oksidatif oleh enzim glutamat dehidrogenase.
-
Reaksi ini menghasilkan α-iminoglutarat sebagai intermediat.
-
α-iminoglutarat selanjutnya dikonversi menjadi α-ketoglutarat, sambil melepaskan amonia (NH₃).
-
NAD(P)⁺ direduksi menjadi NAD(P)H, yang dapat digunakan dalam jalur metabolisme lainnya.
3. Peran Amonia (NH₃) dalam Siklus Urea
-
Amonia (NH₃) yang dihasilkan dari deaminasi oksidatif glutamat bersifat toksik, sehingga harus segera didetoksifikasi melalui siklus urea di hati.
-
NH₃ yang tidak segera masuk ke siklus urea dapat menyebabkan hiperamonemia, yang berbahaya bagi sistem saraf pusat.
-
Dalam siklus urea, NH₃ akan dikombinasikan dengan karbon dioksida (CO₂) dan aspartat untuk membentuk urea, yang kemudian diekskresikan melalui urin.
4. Pentingnya Regulasi Glutamat Dehidrogenase
-
Aktivitas glutamat dehidrogenase (GDH) dapat diatur oleh kadar ATP, ADP, dan GTP.
-
Jika energi dalam sel rendah (ADP tinggi), GDH akan diaktifkan untuk menghasilkan α-ketoglutarat yang dapat masuk ke siklus Krebs untuk produksi energi.
-
Jika energi dalam sel tinggi (ATP dan GTP tinggi), GDH dihambat, sehingga metabolisme nitrogen lebih terfokus pada sintesis protein atau metabolisme lainnya.
5. Kesimpulan
-
Glutamat dehidrogenase (GDH) berperan dalam deaminasi oksidatif glutamat untuk menghasilkan amonia (NH₃) dan α-ketoglutarat.
-
Amonia yang dihasilkan bersifat toksik, sehingga harus segera diubah menjadi urea dalam siklus urea.
-
Reaksi ini terkait erat dengan keseimbangan energi dalam tubuh, karena α-ketoglutarat yang dihasilkan dapat masuk ke siklus Krebs.
138 Syarah (Penjelasan) Slide ke-69
1. Pengantar: Peran Siklus Urea dalam Detoksifikasi Amonia
Siklus urea, juga dikenal sebagai siklus ornithine, merupakan jalur metabolisme utama yang bertanggung jawab untuk menghilangkan amonia (NH₃) dari tubuh dalam bentuk urea. Proses ini terjadi di hati, dengan sebagian reaksi berlangsung di mitokondria dan sebagian lainnya di sitosol.
Mengapa siklus urea penting?
Amonia (NH₃) bersifat toksik bagi sel, terutama pada sistem saraf.
Siklus urea mengubah amonia menjadi urea, yang bersifat lebih larut dalam air dan dapat diekskresikan melalui urin oleh ginjal.
Proses ini juga terhubung dengan siklus Krebs melalui fumarat, yang dapat masuk kembali ke siklus asam sitrat.
2. Reaksi Utama dalam Siklus Urea
Langkah 1: Sintesis Karbamoil Fosfat (Mitokondria)
-
NH₃ + HCO₃⁻ + 2 ATP → Karbamoil Fosfat + 2 ADP + Pᵢ
-
Enzim: Karbamoil fosfat sintetase I
-
Karbamoil fosfat adalah prekursor penting dalam siklus urea yang terbentuk dari amonia bebas.
Langkah 2: Pembentukan Citrulline (Mitokondria)
-
Karbamoil fosfat + Ornithine → Citrulline
-
Enzim: Ornithine transcarbamylase
-
Citrulline kemudian ditranspor keluar dari mitokondria menuju sitosol.
Langkah 3: Pembentukan Arginosuksinat (Sitosol)
-
Citrulline + Aspartat + ATP → Arginosuksinat + AMP + PPᵢ
-
Enzim: Arginosuksinat sintetase
-
Aspartat berperan sebagai donor nitrogen kedua dalam siklus ini.
Langkah 4: Pembentukan Arginine dan Fumarate (Sitosol)
-
Arginosuksinat → Arginine + Fumarate
-
Enzim: Arginosuksinat liase
-
Fumarate diubah menjadi malat dan masuk ke siklus Krebs untuk menghasilkan energi tambahan.
Langkah 5: Pembentukan Urea dan Regenerasi Ornithine
-
Arginine + H₂O → Urea + Ornithine
-
Enzim: Arginase
-
Ornithine yang terbentuk kembali masuk ke mitokondria untuk mengulangi siklus urea.
3. Hubungan dengan Metabolisme Asam Amino dan Siklus Krebs
-
Transaminasi: Amonia yang masuk ke siklus urea berasal dari transaminasi asam amino, di mana glutamat berperan sebagai donor utama gugus amino.
-
Siklus Krebs dan Siklus Urea saling berhubungan melalui fumarat, yang dapat masuk kembali ke siklus Krebs sebagai malat untuk regenerasi energi.
-
Keseimbangan nitrogen dalam tubuh dijaga dengan ketat untuk memastikan tidak ada akumulasi amonia yang bersifat toksik.
4. Regulasi Siklus Urea
-
Aktivitas siklus urea meningkat saat asupan protein tinggi, karena lebih banyak amonia yang harus diekskresikan.
-
Enzim kunci yang mengatur kecepatan siklus urea adalah karbamoil fosfat sintetase I (CPSI), yang diaktivasi oleh N-acetylglutamate (NAG).
-
Gangguan dalam siklus urea dapat menyebabkan hiperamonemia, kondisi di mana amonia dalam darah meningkat dan dapat menyebabkan kerusakan otak.
5. Kesimpulan
-
Siklus urea adalah jalur utama untuk membuang nitrogen berlebih dari tubuh dalam bentuk urea.
-
Reaksi ini terjadi di hati, dengan bagian awal berlangsung di mitokondria dan tahap selanjutnya di sitosol.
-
Siklus ini berhubungan erat dengan metabolisme asam amino dan siklus Krebs, memastikan efisiensi penggunaan energi dalam sel.
-
Gangguan pada enzim siklus urea dapat menyebabkan hiperamonemia, yang berbahaya bagi sistem saraf.
140 Syarah (Penjelasan) Slide ke-70
1. Siklus Urea (Siklus Ornithine)
Siklus urea terjadi di hati, di mana amonia (NH₃) yang berbahaya diubah menjadi urea untuk dibuang melalui urin. Reaksi-reaksi penting dalam siklus ini melibatkan mitokondria untuk sintesis karbamoil fosfat dan sitosol untuk langkah-langkah lanjutan.
2. Proses di Mitokondria: Sintesis Karbamoil Fosfat
Langkah pertama adalah konversi amonia menjadi karbamoil fosfat dalam mitokondria:
-
Reaksi:
NH₃ + HCO₃⁻ + 2 ATP → Karbamoil Fosfat + 2 ADP + Pᵢ -
Enzim: Karbamoil Fosfat Sintetase I
-
Fungsi: Amonia bergabung dengan bikarbonat untuk membentuk karbamoil fosfat, yang kemudian digunakan untuk membentuk citrulline.
3. Pembentukan Citrulline di Mitokondria
Karbamoil fosfat bereaksi dengan ornithine untuk membentuk citrulline, yang kemudian dipindahkan ke sitosol:
-
Reaksi:
Karbamoil Fosfat + Ornithine → Citrulline -
Enzim: Ornithine Transcarbamylase
4. Pembentukan Arginosuksinat di Sitosol
Di sitosol, citrulline bereaksi dengan aspartat untuk membentuk arginosuksinat. Aspartat bertindak sebagai donor nitrogen:
-
Reaksi:
Citrulline + Aspartat + ATP → Arginosuksinat + AMP + PPᵢ -
Enzim: Arginosuksinat Sintetase
-
Fungsi: Penyediaan dua gugus nitrogen yang diperlukan dalam siklus urea.
5. Pembentukan Arginine dan Fumarate (Sitosol)
Arginosuksinat kemudian dipecah untuk menghasilkan arginine dan fumarate. Fumarate yang terbentuk akan berkontribusi pada siklus Krebs:
-
Reaksi:
Arginosuksinat → Arginine + Fumarate -
Enzim: Arginosuksinat Liase
-
Fungsi: Fumarate, sebagai hasil samping, masuk ke siklus asam sitrat untuk menghasilkan energi.
6. Regenerasi Ornithine dan Pembentukan Urea
Pada akhirnya, arginine dipecah menjadi urea dan ornithine. Ornithine yang terbentuk kembali akan melanjutkan siklus ini:
-
Reaksi:
Arginine + H₂O → Urea + Ornithine -
Enzim: Arginase
-
Fungsi: Urea yang terbentuk akan dibuang melalui ginjal, sementara ornithine digunakan untuk memulai kembali siklus.
7. Hubungan dengan Metabolisme Asam Amino
-
Transaminasi: Amonia yang masuk ke siklus urea berasal dari deaminasi asam amino, dengan glutamat dan oksoglutarat memainkan peran utama dalam transfer nitrogen.
-
Siklus Krebs: Fumarate yang terbentuk selama siklus urea dapat memasuki siklus Krebs untuk menghasilkan energi lebih lanjut.
-
Pengaturan nitrogen: Siklus urea memastikan bahwa nitrogen yang berlebih dalam tubuh diproses dan dibuang dengan cara yang tidak berbahaya.
8. Kesimpulan:
Siklus urea merupakan mekanisme utama tubuh dalam mengeliminasi amonia, yang berfungsi sebagai detoksifikasi. Proses ini melibatkan beberapa enzim dan zat pembawa, yang bekerja sama dalam mitokondria dan sitosol untuk menghasilkan urea yang dapat dikeluarkan.
142 Syarah (Penjelasan) Slide ke-71
Pada gambar ini, yang menggambarkan siklus urea (urea cycle), terlihat serangkaian reaksi biokimia yang berlangsung di dalam mitokondria dan sitoplasma sel untuk memetabolisme produk sampingan nitrogen dalam tubuh, terutama yang dihasilkan dari asam amino. Berikut penjelasan mendetail mengenai proses yang terjadi pada gambar ini:
-
Penjelasan Umum Siklus Urea:
-
Siklus urea adalah jalur metabolik yang terjadi di hati dan berfungsi untuk mengubah amonia beracun (NH₃) menjadi urea, yang kemudian diekskresikan melalui urin. Proses ini sangat penting untuk menghilangkan nitrogen yang berlebihan dalam tubuh yang berasal dari pemecahan asam amino.
-
-
Karbamoyl Phosphate Synthetase I:
-
Pada tahap pertama, karbon dioksida (CO₂) dan amonia (NH₃) dikombinasikan dengan menggunakan energi dari 2 ATP untuk membentuk karbamoyl fosfat. Reaksi ini dikatalisis oleh karbamoyl fosfat synthetase I, yang terjadi di mitokondria.
-
Karbamoyl fosfat merupakan senyawa penting dalam sintesis urea dan bertindak sebagai donor kelompok karbamil pada langkah-langkah berikutnya dalam siklus urea.
-
-
Pembentukan Sitrulin:
-
Karbamoyl fosfat kemudian bereaksi dengan ornitina, menghasilkan sitrulin melalui reaksi yang dikatalisis oleh ornitine transcarbamoylase. Sitrulin adalah produk awal dari siklus urea yang melibatkan amonia.
-
-
Proses Lanjut Siklus Urea (Argininosuksinat Sintase):
-
Setelah terbentuknya sitrulin, sitrulin akan keluar dari mitokondria menuju sitoplasma untuk berikatan dengan aspartat (dengan bantuan energi dari ATP) membentuk argininosuksinat melalui aksi enzim argininosuksinat sintase.
-
Reaksi ini penting karena aspartat menyediakan nitrogen tambahan yang digunakan dalam sintesis argininosuksinat.
-
-
Pembentukan Arginin dan Fumarat:
-
Argininosuksinat kemudian diubah menjadi arginin dan fumarat melalui aksi enzim argininosuksinat liase. Fumarat yang dihasilkan selanjutnya dapat masuk ke dalam siklus asam sitrat untuk menghasilkan energi lebih lanjut, sementara arginin melanjutkan proses menuju pembentukan urea.
-
-
Pembentukan Urea:
-
Pada tahap terakhir, arginin dikatalisis oleh arginase untuk menghasilkan urea dan ornitina. Ornitina kembali memasuki mitokondria untuk mengulang siklus ini, sementara urea dibawa ke darah dan akhirnya diekskresikan oleh ginjal.
-
Proses ini mengeluarkan urea sebagai produk akhir, yang penting untuk pengaturan kadar nitrogen dalam tubuh.
-
-
Pentingnya Siklus Urea:
-
Siklus urea adalah mekanisme utama bagi tubuh untuk menangani akumulasi amonia yang dihasilkan dari deaminasi asam amino. Jika amonia dibiarkan menumpuk dalam tubuh, hal ini dapat menyebabkan keracunan, mengingat amonia adalah senyawa yang sangat toksik.
-
Oleh karena itu, siklus urea tidak hanya berfungsi untuk menghilangkan produk sampingan nitrogen, tetapi juga untuk menjaga homeostasis nitrogen dalam tubuh.
-
Secara keseluruhan, gambar ini memberikan gambaran yang jelas tentang bagaimana amonia yang dihasilkan dari metabolisme asam amino diproses melalui siklus urea untuk menghasilkan urea yang lebih tidak beracun dan siap diekskresikan. Proses ini sangat bergantung pada berbagai enzim, yang masing-masing memiliki peran khusus dalam memfasilitasi transformasi dan konversi senyawa-senyawa yang terlibat dalam siklus ini.
144 Syarah (Penjelasan) Slide ke-72
Pada gambar ini, terdapat penjelasan mengenai katabolisme rangka karbon asam amino (AA), yang merujuk pada jalur pemecahan asam amino untuk menghasilkan senyawa-senyawa intermediat yang penting dalam metabolisme sel. Proses ini memainkan peran penting dalam pengaturan energi dan penyediaan bahan baku bagi jalur metabolisme lain. Berikut adalah penjelasan mendetail terkait isi gambar ini:
Katabolisme Rangka Karbon Asam Amino:
-
Rangka Karbon Asam Amino:
-
Asam amino (AA) memiliki rangka karbon yang dapat diubah menjadi berbagai senyawa. Rangka karbon ini bersifat amfibolik, yang berarti bisa memasuki dua jalur metabolik utama, yaitu glikogenesis (sintesis glukosa) atau glikogenolisis (degradasi glukosa) dan sintesis senyawa energi lainnya.
-
Rangka karbon AA dapat diubah menjadi tujuh jenis senyawa utama yang sangat penting dalam metabolisme, yaitu:
-
Piruvat (terlibat dalam siklus asam sitrat)
-
Asetil-CoA (terlibat dalam siklus asam sitrat dan sintesis lemak)
-
Aetoasetil-CoA
-
α-Ketoglutarat (intermediat siklus asam sitrat)
-
Suksinil-CoA (intermediat dalam siklus asam sitrat)
-
Fumarat (intermediat siklus asam sitrat)
-
Oksaloasetat (intermediat siklus asam sitrat, juga digunakan untuk sintesis glukosa)
-
-
Senyawa-senyawa ini tidak hanya berperan dalam proses produksi energi tetapi juga dalam sintesis glukosa (gluconeogenesis), lemak, dan senyawa lain yang dibutuhkan oleh tubuh.
-
-
Asam Amino Glikogenik:
-
Asam amino glikogenik adalah asam amino yang dapat diubah menjadi glukosa melalui proses glukoneogenesis.
-
Asam amino yang termasuk dalam kategori glikogenik adalah:
-
Ala (Alanin), Arg (Arginin), Asp (Asparagin), Sis (Sistin), Glu (Glutamat), Gli (Glisin), His (Histidin), Met (Metionin), Pro (Prolin), Ser (Serin), Tre (Treonin), Val (Valin), dan Hidrosiprolin.
-
-
-
Asam Amino Ketogenik Murni:
-
Asam amino ketogenik murni adalah asam amino yang diubah menjadi asetil-CoA atau aetoasetil-CoA, yang keduanya merupakan prekursor untuk sintesis tubuh keton dan energi, tetapi tidak dapat digunakan untuk sintesis glukosa.
-
Leusin adalah contoh utama dari asam amino yang murni ketogenik.
-
-
Asam Amino Glikogenik dan Ketogenik:
-
Beberapa asam amino dapat berfungsi sebagai glikogenik dan ketogenik, tergantung pada jalur metabolik yang dipilih oleh tubuh. Asam amino ini bisa masuk ke jalur pembentukan glukosa maupun jalur ketogenik untuk pembentukan energi.
-
Asam amino yang termasuk dalam kategori ini adalah Ileu (Isoleusin), Lis (Lisin), Tir (Tirosin), Trip (Triptofan), dan Fenilalanin (Fenilalanin).
-
Modifikasi yang Perlu Diperhatikan:
-
Salah satu hal yang perlu dicatat adalah bahwa meskipun fenilalanin termasuk dalam kategori glikogenik dan ketogenik, proses konversinya menjadi fenilpiruvat juga berperan dalam metabolisme asam amino penting lainnya.
-
Perlu juga diingat bahwa dalam jalur konversi ini, beberapa asam amino memiliki efek ganda sebagai glikogenik dan ketogenik, dengan tujuan untuk mengoptimalkan regulasi energi tubuh sesuai kebutuhan.
Dengan demikian, gambar ini memberikan gambaran tentang diversitas jalur metabolik asam amino, yang mempengaruhi banyak aspek penting dalam tubuh manusia, mulai dari penyediaan energi, sintesis glukosa, hingga sintesis lemak dan senyawa penting lainnya.
146 Syarah (Penjelasan) Slide ke-73
Pada gambar ini, terdapat penjelasan tentang asam amino (AA) yang membentuk senyawa amfibolik, yang berperan dalam jalur metabolisme yang bisa berfungsi baik untuk penyediaan energi (glikogenik) maupun untuk sintesis senyawa lain (ketogenik). Berikut adalah penjelasan lebih lanjut mengenai tiap asam amino dan senyawa yang terbentuk:
AA Pembentuk Senyawa Amfibolik:
-
AA Pembentuk Oksaloasetat:
-
Asparat dan Asparagin adalah asam amino yang dapat diubah menjadi oksaloasetat. Oksaloasetat adalah senyawa intermediat dalam siklus asam sitrat (Krebs), yang berperan dalam metabolisme energi dan sintesis glukosa.
-
-
AA Pembentuk α-Ketoglutarat:
-
Glutamat, Glutamin, Prolin, Arginin, dan Histidin adalah asam amino yang diubah menjadi α-ketoglutarat. α-Ketoglutarat juga merupakan senyawa intermediat dalam siklus asam sitrat yang berperan dalam menghasilkan energi dan merupakan prekursor untuk sintesis asam amino lainnya.
-
-
AA Pembentuk Piruvat:
-
Alanin, Serin, Glin, Sistein, Treonin, dan Hidrosiprolin adalah asam amino yang diubah menjadi piruvat. Piruvat berfungsi sebagai prekursor dalam produksi energi melalui glikolisis dan juga berperan dalam sintesis glukosa (gluconeogenesis).
-
-
AA Pembentuk Asetil-CoA:
-
Fenilalanin, Tirosin, Lisin, Treonin, dan Leusin dapat diubah menjadi Asetil-CoA, yang memainkan peran penting dalam siklus asam sitrat untuk produksi energi dan dalam sintesis lemak.
-
-
AA Pembentuk Suksinil-CoA:
-
Metionin, Isoleusin, dan Valin diubah menjadi Suksinil-CoA, yang juga terlibat dalam siklus asam sitrat dan berfungsi dalam produksi energi serta sebagai prekursor untuk sintesis asam amino dan senyawa lainnya.
-
Pentingnya AA Amfibolik:
-
Amfibolik mengacu pada kemampuan suatu senyawa untuk terlibat dalam dua jalur metabolik utama: katabolisme (pemecahan untuk menghasilkan energi) dan anabolisme (sintesis senyawa baru). Dalam konteks asam amino ini, mereka dapat berfungsi untuk menghasilkan energi atau digunakan dalam sintesis senyawa penting lainnya, seperti glukosa, lemak, atau senyawa ketogenik.
-
Misalnya, asparagin dan asparat yang membentuk oksaloasetat dapat berfungsi dalam jalur pembentukan glukosa (gluconeogenesis) atau memasuki siklus asam sitrat untuk produksi energi.
-
Dengan demikian, asam amino ini sangat penting dalam menjaga keseimbangan energi dan metabolisme tubuh secara keseluruhan.
Pengetahuan ini mendasari pemahaman mengenai peran ganda asam amino dalam tubuh sebagai penyedia energi dan sebagai blok bangunan untuk senyawa biologis penting lainnya.
148 Syarah (Penjelasan) Slide ke-74
Pada gambar ini terdapat ringkasan (summary) dari proses metabolisme asam amino, yang melibatkan beberapa tahapan penting, yaitu transaminasi, deaminasi, dan siklus urea. Penjelasan setiap bagian dalam gambar adalah sebagai berikut:
Transaminasi:
-
Proses transaminasi adalah perpindahan gugus amino (NH₂) dari satu asam amino ke asam keto lain. Pada gambar ini, menunjukkan bahwa proses transaminasi melibatkan beberapa asam amino yang berbagi gugus amino untuk membentuk glutamat. Glutamat yang terbentuk ini akan berperan sebagai senyawa pengangkut nitrogen ke dalam jalur metabolisme lainnya, termasuk dalam siklus urea.
-
Enzim yang terlibat: Aminotransferase atau Transaminase, yang berperan penting dalam proses ini.
Deaminasi:
-
Deaminasi adalah proses penghilangan gugus amino dari asam amino, yang mengarah pada pembentukan amonia (NH₃) yang harus segera dibuang karena sifat toksiknya. Amonia ini kemudian masuk ke dalam siklus urea untuk diubah menjadi urea yang tidak beracun.
-
Gambar menunjukkan peran penting dari enzim glutamate dehydrogenase, yang berfungsi untuk mengubah glutamat menjadi α-ketoglutarat sambil menghasilkan amonia.
Siklus Urea:
-
Siklus urea terjadi di dalam hati, berfungsi untuk mengonversi amonia yang dihasilkan dari deaminasi menjadi urea yang lebih aman untuk dibuang melalui ginjal. Siklus ini melibatkan beberapa enzim seperti karbamoil fosfat sintetase, ornithine transcarbamoylase, arginosuksinat sintetase, dan arginosuksinat lyase, yang semuanya bekerja untuk mengikat amonia ke dalam struktur urea yang lebih stabil.
-
Pada gambar ini juga terlihat amonia yang diubah menjadi karbamoil fosfat, yang kemudian berlanjut menjadi sitrulin dan akhirnya membentuk urea.
Aminotransferase dan peranannya dalam transaminasi:
-
Enzim aminotransferase (atau transaminase) memainkan peran kunci dalam proses transaminasi. Pada gambar, struktur tiga dimensi enzim ini ditunjukkan, menggambarkan betapa pentingnya peranannya dalam pergerakan gugus amino.
Summary:
-
Deaminasi menghasilkan amonia, yang kemudian dikendalikan dalam siklus urea untuk dibuang sebagai urea.
-
Transaminasi menyediakan gugus amino untuk membentuk senyawa-senyawa penting lainnya, sementara siklus urea memastikan bahwa amonia yang berbahaya dapat dikonversi menjadi senyawa yang aman.
-
Gambar ini menggambarkan alur proses metabolisme nitrogen yang dimulai dari transaminasi, dilanjutkan dengan deaminasi, dan diakhiri dengan proses dalam siklus urea untuk menghilangkan amonia dari tubuh.
Anotasi yang perlu dipertimbangkan:
Pada gambar ini, ada penekanan pada pentingnya interaksi antara glutamat, asparat, dan asam amino lainnya dalam mengatur siklus nitrogen dan pembentukan senyawa amonia yang aman.
150 Syarah (Penjelasan) Slide ke-75
1. Pengantar
Materi ini membahas asam amino dan protein sebagai molekul fundamental dalam biokimia yang berperan sebagai penyusun utama struktur dan fungsi sel. Setiap protein tersusun atas rantai polipeptida dari asam amino yang saling berikatan melalui ikatan peptida, dan memiliki tingkatan struktur mulai dari primer hingga kuartener.
2. Ciri dan Struktur Asam Amino
Asam amino memiliki atom karbon α (asimetrik) yang terikat pada empat gugus:
-
Gugus amino (–NH₂)
-
Gugus karboksil (–COOH)
-
Atom hidrogen (–H)
-
Gugus samping (R) yang membedakan jenis asam amino
Semua asam amino bersifat optik aktif kecuali glisin, karena glisin tidak memiliki atom karbon asimetrik.
3. Klasifikasi Asam Amino
Klasifikasi dilakukan berdasarkan gugus R dan sifat kimiawi:
-
Nonpolar (hidrofobik): Alanin, Valin, Leusin, Isoleusin
-
Polar tanpa muatan: Serin, Treonin, Asparagin, Glutamin
-
Bermuatan negatif (asam): Aspartat, Glutamat
-
Bermuatan positif (basa): Lisin, Arginin, Histidin
4. Reaksi Kimia Spesifik Asam Amino
Asam amino dapat mengalami reaksi kimia sesuai gugus fungsionalnya:
-
Gugus amino → reaksi asetilasi
-
Gugus karboksil → reaksi esterifikasi
Metode deteksi umum:
-
Reaksi ninhidrin: menghasilkan warna ungu khas untuk identifikasi asam amino.
-
Reaksi FDNB (1-fluoro-2,4-dinitrobenzene): digunakan untuk penentuan ujung N-terminal.
5. Asam Amino Esensial dan Non-Esensial
Asam amino esensial adalah yang tidak dapat disintesis tubuh, meliputi:
FAT HILL MET VALIN → Fenilalanin, Arginin, Treonin, Histidin, Isoleusin, Lisin, Leusin, Metionin, Valin.
Sedangkan non-esensial dapat dibentuk dari senyawa perantara metabolik seperti piruvat, oksaloasetat, dan glutamat.
6. Peptida dan Protein
-
Peptida: rantai pendek 2–100 asam amino.
-
Polipeptida: rantai panjang >100 asam amino.
-
Protein: satu atau lebih rantai polipeptida yang berlipat membentuk struktur 3D tertentu.
7. Struktur Protein
-
Primer: urutan linier asam amino yang dihubungkan ikatan peptida.
-
Sekunder: pola lokal seperti α-heliks dan β-sheet, distabilkan oleh ikatan hidrogen.
-
Tersier: lipatan tiga dimensi keseluruhan rantai, dipertahankan oleh interaksi hidrofobik, ionik, dan disulfida.
-
Kuartener: asosiasi beberapa rantai polipeptida (contoh: hemoglobin).
8. Denaturasi Protein
Denaturasi adalah perubahan struktur tiga dimensi protein tanpa pemutusan ikatan peptida, biasanya disebabkan oleh panas, perubahan pH, bahan kimia, atau gaya mekanik. Akibatnya, protein kehilangan aktivitas biologisnya.
9. Klasifikasi Protein Berdasarkan Fungsi
-
Enzimatik: katalis biologis (contoh: tripsin, ribonuklease)
-
Nutrien dan penyimpan: ovalbumin, ferritin
-
Transport: hemoglobin, mioglobin
-
Kontraktik: aktin, miosin
-
Struktural: kolagen, keratin, elastin
-
Pertahanan: antibodi
-
Pengatur: hormon protein (insulin)
-
Genetik: histon, nukleoprotein
10. Klasifikasi Protein Berdasarkan Bentuk
-
Protein serabut (fibrous): struktur panjang, tidak larut air, bersifat pelindung (contoh: kolagen, keratin).
-
Protein globular: bentuk bola, larut air, mudah terdenaturasi (contoh: enzim, antibodi).
11. Klasifikasi Berdasarkan Kelarutan
| Jenis | Sifat Kelarutan | Contoh |
|---|---|---|
| Albumin | Larut air, terkoagulasi panas | Serum albumin |
| Globulin | Larut garam encer | Globulin |
| Glutelin | Larut asam/basa encer | Glutelin (gandum) |
| Prolamin | Larut alkohol 70–80% | Gliadin |
| Histon | Larut air, tidak larut amonia | Histon |
| Protamin | Larut air, tidak koagulasi panas | Protamin ikan |
12. Molekul Hibrid
-
Glikoprotein: 1–30% karbohidrat, misal protein plasma darah.
-
Proteoglikan: 95% karbohidrat (disakarida berulang) – penyusun jaringan ikat.
-
Peptidoglikan: gabungan peptida dan polisakarida – penyusun dinding sel bakteri.
13. Metabolisme Asam Amino
Terdiri dari dua fase besar: biosintesis dan katabolisme.
a. Biosintesis Asam Amino
-
Asam amino non-esensial disintesis dari perantara glikolisis dan siklus Krebs.
-
Contoh: prolin dari glutamat; tirosin dari fenilalanin melalui enzim fenilalanin hidroksilase (membutuhkan tetrahidrobiopterin dan NADPH).
b. Katabolisme Asam Amino
Terdiri dari penguraian gugus amino dan kerangka karbon:
-
Transaminasi: pemindahan gugus amino ke asam α-keto lain (tanpa kehilangan N total).
-
Enzim utama: ALT (alanine transaminase) dan AST (aspartate transaminase).
-
-
Deaminasi oksidatif: menghasilkan amonia dan α-ketoasam.
-
Trans-deaminasi: kombinasi transaminasi dan deaminasi untuk pembuangan nitrogen.
-
Siklus urea: konversi NH₃ dan CO₂ menjadi urea di hati (khusus mamalia).
14. Katabolisme Kerangka Karbon
Kerangka karbon hasil deaminasi dapat dimasukkan ke jalur metabolik utama:
-
Piruvat: dari alanin, serin, glisin
-
Asetil-KoA: dari leusin, lisin, fenilalanin
-
Suksinil-KoA: dari metionin, isoleusin, valin
-
Oksaloasetat: dari aspartat, asparagin
-
α-Ketoglutarat: dari glutamat, prolin, arginin
Asam amino diklasifikasikan menjadi:
-
Glikogenik: menghasilkan prekursor glukosa
-
Ketogenik: menghasilkan badan keton
-
Campuran: menghasilkan keduanya (misal: isoleusin, tirosin, triptofan)
15. Ekskresi Nitrogen
-
Ureotelik (mammalia): ekskresi urea.
-
Urikotelik (reptil & aves): ekskresi asam urat.
-
Ammonotelik (ikan): ekskresi amonia langsung.
16. Kesimpulan
Asam amino merupakan unit dasar pembentuk protein yang menjalankan beragam fungsi biologis penting. Proses biosintesis dan degradasinya memastikan keseimbangan nitrogen dan energi dalam tubuh. Struktur protein yang kompleks menentukan fungsinya, dan perubahan pada struktur tersebut (misalnya denaturasi) dapat mengubah sifat biologisnya secara drastis.