© Tim Dosen Biokimia (Biologi, FMIPA, Universitas Negeri Surabaya)
2 Syarah (Penjelasan) Slide ke-1 (Cover)
Statement:
A protein with catalytic properties due to its power of specific activation.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
A protein → suatu protein
-
with catalytic properties → dengan sifat-sifat katalitik
-
due to → karena
-
its power of specific activation → kemampuannya dalam melakukan aktivasi secara spesifik
Syarah (Penjelasan Komprehensif):
Pernyataan ini menjelaskan bahwa enzim adalah protein yang memiliki kemampuan katalitik, yaitu kemampuan untuk mempercepat reaksi kimia tanpa ikut habis bereaksi. Sifat katalitik tersebut muncul karena struktur tiga dimensi enzim membentuk situs aktif (active site) yang secara khusus dapat berinteraksi dengan substrat tertentu. Kalimat “power of specific activation” merujuk pada kemampuan enzim untuk mengaktifkan reaksi secara selektif terhadap satu jenis substrat atau sekelompok substrat yang mirip, sesuai dengan prinsip spesifisitas enzimatik. Dengan kata lain, setiap enzim hanya bekerja pada substrat tertentu karena kecocokan bentuk antara situs aktif enzim dan substratnya, seperti kunci dan gembok (lock and key model) atau seperti sarung tangan dan tangan (induced fit model).
Selain mempercepat laju reaksi, enzim juga menurunkan energi aktivasi yang dibutuhkan suatu reaksi agar dapat berlangsung. Tanpa enzim, banyak reaksi biokimia dalam sel akan terlalu lambat untuk menopang kehidupan. Oleh sebab itu, enzim sering disebut sebagai “biological catalyst” atau “biokatalis,” karena fungsinya serupa dengan katalis dalam kimia, namun bekerja dalam kondisi biologis yang sangat spesifik (pH, suhu, ion, dan lingkungan seluler).
Anotasi [Pembaruan 2025]:
Meskipun sebagian besar enzim merupakan protein, tidak semua katalis biologis terbuat dari protein. Beberapa molekul RNA juga memiliki aktivitas katalitik dan disebut ribozyme. Contohnya adalah peptidyl transferase RNA dalam ribosom dan RNase P. Oleh karena itu, definisi yang lebih mutakhir menyebut bahwa enzim adalah biomolekul (biasanya protein, tetapi juga dapat berupa RNA) yang bertindak sebagai katalis biologis untuk mempercepat reaksi kimia dalam organisme hidup.
Ringkasan:
Enzim adalah protein yang berfungsi sebagai katalis biologis karena kemampuannya mengaktifkan reaksi secara spesifik terhadap substrat tertentu. Sifat ini memungkinkan reaksi biokimia berlangsung cepat dan efisien pada kondisi fisiologis. Namun, berdasarkan temuan modern, beberapa enzim juga dapat berupa RNA dengan aktivitas katalitik (ribozyme).
4 Syarah (Penjelasan) Slide ke-2
Statement 1:
Chemical reactions need an initial input of energy = THE ACTIVATION ENERGY
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Chemical reactions → reaksi kimia
-
need → membutuhkan
-
an initial input of energy → masukan awal berupa energi
-
= THE ACTIVATION ENERGY → disebut sebagai energi aktivasi
Syarah:
Setiap reaksi kimia, baik yang terjadi di alam maupun dalam sel hidup, memerlukan sejumlah energi awal untuk dapat dimulai. Energi ini disebut energi aktivasi (activation energy), yaitu energi minimum yang diperlukan agar molekul reaktan dapat mencapai kondisi di mana ikatan-ikatan kimia mereka mulai melemah dan dapat diubah menjadi produk baru. Tanpa energi aktivasi, partikel-partikel penyusun reaktan tidak akan memiliki cukup energi untuk bertumbukan dengan orientasi yang tepat guna membentuk produk. Dalam sistem biologis, energi aktivasi biasanya diperoleh dari panas lingkungan, energi cahaya, atau energi kimia yang disuplai oleh molekul seperti ATP. Namun dalam sistem sel, peningkatan suhu bukanlah pilihan efisien karena dapat merusak struktur protein dan membran. Oleh karena itu, organisme menggunakan enzim untuk menurunkan energi aktivasi ini, sehingga reaksi dapat berlangsung cepat pada suhu tubuh yang relatif rendah (sekitar 37°C pada manusia).
Statement 2:
During this part of the reaction the molecules are said to be in a transition state.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
During this part of the reaction → selama tahap ini dari reaksi
-
the molecules are said to be → molekul dikatakan berada
-
in a transition state → dalam keadaan transisi
Syarah:
Pada tahap ketika energi aktivasi telah tercapai, molekul reaktan tidak langsung berubah menjadi produk. Sebaliknya, mereka berada dalam kondisi sementara yang disebut keadaan transisi (transition state). Dalam keadaan ini, ikatan-ikatan lama mulai melemah sementara ikatan-ikatan baru mulai terbentuk, sehingga struktur molekul berada pada titik energi tertinggi dan paling tidak stabil. Kondisi transisi ini berlangsung sangat singkat — hanya dalam orde waktu femtosekon hingga pikosekon. Enzim bekerja dengan menstabilkan keadaan transisi, yakni dengan menyediakan lingkungan kimiawi yang sesuai agar energi yang dibutuhkan untuk mencapai puncak ini berkurang secara signifikan. Inilah salah satu prinsip mendasar dari katalisis enzimatik.
Anotasi [Pembaruan 2025]:
Dalam konteks biofisika modern, energi aktivasi tidak hanya dianggap sebagai “penghalang energi,” tetapi juga sebagai bagian dari landskap energi potensial (energy landscape) yang menggambarkan berbagai konformasi molekul selama reaksi. Model terbaru menggunakan pendekatan komputasi kuantum dan dinamika molekuler untuk memetakan keadaan transisi ini secara lebih akurat. Selain itu, istilah “transition state analog” kini digunakan untuk menyebut molekul sintetis yang menyerupai keadaan transisi dan berfungsi sebagai inhibitor enzim yang sangat kuat, karena enzim memiliki afinitas sangat tinggi terhadap bentuk transisi dari substratnya.
Ringkasan:
Reaksi kimia membutuhkan energi awal yang disebut energi aktivasi agar molekul reaktan dapat mencapai keadaan transisi, yaitu kondisi energi tertinggi di mana ikatan lama mulai terputus dan ikatan baru mulai terbentuk. Enzim berperan penting dalam menurunkan energi aktivasi dengan menstabilkan keadaan transisi, sehingga reaksi dapat berlangsung cepat pada suhu fisiologis tanpa merusak sistem biologis.
6 Syarah (Penjelasan) Slide ke-3
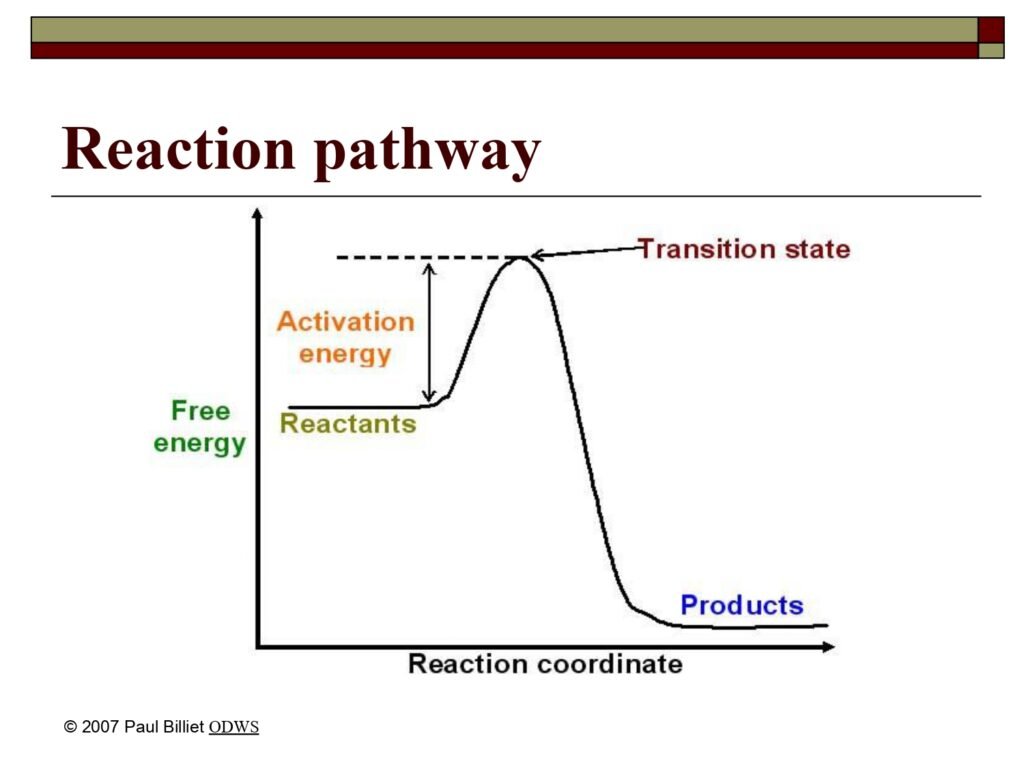
Diagram yang menggambarkan hubungan antara Free Energy (Energi Bebas) dan Reaction Coordinate (Koordinat Reaksi), dengan tiga tahapan utama:
-
Reactants (Reaktan) — posisi awal molekul sebelum reaksi.
-
Transition State (Keadaan Transisi) — puncak energi tertinggi dari reaksi.
-
Products (Produk) — hasil akhir dengan energi lebih rendah.
Garis vertikal menunjukkan Activation Energy (Energi Aktivasi), yaitu selisih energi antara reaktan dan keadaan transisi.
Terjemah Istilah dalam Diagram:
-
Free Energy → energi bebas (energi potensial yang dapat digunakan untuk melakukan kerja dalam sistem kimia)
-
Reaction Coordinate → lintasan atau tahapan perubahan molekul selama reaksi berlangsung
-
Reactants → reaktan, zat awal yang mengalami reaksi
-
Activation Energy → energi aktivasi, energi minimum yang dibutuhkan agar reaksi dapat berlangsung
-
Transition State → keadaan transisi, kondisi tak stabil dengan energi maksimum
-
Products → produk, hasil akhir dari reaksi kimia setelah energi dilepaskan
Syarah (Penjelasan Komprehensif):
Diagram ini menggambarkan jalur energi reaksi kimia (reaction energy pathway) yang memperlihatkan bagaimana energi bebas sistem berubah sepanjang proses reaksi dari reaktan menuju produk. Pada awalnya, molekul berada pada tingkat energi bebas tertentu (ditunjukkan sebagai Reactants). Untuk memulai reaksi, molekul harus terlebih dahulu menyerap energi hingga mencapai tingkat energi aktivasi, yang ditunjukkan oleh puncak tertinggi pada grafik — dikenal sebagai transition state. Pada titik ini, ikatan lama mulai melemah dan ikatan baru mulai terbentuk.
Setelah melewati keadaan transisi, molekul akan melepaskan energi menuju keadaan yang lebih stabil, membentuk produk (Products). Energi bebas produk biasanya lebih rendah dibandingkan reaktan, menandakan bahwa reaksi ini bersifat eksotermik (melepaskan energi). Namun, beberapa reaksi lain bisa bersifat endotermik jika produk justru memiliki energi bebas yang lebih tinggi, artinya sistem menyerap energi dari lingkungan.
Enzim berperan penting dalam menurunkan tinggi “bukit energi” ini — yaitu menurunkan energi aktivasi (activation energy) tanpa mengubah energi total reaktan atau produk. Dengan demikian, enzim mempercepat pencapaian keadaan transisi sehingga reaksi biologis yang semula lambat dapat berlangsung dalam waktu yang cukup cepat untuk menopang kehidupan.
Anotasi [Pembaruan 2025]:
Model klasik pada slide ini menggambarkan jalur reaksi secara satu dimensi, namun pendekatan biokimia modern kini menggunakan konsep multidimensional energy landscape, di mana jalur reaksi tidak tunggal, melainkan melalui banyak kemungkinan mikro-konformasi. Dalam biokatalisis modern, mekanisme enzimatik sering dijelaskan melalui model induced fit dan transition state stabilization, di mana situs aktif enzim menyesuaikan bentuknya untuk menstabilkan keadaan transisi — bukan hanya sekadar “menurunkan energi aktivasi” secara pasif.
Selain itu, istilah ΔG (delta G) kini digunakan untuk mengukur perubahan energi bebas Gibbs antara reaktan dan produk. Jika ΔG < 0, reaksi bersifat spontan (eksotermik), sedangkan jika ΔG > 0, reaksi membutuhkan input energi (endotermik).
Ringkasan:
Diagram “Reaction Pathway” menunjukkan bahwa agar reaksi kimia terjadi, reaktan harus mencapai keadaan transisi dengan energi aktivasi tertentu. Setelah melewati titik ini, energi dilepaskan dan produk terbentuk pada tingkat energi lebih rendah. Enzim mempercepat proses ini dengan menurunkan energi aktivasi dan menstabilkan keadaan transisi, tanpa mengubah total energi reaksi (ΔG).
8 Syarah (Penjelasan) Slide ke-4
Statement 1:
Increasing the temperature make molecules move faster
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Increasing the temperature → meningkatkan suhu
-
make molecules move faster → membuat molekul bergerak lebih cepat
Syarah:
Secara umum, kenaikan suhu akan meningkatkan energi kinetik partikel. Molekul-molekul yang lebih cepat bergerak akan bertumbukan lebih sering dan dengan energi yang lebih tinggi, sehingga peluang terjadinya reaksi kimia meningkat. Prinsip ini dikenal sebagai teori tumbukan (collision theory), di mana laju reaksi bergantung pada frekuensi dan energi tumbukan antarpartikel. Dalam konteks biokimia, meskipun peningkatan suhu mempercepat reaksi, ada batasan penting: sistem biologis tidak dapat mentoleransi perubahan suhu yang terlalu besar, karena protein—termasuk enzim—dapat mengalami denaturasi pada suhu tinggi, kehilangan struktur tiga dimensinya, dan akhirnya kehilangan aktivitas biologis.
Statement 2:
Biological systems are very sensitive to temperature changes.
Terjemah:
-
Biological systems → sistem biologis
-
are very sensitive → sangat sensitif
-
to temperature changes → terhadap perubahan suhu
Syarah:
Sistem biologis, terutama sel-sel hidup, sangat bergantung pada kestabilan suhu. Enzim, yang merupakan katalis utama dalam reaksi metabolik, bekerja optimal hanya pada rentang suhu sempit — umumnya sekitar 37°C untuk manusia. Kenaikan suhu sedikit di atas batas ini dapat menyebabkan denaturasi enzim, sedangkan penurunan suhu ekstrem memperlambat gerakan molekul dan menurunkan laju reaksi. Oleh karena itu, tubuh makhluk hidup memiliki mekanisme homeostasis untuk mempertahankan suhu internal yang stabil demi menjamin aktivitas enzim tetap efisien.
Statement 3:
Enzymes can increase the rate of reactions without increasing the temperature.
Terjemah:
-
Enzymes → enzim
-
can increase the rate of reactions → dapat meningkatkan laju reaksi
-
without increasing the temperature → tanpa meningkatkan suhu
Syarah:
Inilah inti dari fungsi enzim sebagai biokatalis. Enzim mampu mempercepat reaksi kimia tanpa perlu menaikkan suhu. Mereka bekerja dengan menurunkan energi aktivasi yang diperlukan oleh reaksi tersebut, sehingga reaktan dapat mencapai keadaan transisi dengan energi yang lebih rendah. Dengan demikian, reaksi yang secara alami akan berjalan lambat pada suhu tubuh dapat berlangsung cepat tanpa mengganggu kestabilan fisiologis sel.
Statement 4:
They do this by lowering the activation energy.
Terjemah:
-
They do this → mereka (enzim) melakukan ini
-
by lowering the activation energy → dengan menurunkan energi aktivasi
Syarah:
Penurunan energi aktivasi dilakukan melalui interaksi spesifik antara enzim dan substrat pada situs aktifnya. Enzim menstabilkan keadaan transisi melalui pembentukan kompleks enzim–substrat, yang menurunkan kebutuhan energi untuk memutus dan membentuk ikatan kimia baru. Hal ini membuat lintasan energi reaksi menjadi lebih efisien, memungkinkan reaksi mencapai kesetimbangan lebih cepat tanpa perlu input energi eksternal tambahan.
Statement 5:
They create a new reaction pathway “a short cut”
Terjemah:
-
They create → mereka (enzim) menciptakan
-
a new reaction pathway → jalur reaksi baru
-
“a short cut” → jalan pintas
Syarah:
Ungkapan ini menjelaskan secara metaforis bahwa enzim menyediakan jalur alternatif (alternative pathway) bagi reaksi kimia yang memiliki hambatan energi lebih rendah dibandingkan jalur reaksi normal tanpa enzim. Jalur baru ini bukan berarti mengubah produk akhir atau arah reaksi, tetapi hanya memperpendek “rute” energi yang harus dilalui oleh reaktan untuk mencapai produk. Dengan kata lain, enzim bertindak sebagai “jalan pintas” molekuler yang efisien dan terkontrol secara spesifik.
Anotasi [Pembaruan 2025]:
Pemahaman modern menekankan bahwa enzim tidak sekadar menurunkan energi aktivasi secara pasif, tetapi juga secara aktif menstabilkan konformasi transisi melalui gaya-gaya kimia tertentu: ikatan hidrogen, gaya elektrostatik, hidrofobik, dan perubahan konformasi (model induced fit). Selain itu, beberapa enzim bekerja dengan mekanisme multi-step catalysis, misalnya melalui pembentukan kompleks kovalen sementara, transfer proton, atau penataan ulang muatan elektron.
Ringkasan:
Reaksi kimia dapat dipercepat dengan menaikkan suhu, tetapi dalam sistem biologis hal ini berisiko karena enzim mudah rusak. Enzim mengatasi hal ini dengan menurunkan energi aktivasi dan menyediakan jalur reaksi alternatif (“short cut”) yang membuat reaksi berlangsung cepat pada suhu fisiologis tanpa mengubah total energi reaksi.
10 Syarah (Penjelasan) Slide ke-5
Statement:
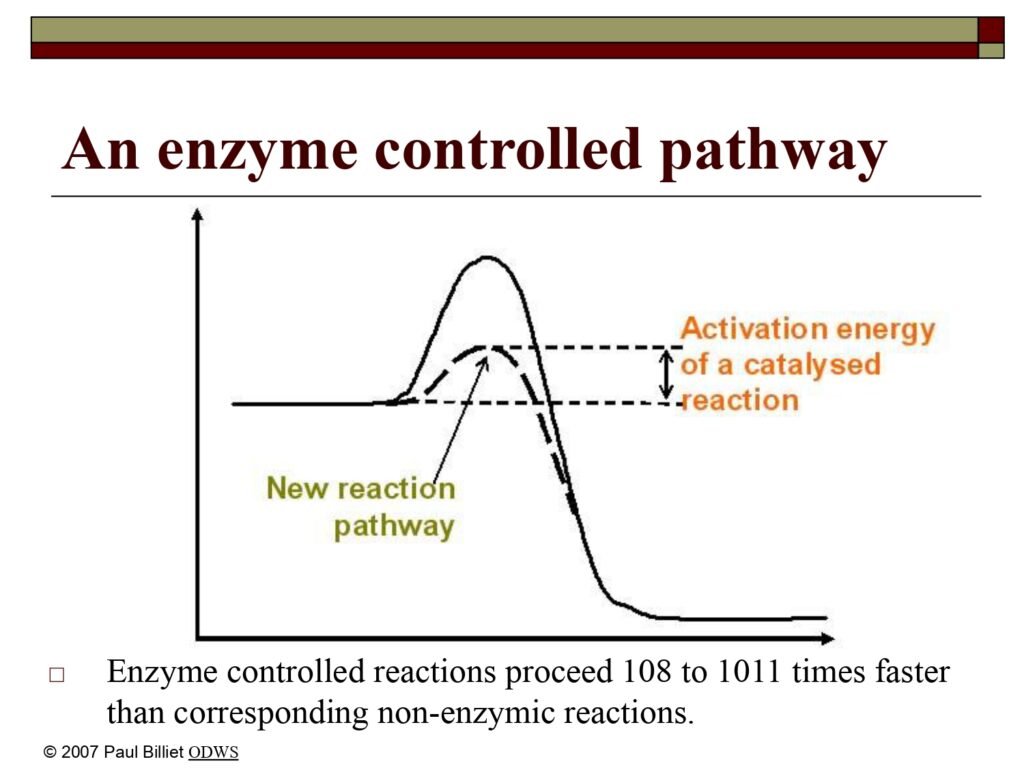
Enzyme controlled reactions proceed 10⁸ to 10¹¹ times faster than corresponding non-enzymic reactions.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Enzyme controlled reactions → reaksi yang dikendalikan oleh enzim
-
proceed → berlangsung / berjalan
-
10⁸ to 10¹¹ times faster → 100 juta hingga 100 milyar kali lebih cepat
-
than corresponding non-enzymic reactions → dibandingkan reaksi sejenis yang tidak dikatalisis oleh enzim
Syarah (Penjelasan Komprehensif):
Slide ini memperlihatkan perbandingan antara jalur reaksi tanpa enzim dan jalur reaksi yang dikatalisis oleh enzim menggunakan grafik energi bebas terhadap koordinat reaksi. Garis bergelombang tinggi menggambarkan jalur reaksi alami tanpa enzim, sedangkan garis yang lebih rendah menunjukkan jalur reaksi yang dipercepat oleh enzim. Pada jalur yang dikendalikan enzim, energi aktivasi (activation energy) berkurang drastis, sehingga reaksi dapat berlangsung jauh lebih cepat — bahkan hingga 10⁸–10¹¹ kali lipat lebih cepat dibanding reaksi yang sama tanpa enzim.
Percepatan ini terjadi karena enzim menciptakan “new reaction pathway” atau jalur reaksi baru yang lebih efisien, seperti disebut pada slide sebelumnya. Jalur ini bekerja dengan menstabilkan keadaan transisi (transition state stabilization) dan mengurangi energi yang dibutuhkan untuk mencapai puncak energi aktivasi. Mekanisme ini tidak mengubah energi total antara reaktan dan produk (ΔG tetap sama), melainkan hanya memperpendek waktu yang dibutuhkan untuk mencapai kesetimbangan.
Dalam sistem biologis, percepatan reaksi sebesar ini sangat penting. Misalnya, tanpa enzim, reaksi hidrasi karbondioksida dalam tubuh manusia akan berlangsung sangat lambat—hanya beberapa molekul per detik. Namun dengan bantuan enzim karbonik anhidrase, reaksi yang sama dapat terjadi hingga 10⁶ kali per detik pada satu molekul enzim! Artinya, tanpa enzim, metabolisme sel tidak akan mampu menopang kehidupan karena laju reaksi biokimia terlalu lambat untuk menyediakan energi atau produk metabolik tepat waktu.
Anotasi [Pembaruan 2025]:
Definisi modern menambahkan bahwa efektivitas enzim diukur menggunakan katalitik efisiensi (catalytic efficiency), yaitu perbandingan antara kcat/Km.
-
kcat (turnover number) menunjukkan jumlah molekul substrat yang dapat dikonversi menjadi produk oleh satu molekul enzim per detik.
-
Km (Michaelis constant) menunjukkan konsentrasi substrat yang dibutuhkan untuk mencapai setengah laju maksimum reaksi.
Nilai kcat/Km yang mendekati 10⁸–10⁹ M⁻¹ s⁻¹ dianggap sebagai batas difusi, yakni kecepatan maksimum yang mungkin terjadi karena keterbatasan tumbukan molekul di dalam cairan. Enzim seperti superoksida dismutase, karboksipeptidase, dan asetilkolinesterase termasuk dalam kategori ini—mereka bereaksi secepat mungkin sesuai hukum fisika.
Selain itu, kemajuan riset biofisika menunjukkan bahwa beberapa enzim bekerja bukan hanya melalui “penurunan energi aktivasi,” tetapi juga melibatkan dinamika protein (protein dynamics) dan transfer kuantum proton atau elektron, menjelaskan mengapa percepatan hingga 10¹¹ kali lipat bisa terjadi dalam sistem biologis kompleks.
Ringkasan:
Enzim mempercepat reaksi kimia hingga 100 juta hingga 100 milyar kali lebih cepat dibandingkan reaksi tanpa enzim. Hal ini dicapai dengan menciptakan jalur reaksi alternatif yang menurunkan energi aktivasi dan menstabilkan keadaan transisi tanpa mengubah energi total reaksi (ΔG). Dalam biologi, percepatan luar biasa ini memungkinkan metabolisme sel berlangsung efisien pada suhu tubuh normal.
12 Syarah (Penjelasan) Slide ke-6
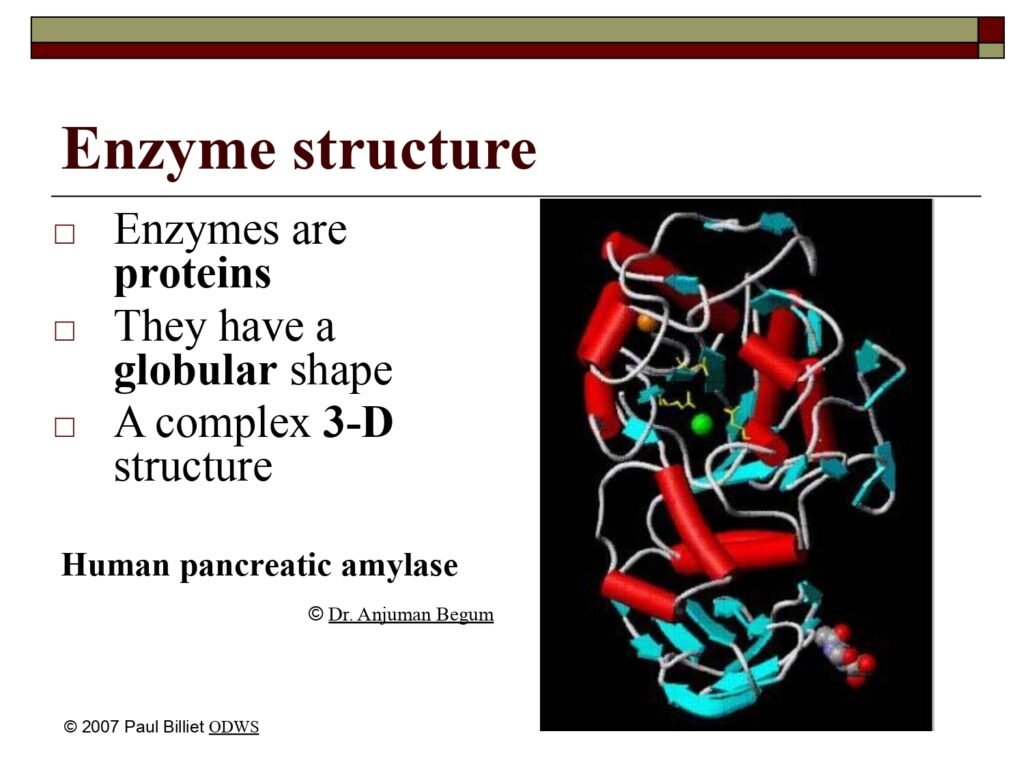
Statement 1:
Enzymes are proteins
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Enzymes → enzim
-
are → merupakan / adalah
-
proteins → protein
Syarah:
Enzim sebagian besar tersusun dari molekul protein, yaitu polimer asam amino yang dilipat membentuk struktur tiga dimensi tertentu. Sebagai protein, enzim memiliki urutan asam amino (struktur primer) yang menentukan cara lipatannya menjadi struktur sekunder (heliks α dan lembaran β), tersusun lebih lanjut menjadi struktur tersier yang membentuk situs aktif, dan kadang membentuk struktur kuarterner jika tersusun dari beberapa subunit protein. Sifat katalitik enzim sepenuhnya bergantung pada konformasi spasial (bentuk tiga dimensi) dari protein tersebut. Bila bentuk ini terganggu—misalnya akibat panas, pH ekstrem, atau bahan kimia—enzim dapat mengalami denaturasi, kehilangan struktur dan fungsinya.
Statement 2:
They have a globular shape
Terjemah:
-
They have → mereka (enzim) memiliki
-
a globular shape → bentuk globular (bulat/tergulung padat)
Syarah:
Enzim tergolong protein globular, bukan protein serat (fibrous protein) seperti kolagen atau keratin. Protein globular memiliki bentuk bola tidak beraturan yang terlipat rapat karena interaksi antar gugus fungsional asam amino—seperti ikatan hidrogen, disulfida, dan gaya hidrofobik. Bentuk globular memungkinkan sebagian residu asam amino berada di permukaan untuk berinteraksi dengan air (hidrofilik), sedangkan sebagian lain tersembunyi di dalam (hidrofobik), menciptakan lingkungan mikro yang ideal bagi aktivitas katalitik. Struktur globular inilah yang memungkinkan terbentuknya active site (situs aktif) — daerah khusus tempat substrat berikatan dan reaksi berlangsung.
Statement 3:
A complex 3-D structure
Terjemah:
-
A complex → suatu bentuk yang kompleks
-
3-D structure → struktur tiga dimensi
Syarah:
Struktur tiga dimensi enzim menentukan fungsi spesifiknya. Setiap enzim memiliki konformasi unik yang dirancang untuk mengikat substrat tertentu melalui kecocokan spasial dan kimiawi. Model klasik seperti Lock and Key menggambarkan kecocokan sempurna antara enzim dan substrat, sedangkan model modern Induced Fit menjelaskan bahwa enzim dapat sedikit berubah bentuk untuk menyesuaikan diri dengan substrat ketika terjadi pengikatan. Dalam konteks struktural, interaksi antara rantai samping asam amino (misalnya residu serin, histidin, atau aspartat) sering membentuk katalitik triad, yaitu susunan residu aktif yang bertanggung jawab atas mekanisme reaksi kimia.
Gambar pada Slide:
Menampilkan model pita tiga dimensi dari Human Pancreatic Amylase, yaitu enzim pencernaan yang berfungsi memecah pati menjadi maltosa dan glukosa. Warna merah mewakili α-heliks, biru/toska menunjukkan β-sheet, dan garis putih menandakan loop atau random coil. Model ini memperlihatkan bagaimana elemen struktural tersebut saling berinteraksi untuk membentuk situs aktif di bagian tengah molekul, tempat terjadinya ikatan substrat (pati) dengan enzim.
Anotasi [Pembaruan 2025]:
Penelitian terkini dalam struktur enzimatik menggunakan metode cryo-electron microscopy (cryo-EM) dan X-ray crystallography beresolusi tinggi, memungkinkan pemetaan atomik enzim hingga skala Angstrom. Selain itu, integrasi AI protein prediction tools seperti AlphaFold2 dan ESMFold kini dapat memprediksi struktur 3D enzim dari urutan asam amino secara akurat, membuka jalan bagi desain enzim buatan (enzyme engineering).
Secara biologis, sebagian enzim juga membutuhkan komponen non-protein untuk berfungsi, seperti koenzim (mis. NAD⁺, FAD) atau ion logam kofaktor (mis. Zn²⁺, Mg²⁺, Fe²⁺). Oleh karena itu, meskipun enzim tergolong protein, aktivitas katalitiknya sering kali merupakan hasil sinergi antara bagian protein (apoenzim) dan non-protein (kofaktor), membentuk holoenzim yang aktif secara penuh.
Ringkasan:
Enzim adalah protein globular dengan struktur tiga dimensi kompleks yang memungkinkan pembentukan situs aktif untuk mengikat substrat dan melakukan katalisis. Struktur ini menentukan spesifisitas dan aktivitas enzim. Dalam praktik modern, pemahaman tentang struktur 3D enzim menjadi kunci dalam bioinformatika struktural dan rekayasa protein untuk desain enzim baru yang lebih efisien.
14 Syarah (Penjelasan) Slide ke-7
Statement 1:
One part of an enzyme, the active site, is particularly important.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
One part of an enzyme → satu bagian dari enzim
-
the active site → situs aktif
-
is particularly important → sangat penting / memiliki peranan khusus
Syarah:
Situs aktif (active site) adalah bagian spesifik pada enzim yang berperan langsung dalam pengikatan substrat dan pelaksanaan reaksi katalitik. Walaupun ukuran situs aktif hanya sekitar 5–10% dari total volume enzim, bagian inilah yang menentukan spesifisitas dan efisiensi enzim. Situs aktif terbentuk dari lipatan tiga dimensi protein enzim yang menghasilkan cekungan (groove) atau kantung (pocket) di mana substrat dapat menempel. Posisi dan orientasi residu asam amino di situs ini memungkinkan terjadinya interaksi kimia seperti ikatan hidrogen, gaya elektrostatik, gaya van der Waals, dan interaksi hidrofobik yang memastikan substrat menempel dengan presisi tinggi.
Situs aktif juga menjadi tempat terjadinya reaksi kimia aktual — di sinilah ikatan lama pada substrat diputus dan ikatan baru terbentuk, menghasilkan produk akhir. Dengan demikian, walau kecil ukurannya, situs aktif berfungsi sebagai “jantung molekuler” dari aktivitas enzimatik.
Statement 2:
The shape and the chemical environment inside the active site permits a chemical reaction to proceed more easily.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
The shape → bentuk (geometri)
-
and the chemical environment → dan lingkungan kimiawi
-
inside the active site → di dalam situs aktif
-
permits a chemical reaction to proceed more easily → memungkinkan reaksi kimia berlangsung lebih mudah
Syarah:
Bentuk (shape) dan lingkungan kimiawi (chemical environment) situs aktif sangat menentukan fungsi katalitik enzim. Bentuk tiga dimensinya menentukan spesifisitas substrat, yakni hanya molekul dengan bentuk dan ukuran tertentu yang dapat masuk dan berikatan. Lingkungan kimiawinya ditentukan oleh residu-residu asam amino yang terdapat di dalam situs aktif — beberapa mungkin bersifat asam (menyumbangkan proton), basa (menarik proton), polar, atau nonpolar, sesuai kebutuhan reaksi. Kombinasi ini menciptakan mikro-lingkungan ideal yang dapat menurunkan energi aktivasi reaksi secara signifikan.
Sebagai contoh, DNA polymerase β (yang ditunjukkan pada gambar) memiliki situs aktif yang mampu menstabilkan pasangan basa nukleotida dan mengatur orientasi ion logam seperti Mg²⁺, yang penting dalam proses katalisis penambahan nukleotida baru pada rantai DNA. Lingkungan kimiawi yang tepat di situs aktif memastikan bahwa reaksi berjalan cepat, spesifik, dan bebas kesalahan (high fidelity catalysis).
Gambar pada Slide:
Model molekul DNA Polymerase Beta (PDB ID: 9ICW) menampilkan bagian enzim (warna merah dan kuning untuk rantai polipeptida) dan wilayah situs aktif (warna hijau) di mana DNA atau nukleotida berinteraksi. Representasi ini memperlihatkan bahwa situs aktif tidak selalu berada di permukaan, melainkan bisa berada di rongga dalam (internal pocket) yang terbentuk akibat pelipatan protein. Lokasi tersebut membantu menjaga lingkungan reaksi tetap terlindung dari air atau gangguan eksternal.
Anotasi [Pembaruan 2025]:
Pemahaman mutakhir menekankan bahwa situs aktif bersifat dinamis, bukan struktur statis. Enzim dapat mengalami perubahan bentuk kecil saat substrat berikatan — fenomena ini disebut induced fit, diperkenalkan oleh Daniel Koshland pada tahun 1958. Model ini kini diperluas menjadi conformational selection, di mana enzim sudah memiliki banyak konformasi pra-ada, dan substrat menstabilkan salah satunya.
Selain itu, teknologi quantum mechanics/molecular mechanics (QM/MM) kini digunakan untuk mempelajari transfer proton dan elektron di dalam situs aktif dengan resolusi atomik, memberikan bukti bahwa katalisis enzimatik tidak hanya bergantung pada bentuk situs aktif, tetapi juga pada fluktuasi elektron dan dinamika atomik waktu nyata.
Ringkasan:
Situs aktif adalah bagian paling penting dari enzim, tempat substrat berikatan dan reaksi kimia berlangsung. Bentuk tiga dimensi dan lingkungan kimiawi di dalamnya menentukan spesifisitas serta efisiensi reaksi. Enzim mempercepat reaksi dengan menciptakan lingkungan mikrokimia yang menurunkan energi aktivasi. Pemahaman modern menambahkan bahwa situs aktif bersifat dinamis, mengalami perubahan bentuk yang memungkinkan katalisis berlangsung secara presisi dan efisien.
16 Syarah (Penjelasan) Slide ke-8
Statement 1:
An additional non-protein molecule that is needed by some enzymes to help the reaction.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
An additional → suatu tambahan
-
non-protein molecule → molekul bukan protein
-
that is needed by some enzymes → yang dibutuhkan oleh beberapa enzim
-
to help the reaction → untuk membantu reaksi
Syarah:
Tidak semua enzim dapat bekerja hanya dengan komponen proteinnya. Sebagian enzim memerlukan komponen tambahan non-protein yang disebut ko-faktor (cofactor) untuk menjalankan aktivitas katalitiknya. Ko-faktor ini dapat berupa ion logam (misalnya Fe²⁺, Mg²⁺, Mn²⁺, Zn²⁺, Cu²⁺, atau Mo⁶⁺) atau molekul organik kecil (koenzim). Fungsi utama ko-faktor adalah membantu pembentukan kompleks enzim–substrat yang stabil, berpartisipasi dalam transfer elektron, proton, atau gugus kimia, serta menstabilkan keadaan transisi reaksi.
Tanpa ko-faktor, banyak enzim tidak dapat berfungsi sama sekali; bentuk enzim tanpa ko-faktor disebut apoenzim, sedangkan bentuk aktifnya (yang mengandung ko-faktor) disebut holoenzim.
Statement 2:
Tightly bound cofactors are called prosthetic groups.
Terjemah:
-
Tightly bound cofactors → ko-faktor yang terikat kuat
-
are called prosthetic groups → disebut gugus prostetik
Syarah:
Jika ko-faktor melekat kuat pada enzim, baik secara kovalen maupun non-kovalen tetapi sangat stabil, maka disebut gugus prostetik (prosthetic group). Gugus prostetik menjadi bagian integral dari struktur enzim dan tidak dilepaskan selama proses katalisis. Contoh klasiknya adalah heme pada hemoglobin dan sitokrom oksidase, serta FAD (flavin adenine dinucleotide) pada suksinat dehidrogenase. Gugus prostetik memungkinkan enzim melakukan reaksi redoks kompleks dengan stabilitas tinggi dan akurasi yang presisi.
Statement 3:
Cofactors that are bound and released easily are called coenzymes.
Terjemah:
-
Cofactors that are bound and released easily → ko-faktor yang mudah berikatan dan dilepaskan
-
are called coenzymes → disebut koenzim
Syarah:
Berbeda dari gugus prostetik, koenzim hanya berikatan sementara dengan enzim saat reaksi berlangsung dan dilepaskan setelahnya. Koenzim biasanya berupa molekul organik kecil yang berasal dari vitamin, dan berperan sebagai pembawa sementara (transporter) gugus kimia tertentu. Contohnya:
-
NAD⁺ / NADH (berasal dari niasin atau vitamin B₃) berfungsi membawa elektron dan proton dalam reaksi oksidasi-reduksi.
-
CoA (koenzim A) (berasal dari asam pantotenat atau vitamin B₅) membawa gugus asetil dalam metabolisme karbohidrat dan lemak.
-
TPP (tiamin pirofosfat) (berasal dari vitamin B₁) berperan dalam dekarboksilasi oksidatif.
Setelah membantu reaksi, koenzim kembali ke bentuk awalnya agar dapat digunakan kembali dalam siklus berikutnya.
Statement 4:
Many vitamins are coenzymes.
Terjemah:
-
Many vitamins → banyak vitamin
-
are coenzymes → merupakan koenzim
Syarah:
Sebagian besar vitamin berfungsi sebagai prekursor (bahan dasar) pembentuk koenzim. Karena tubuh tidak dapat mensintesis sebagian besar vitamin dalam jumlah cukup, maka asupan vitamin dari makanan menjadi esensial untuk mendukung aktivitas enzimatik. Kekurangan vitamin tertentu dapat menyebabkan gangguan enzimatik spesifik, misalnya:
-
Kekurangan vitamin B₃ (niasin) → menghambat kerja enzim dehidrogenase, menyebabkan penyakit pellagra.
-
Kekurangan vitamin B₁ (tiamin) → mengganggu enzim piruvat dehidrogenase, menyebabkan beri-beri.
-
Kekurangan vitamin B₆ (piridoksal fosfat) → menurunkan aktivitas enzim transaminase, mengganggu metabolisme asam amino.
Dengan demikian, vitamin bukan sekadar nutrien, tetapi juga komponen penting sistem katalitik sel.
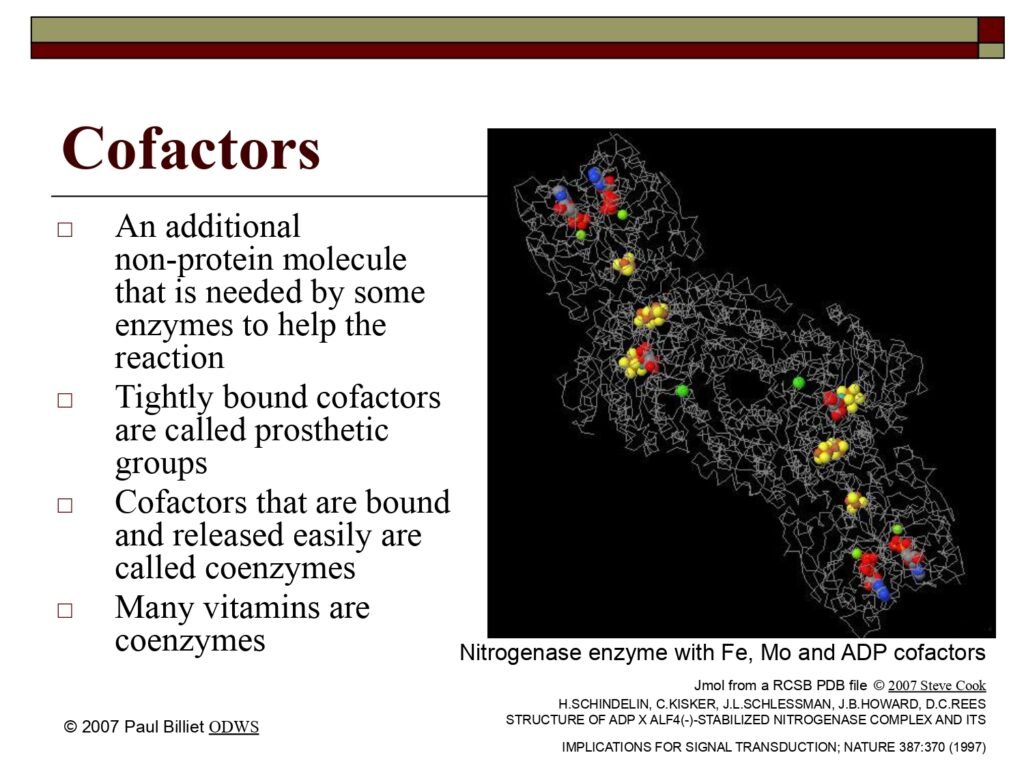
Gambar pada Slide:
Struktur enzim nitrogenase (enzim pengikat nitrogen biologis) dengan ko-faktor Fe (besi), Mo (molibdenum), dan ADP, memperlihatkan kompleks multiatomik yang sangat spesifik. Enzim nitrogenase bekerja dalam proses fiksasi nitrogen, yaitu konversi N₂ menjadi NH₃ pada organisme prokariotik seperti Rhizobium. Keberadaan logam Fe dan Mo pada situs aktif memungkinkan transfer elektron yang diperlukan untuk memutus ikatan rangkap tiga kuat pada gas nitrogen.
Anotasi [Pembaruan 2025]:
Dalam biokimia modern, istilah “cofactor” kini mencakup tidak hanya molekul kecil dan ion logam, tetapi juga kompleks logam–kluster seperti Fe-S cluster, Mn cluster, Cu center, dan Zn finger, yang berperan penting dalam katalisis redoks dan pengikatan DNA.
Selain itu, pendekatan metalloenzyme engineering digunakan untuk merekayasa enzim buatan dengan ko-faktor logam baru untuk memperluas kemampuan katalitiknya — misalnya mengganti ion logam asli dengan logam transisi lain untuk meningkatkan aktivitas atau stabilitas.
Riset terbaru juga mengungkap cofactor dynamics, yaitu bagaimana ko-faktor tidak hanya membantu reaksi, tetapi juga ikut mengatur regulasi aktivitas enzim (misalnya NAD⁺ sebagai sinyal metabolik pada enzim sirtuin yang terkait penuaan).
Ringkasan:
Ko-faktor adalah molekul non-protein yang membantu kerja enzim. Jika melekat kuat disebut gugus prostetik, jika lepas-pasang disebut koenzim. Sebagian besar koenzim berasal dari vitamin dan berperan membawa gugus kimia dalam reaksi. Ko-faktor logam seperti Fe, Zn, dan Mg penting dalam katalisis redoks dan stabilisasi struktur enzim. Dalam biokimia modern, pemahaman tentang dinamika ko-faktor telah menjadi kunci dalam desain enzim sintetis dan penelitian metabolik.
18 Syarah (Penjelasan) Slide ke-9
Statement 1:
The substrate of an enzyme are the reactants that are activated by the enzyme.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
The substrate of an enzyme → substrat dari suatu enzim
-
are the reactants → adalah zat pereaksi (reaktan)
-
that are activated by the enzyme → yang diaktifkan oleh enzim
Syarah:
Substrat (substrate) adalah molekul atau senyawa kimia yang menjadi target kerja enzim. Dalam konteks reaksi biokimia, substrat berperan sebagai reaktan (reactant) — yaitu bahan awal yang akan diubah oleh enzim menjadi produk baru. Enzim tidak mengubah dirinya sendiri selama reaksi, melainkan hanya menurunkan energi aktivasi yang dibutuhkan substrat agar reaksi dapat berlangsung dengan lebih cepat.
Ketika substrat berikatan dengan situs aktif enzim, terbentuklah kompleks enzim–substrat (enzyme–substrate complex). Di dalam kompleks ini, enzim membantu memposisikan substrat dengan orientasi yang tepat, mengatur jarak antar gugus fungsional, dan menstabilkan keadaan transisi sehingga ikatan kimia lebih mudah diputus atau dibentuk. Setelah reaksi selesai, substrat telah berubah menjadi produk, dan enzim dilepaskan dalam bentuk semula sehingga dapat digunakan kembali untuk siklus reaksi berikutnya.
Statement 2:
Enzymes are specific to their substrates.
Terjemah:
-
Enzymes are specific → enzim bersifat spesifik
-
to their substrates → terhadap substratnya masing-masing
Syarah:
Salah satu ciri khas enzim adalah spesifisitas (specificity), yaitu kemampuan enzim untuk mengenali dan mengikat hanya substrat tertentu dari sekian banyak molekul di dalam sel. Spesifisitas ini diatur oleh bentuk geometris (spatial complementarity) dan sifat kimiawi (chemical complementarity) antara situs aktif dan substrat.
Model klasik Lock and Key (dikemukakan oleh Emil Fischer tahun 1894) menyatakan bahwa bentuk situs aktif enzim sudah sesuai secara tepat dengan substratnya — seperti kunci dan gembok. Namun model ini kemudian disempurnakan oleh teori Induced Fit (Daniel Koshland, 1958), yang menjelaskan bahwa situs aktif dapat sedikit berubah bentuk untuk menyesuaikan diri dengan substrat saat pengikatan terjadi. Kedua model tersebut menegaskan bahwa hanya substrat dengan struktur tertentu yang dapat “diaktifkan” oleh enzim tertentu, sehingga reaksi yang terjadi di dalam sel dapat terkontrol secara sangat selektif.
Statement 3:
The specificity is determined by the active site.
Terjemah:
-
The specificity → tingkat kekhususan
-
is determined by → ditentukan oleh
-
the active site → situs aktif
Syarah:
Spesifisitas enzim sepenuhnya ditentukan oleh struktur tiga dimensi situs aktif, yang dibentuk oleh urutan dan orientasi spesifik dari residu-residu asam amino. Beberapa residu berperan langsung dalam pengikatan substrat (binding site) melalui ikatan hidrogen atau interaksi elektrostatik, sementara residu lain berperan dalam katalisis (catalytic site) untuk mempercepat reaksi.
Dengan kata lain, situs aktif bukan hanya tempat fisik, tetapi juga ruang kimia yang kompleks yang dirancang oleh evolusi untuk mengatur pengenalan dan konversi substrat tertentu. Setiap perubahan kecil pada urutan asam amino (misalnya akibat mutasi) dapat mengubah bentuk situs aktif dan menyebabkan hilangnya spesifisitas — fenomena ini menjadi dasar bagi banyak penyakit genetik yang melibatkan enzim.
Anotasi [Pembaruan 2025]:
Penelitian terkini menunjukkan bahwa spesifisitas enzim tidak hanya bergantung pada struktur statis situs aktif, tetapi juga pada dinamika protein secara keseluruhan. Enzim dapat mengubah konformasinya dalam skala waktu mikrodetik hingga milidetik untuk “memandu” substrat menuju orientasi reaksi yang optimal.
Selain itu, beberapa enzim bersifat promiskuous (enzim promiscuous) — artinya dapat bekerja pada beberapa substrat yang mirip secara struktural. Fenomena ini penting dalam evolusi biokimia, karena memberi dasar bagi munculnya enzim baru (neofunctionalization) melalui mutasi adaptif.
Dalam bioengineering, prinsip spesifisitas ini menjadi kunci dalam desain enzim rekombinan dan enzim sintetis, yang dapat diubah untuk menerima substrat baru melalui site-directed mutagenesis dan protein design berbasis AI (misalnya AlphaFold + Rosetta).
Ringkasan:
Substrat adalah reaktan yang diubah oleh enzim menjadi produk. Setiap enzim memiliki tingkat spesifisitas tertentu terhadap substratnya, yang ditentukan oleh bentuk dan lingkungan kimiawi situs aktif. Hubungan antara enzim dan substrat diatur oleh prinsip kecocokan bentuk dan sifat kimia (model lock and key serta induced fit). Pemahaman modern menambahkan bahwa dinamika protein dan fleksibilitas konformasi juga berperan besar dalam menentukan spesifisitas katalitik enzim.
20 Syarah (Penjelasan) Slide ke-10
Statement 1:
Fit between the substrate and the active site of the enzyme is exact.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Fit between → kesesuaian antara
-
the substrate and the active site of the enzyme → substrat dan situs aktif enzim
-
is exact → sangat tepat / pas sempurna
Syarah:
Hipotesis Lock and Key (kunci dan gembok) pertama kali dikemukakan oleh Emil Fischer pada tahun 1894, menggambarkan hubungan antara enzim dan substrat yang bersifat spesifik dan presisi. Menurut model ini, bentuk situs aktif enzim sudah “tetap” dan memiliki komplementaritas struktural yang sempurna dengan substrat tertentu, layaknya sebuah kunci yang hanya dapat masuk ke gembok tertentu. Dengan demikian, substrat harus memiliki bentuk yang persis cocok agar dapat masuk ke dalam situs aktif dan membentuk kompleks enzim–substrat.
Model ini menekankan prinsip spesifisitas enzimatik absolut, artinya satu enzim hanya dapat mengenali satu jenis substrat. Walau model ini sederhana, ia membantu menjelaskan mengapa enzim begitu selektif dalam memilih substrat di tengah banyaknya molekul lain di dalam sel.
Statement 2:
Like a key fits into a lock very precisely.
Terjemah:
-
Like a key fits into a lock very precisely → seperti kunci yang pas sekali masuk ke dalam gembok
Syarah:
Analogi ini menjelaskan bahwa substrat (kunci) hanya dapat mengikat enzim (gembok) jika bentuknya sesuai sempurna. Interaksi ini diatur oleh gaya-gaya molekuler spesifik seperti ikatan hidrogen, interaksi elektrostatik, dan gaya van der Waals, yang mengunci substrat di dalam situs aktif untuk memulai reaksi. Kecocokan ini tidak hanya dalam hal bentuk tiga dimensi, tetapi juga dalam distribusi muatan listrik dan polaritas pada permukaan molekul.
Statement 3:
The key is analogous to the enzyme and the substrate analogous to the lock.
Terjemah:
-
The key is analogous to the enzyme → kunci diibaratkan sebagai enzim
-
and the substrate analogous to the lock → dan substrat diibaratkan sebagai gembok
Syarah:
Pada kalimat ini terdapat kebalikan dari analogi umum: biasanya enzim dianggap gembok dan substrat dianggap kunci, karena enzim bersifat pasif menunggu substrat yang cocok. Namun, dalam konteks ini makna tetap sama — menekankan bahwa hanya kombinasi tertentu yang dapat saling cocok secara kimiawi dan geometris. Analogi ini menyoroti spesifisitas molekuler dua arah, di mana baik substrat maupun enzim memiliki karakteristik fisik dan kimia yang saling melengkapi.
Statement 4:
Temporary structure called the enzyme–substrate complex formed.
Terjemah:
-
Temporary structure → struktur sementara
-
called the enzyme–substrate complex → disebut kompleks enzim–substrat
-
formed → terbentuk
Syarah:
Ketika substrat berhasil masuk ke situs aktif yang cocok, terbentuklah kompleks enzim–substrat (enzyme–substrate complex). Kompleks ini bersifat sementara (transien) dan merupakan tahap kunci dalam mekanisme katalisis enzimatik. Di dalam kompleks ini, enzim menstabilkan keadaan transisi substrat dan menurunkan energi aktivasi, memungkinkan reaksi kimia berlangsung dengan cepat. Setelah reaksi selesai, produk terbentuk dan dilepaskan dari situs aktif.
Statement 5:
Products have a different shape from the substrate.
Terjemah:
-
Products → produk
-
have a different shape from the substrate → memiliki bentuk yang berbeda dari substrat
Syarah:
Setelah reaksi selesai, struktur kimia substrat telah berubah sehingga produk yang dihasilkan tidak lagi cocok dengan situs aktif enzim. Karena itu, produk akan lepas dari enzim, dan situs aktif menjadi kosong kembali untuk menerima substrat baru. Siklus ini dapat berulang ribuan kali per detik pada satu molekul enzim tanpa enzim itu sendiri habis.
Statement 6:
Once formed, they are released from the active site, leaving it free to become attached to another substrate.
Terjemah:
-
Once formed → setelah terbentuk
-
they are released from the active site → produk dilepaskan dari situs aktif
-
leaving it free → meninggalkan situs aktif dalam keadaan bebas
-
to become attached to another substrate → untuk mengikat substrat lain
Syarah:
Ini menggambarkan sifat regeneratif enzim, yakni kemampuannya untuk berulang kali berpartisipasi dalam reaksi tanpa mengalami perubahan permanen. Setelah melepaskan produk, situs aktif kembali ke bentuk semula dan siap berikatan dengan substrat berikutnya. Inilah dasar efisiensi biokatalisis: satu enzim dapat mengkatalisis ribuan reaksi per detik (turnover rate) tanpa kehilangan struktur atau aktivitas.
Anotasi [Pembaruan 2025]:
Model Lock and Key memberikan pemahaman dasar tentang spesifisitas enzim, namun kini dianggap terlalu kaku. Penelitian modern menunjukkan bahwa enzim bukan struktur statis, melainkan dinamis dan fleksibel. Oleh karena itu, model Induced Fit (Koshland, 1958) menjadi pelengkap utama — menjelaskan bahwa enzim dapat berubah bentuk sedikit untuk menyesuaikan diri dengan substrat, meningkatkan afinitas dan efisiensi katalitik.
Selain itu, model Conformational Selection (abad ke-21) menjelaskan bahwa enzim memiliki berbagai konformasi dalam keadaan dinamis, dan substrat memilih konformasi yang paling cocok di antara banyak kemungkinan tersebut. Model ini didukung oleh hasil eksperimen cryo-EM dan simulasi dinamika molekuler (MD simulations) yang menunjukkan bahwa fluktuasi struktur protein memainkan peran penting dalam aktivitas katalitik enzim.
Ringkasan:
Hipotesis Lock and Key menggambarkan bahwa substrat cocok sempurna dengan situs aktif enzim seperti kunci dan gembok, membentuk kompleks enzim–substrat sementara. Setelah reaksi, produk dilepaskan dan enzim siap berikatan kembali dengan substrat baru. Meskipun model ini efektif menjelaskan spesifisitas enzim, pemahaman modern menunjukkan bahwa enzim bersifat dinamis, dan model Induced Fit serta Conformational Selection kini dianggap lebih akurat menggambarkan mekanisme molekuler sebenarnya.
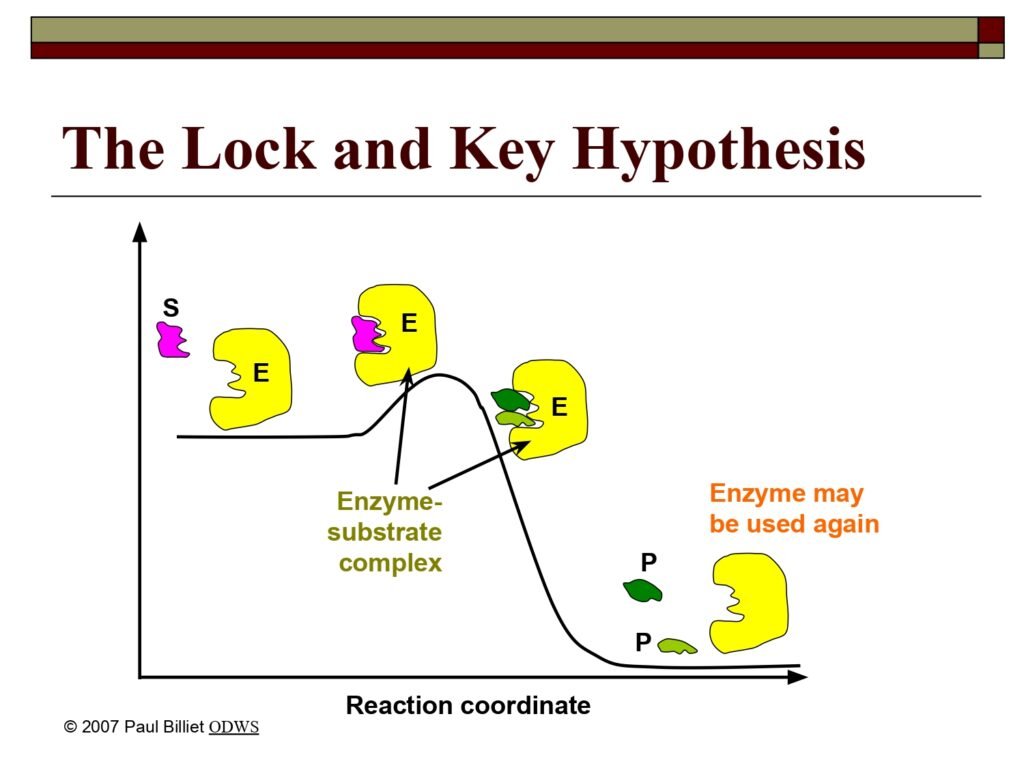
22 Syarah (Penjelasan) Slide ke-11
Gambar yang Ditampilkan:
Diagram ini menunjukkan lintasan energi (reaction coordinate) dari reaksi enzimatik berdasarkan model Lock and Key. Di dalamnya terdapat tahapan:
-
E + S → ES complex → E + P
(Enzim + Substrat → Kompleks Enzim–Substrat → Enzim + Produk)
Simbol:
-
E (kuning): Enzim
-
S (ungu muda): Substrat
-
P (hijau): Produk
Terjemah Unsur Visual:
-
Reaction coordinate → lintasan atau urutan reaksi
-
Enzyme-substrate complex → kompleks enzim–substrat
-
Enzyme may be used again → enzim dapat digunakan kembali
Syarah (Penjelasan Komprehensif):
Diagram ini memperjelas konsep dasar dari hipotesis Lock and Key yang sebelumnya dijelaskan secara verbal pada slide ke-10. Prosesnya dapat dijabarkan sebagai berikut:
-
Tahap awal (E + S):
Enzim (E) memiliki situs aktif dengan bentuk spesifik yang tepat komplementer dengan bentuk substrat (S). Substrat akan masuk ke dalam situs aktif layaknya kunci yang masuk ke dalam gembok. Pada tahap ini, belum terjadi perubahan kimia — hanya pengikatan fisik melalui gaya-gaya non-kovalen seperti ikatan hidrogen, gaya elektrostatik, dan gaya van der Waals. -
Pembentukan kompleks (ES complex):
Setelah substrat menempel, terbentuklah kompleks enzim–substrat (enzyme-substrate complex), yang ditunjukkan sebagai titik puncak pada grafik energi. Titik ini merepresentasikan keadaan transisi (transition state), yaitu kondisi energi tertinggi dalam proses reaksi. Dalam keadaan ini, substrat mulai mengalami distorsi (ketegangan ikatan) yang memudahkan pemutusan dan pembentukan ikatan baru. -
Pembentukan produk (E + P):
Setelah reaksi berlangsung, substrat berubah menjadi produk (P) yang memiliki bentuk dan sifat kimia berbeda dari substrat semula. Karena bentuk produk tidak lagi cocok dengan situs aktif, produk pun dilepaskan. Energi bebas sistem menurun secara signifikan — sesuai dengan arah panah menurun pada grafik. -
Regenerasi enzim:
Enzim tetap utuh dan dapat digunakan kembali untuk mengkatalisis reaksi berikutnya dengan substrat baru. Hal ini menegaskan sifat enzim sebagai biokatalis yang tidak habis selama reaksi, memungkinkan satu molekul enzim mempercepat ribuan reaksi per detik.
Makna Ilmiah dari Grafik Energi:
Sumbu vertikal menggambarkan energi bebas (free energy), sedangkan sumbu horizontal menunjukkan lintasan reaksi (reaction coordinate).
Tanpa enzim, energi aktivasi yang dibutuhkan untuk mencapai keadaan transisi jauh lebih tinggi. Namun dengan enzim, energi aktivasi menurun karena enzim menstabilkan keadaan transisi, sehingga reaksi berlangsung lebih cepat dan efisien.
Model ini menggambarkan bagaimana enzim menurunkan energi aktivasi tanpa mengubah energi total reaksi (ΔG) — yang menentukan apakah reaksi bersifat spontan atau tidak.
Anotasi [Pembaruan 2025]:
Model Lock and Key yang tampak di sini masih menggambarkan kecocokan statis antara enzim dan substrat. Namun penelitian mutakhir berbasis dynamics-based enzymology menunjukkan bahwa pengikatan substrat melibatkan perubahan konformasi kecil pada enzim — dikenal sebagai Induced Fit Model (Koshland, 1958).
Selain itu, penelitian terkini berbasis time-resolved X-ray crystallography dan molecular dynamics (MD) simulations memperlihatkan bahwa interaksi enzim–substrat tidak hanya berlangsung di situs aktif, tetapi juga dipengaruhi oleh residu jauh (distal residues) yang ikut bergetar dan menstabilkan keadaan transisi. Ini menandakan bahwa enzim bekerja sebagai entitas dinamis, bukan sekadar “cetakan molekul” pasif.
Ringkasan:
Diagram Lock and Key Hypothesis menjelaskan bahwa substrat berikatan secara tepat dengan situs aktif enzim membentuk kompleks sementara, yang menurunkan energi aktivasi dan menghasilkan produk baru. Produk kemudian dilepaskan, dan enzim siap digunakan kembali. Meskipun model ini menekankan kecocokan bentuk sempurna, pemahaman modern menambahkan bahwa fleksibilitas struktural dan dinamika konformasi juga berperan penting dalam proses katalitik enzim.
24 Syarah (Penjelasan) Slide ke-12
Statement 1:
This explains enzyme specificity.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
This explains → hal ini menjelaskan
-
enzyme specificity → kekhususan (spesifisitas) enzim
Syarah:
Model Lock and Key menjelaskan secara sederhana mengapa setiap enzim hanya dapat berinteraksi dengan substrat tertentu — fenomena yang disebut spesifisitas enzim. Karena bentuk situs aktif enzim dibuat secara presisi untuk menyesuaikan struktur substratnya, maka hanya substrat dengan geometri dan distribusi muatan yang tepat yang dapat berikatan.
Sebagai contoh, enzim sukrase hanya mampu menghidrolisis sukrosa menjadi glukosa dan fruktosa, tetapi tidak dapat bekerja pada maltosa. Hal ini terjadi karena bentuk situs aktif sukrase hanya cocok dengan konfigurasi ikatan glikosidik pada sukrosa.
Dengan demikian, hipotesis Lock and Key membantu memahami prinsip dasar bahwa struktur menentukan fungsi — bentuk tiga dimensi enzim menentukan substrat apa yang dapat dikatalisisnya.
Statement 2:
This explains the loss of activity when enzymes denature.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
This explains → hal ini juga menjelaskan
-
the loss of activity → hilangnya aktivitas
-
when enzymes denature → ketika enzim mengalami denaturasi
Syarah:
Ketika enzim terpapar suhu tinggi, perubahan pH ekstrem, atau zat kimia tertentu, struktur tiga dimensinya dapat rusak — fenomena ini disebut denaturasi. Denaturasi menyebabkan hilangnya bentuk spesifik dari situs aktif, sehingga substrat tidak lagi dapat “masuk” atau berikatan dengan tepat.
Dalam konteks model Lock and Key, hal ini dapat diibaratkan seperti gembok yang berubah bentuk karena panas — kunci yang tadinya cocok tidak lagi bisa masuk. Akibatnya, enzim kehilangan kemampuannya untuk mengkatalisis reaksi, meskipun urutan asam aminonya (struktur primer) belum berubah.
Fenomena ini menjelaskan mengapa sistem biologis sangat sensitif terhadap suhu dan pH: setiap perubahan struktural kecil pada enzim dapat menyebabkan hilangnya fungsi vital dalam metabolisme. Misalnya, enzim renin atau amilase bekerja optimal pada pH tertentu (sekitar 6–7), dan jika pH melenceng jauh dari nilai tersebut, aktivitas katalitiknya turun drastis.
Anotasi [Pembaruan 2025]:
Pemahaman modern menunjukkan bahwa denaturasi tidak selalu bersifat permanen — beberapa enzim dapat terlipat kembali (refolding) ke bentuk aktif jika kondisi fisiologis dipulihkan, terutama dalam organisme ekstremofil atau sistem in vitro yang dikontrol.
Selain itu, kini diketahui bahwa bukan hanya suhu dan pH yang menyebabkan hilangnya aktivitas, tetapi juga mutasi genetik kecil yang mengubah satu residu asam amino di situs aktif atau pada posisi struktural kunci. Hal ini dapat menurunkan afinitas substrat atau mengganggu stabilitas keseluruhan protein.
Pendekatan protein engineering dan directed evolution kini digunakan untuk memperkuat ketahanan enzim terhadap denaturasi melalui modifikasi residu permukaan, penambahan ikatan disulfida, atau stabilisasi domain hidrofobik.
Ringkasan:
Hipotesis Lock and Key tidak hanya menjelaskan spesifisitas enzim terhadap substratnya, tetapi juga mengapa enzim kehilangan aktivitasnya ketika terdenaturasi. Struktur tiga dimensi enzim yang unik memungkinkan interaksi spesifik dengan substrat. Ketika struktur ini rusak akibat panas, pH, atau zat kimia, situs aktif berubah bentuk dan kehilangan kemampuan untuk mengikat substrat, sehingga aktivitas katalitik hilang. Model ini menjadi dasar pemahaman awal tentang hubungan antara struktur, stabilitas, dan fungsi enzim.
26 Syarah (Penjelasan) Slide ke-13
Statement 1:
Some proteins can change their shape (conformation).
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Some proteins → beberapa protein
-
can change their shape (conformation) → dapat mengubah bentuknya (konformasi)
Syarah:
Hipotesis Induced Fit dikemukakan oleh Daniel E. Koshland Jr. pada tahun 1958 sebagai penyempurnaan dari model Lock and Key. Ia menjelaskan bahwa enzim bukanlah struktur kaku, melainkan molekul yang fleksibel dan dinamis. Beberapa enzim mampu mengalami perubahan konformasi (perubahan bentuk tiga dimensi) ketika substrat mendekat.
Perubahan bentuk ini bukanlah kerusakan struktural, melainkan penyesuaian adaptif yang bertujuan untuk menciptakan kondisi katalitik yang optimal. Dengan demikian, situs aktif tidak harus sudah berbentuk sempurna sebelum substrat datang, tetapi dapat membentuk diri (induced) secara spesifik saat interaksi dimulai.
Statement 2:
When a substrate combines with an enzyme, it induces a change in the enzyme’s conformation.
Terjemah:
-
When a substrate combines with an enzyme → ketika substrat bergabung dengan enzim
-
it induces a change in the enzyme’s conformation → hal ini menginduksi (menyebabkan) perubahan bentuk pada enzim
Syarah:
Ketika substrat mendekati enzim, gaya tarik elektrostatik dan interaksi non-kovalen antara keduanya menyebabkan enzim menyesuaikan bentuk situs aktifnya agar sesuai sempurna dengan substrat tersebut. Fenomena ini disebut induced fit (“kecocokan yang diinduksi”).
Perubahan ini memperkuat ikatan sementara antara enzim dan substrat serta menempatkan gugus-gugus fungsional penting pada posisi yang tepat untuk reaksi. Secara energetik, ini berarti enzim membantu substrat mencapai keadaan transisi dengan lebih mudah, menurunkan energi aktivasi, dan mempercepat laju reaksi secara signifikan.
Statement 3:
The active site is then moulded into a precise conformation.
Terjemah:
-
The active site → situs aktif
-
is then moulded into a precise conformation → kemudian dibentuk menjadi konformasi yang tepat
Syarah:
Pada tahap ini, situs aktif menjadi terbentuk sempurna secara tiga dimensi untuk menampung substrat secara spesifik. Proses ini bukan hanya tentang bentuk geometris, melainkan juga penataan ulang muatan listrik dan ikatan hidrogen yang menghasilkan mikro-lingkungan kimia ideal bagi terjadinya reaksi.
Dengan demikian, situs aktif bersifat plastis (dapat berubah bentuk), bukan rigid. Hal ini menjelaskan bagaimana enzim dapat beradaptasi terhadap variasi kecil pada substrat, dan mengapa enzim tetap efisien walaupun bekerja di lingkungan sel yang sangat kompleks.
Statement 4:
Making the chemical environment suitable for the reaction.
Terjemah:
-
Making the chemical environment suitable for the reaction → menciptakan lingkungan kimia yang sesuai untuk reaksi
Syarah:
Setelah konformasi enzim menyesuaikan diri, gugus-gugus aktif (misalnya residu asam amino seperti serin, histidin, atau aspartat) diposisikan secara presisi sehingga mampu menstabilkan keadaan transisi substrat. Lingkungan kimia di dalam situs aktif menjadi sangat teratur — pH lokal, polaritas, serta posisi donor dan akseptor proton disesuaikan sedemikian rupa untuk memfasilitasi pembentukan atau pemutusan ikatan kimia.
Inilah inti dari mekanisme katalisis enzimatik modern: enzim tidak hanya mengikat substrat, tetapi juga menciptakan lingkungan mikrokimia sementara yang membuat reaksi termodinamika menjadi jauh lebih mudah.
Statement 5:
The bonds of the substrate are stretched to make the reaction easier (lowers activation energy).
Terjemah:
-
The bonds of the substrate are stretched → ikatan-ikatan pada substrat ditarik / diregangkan
-
to make the reaction easier → agar reaksi lebih mudah berlangsung
-
(lowers activation energy) → (menurunkan energi aktivasi)
Syarah:
Selama proses pengikatan, gaya yang timbul antara enzim dan substrat dapat menarik atau menekan ikatan tertentu pada substrat, menyebabkan tegangan (strain) dalam molekul tersebut. Kondisi ini meniru keadaan transisi (transition state), sehingga energi yang diperlukan untuk memecah atau membentuk ikatan baru menjadi jauh lebih rendah.
Dengan kata lain, enzim mempercepat reaksi bukan dengan memberikan energi, melainkan dengan mengurangi kebutuhan energi aktivasi (Ea). Mekanisme ini merupakan prinsip dasar semua katalis, tetapi dalam biologi, terjadi secara terarah, spesifik, dan efisien berkat sifat adaptif struktur enzim.
Anotasi [Pembaruan 2025]:
Model Induced Fit kini menjadi kerangka dasar untuk menjelaskan dynamical enzymology, yaitu pandangan bahwa fungsi enzim tidak dapat dipahami tanpa mempertimbangkan perubahan bentuk dan fluktuasi atomiknya.
Teknik time-resolved crystallography, NMR relaxation, dan molecular dynamics (MD) simulations menunjukkan bahwa enzim selalu berada dalam ensemble konformasi, dan substrat hanya menstabilkan satu dari berbagai bentuk tersebut.
Pendekatan modern bahkan menggabungkan konsep conformational selection — substrat memilih konformasi enzim yang sudah tersedia, lalu enzim mengalami induced fit tambahan untuk mencapai keadaan transisi.
Ringkasan:
Hipotesis Induced Fit menjelaskan bahwa enzim bersifat fleksibel dan dapat menyesuaikan bentuknya saat berinteraksi dengan substrat. Penyesuaian ini menciptakan lingkungan kimia ideal yang menurunkan energi aktivasi, mempercepat reaksi, dan memastikan spesifisitas tinggi. Model ini menggantikan pandangan lama Lock and Key yang kaku, dan kini menjadi dasar pemahaman modern tentang dinamika molekuler dan mekanisme katalisis enzim.
28 Syarah (Penjelasan) Slide ke-14
Statement:
This explains the enzymes that can react with a range of substrates of similar types.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
This explains → hal ini menjelaskan
-
the enzymes that can react → enzim-enzim yang dapat bereaksi
-
with a range of substrates → dengan berbagai jenis substrat
-
of similar types → yang memiliki kemiripan tipe atau struktur
Syarah (Penjelasan Komprehensif):
Slide ini menggambarkan bagaimana model Induced Fit dapat menjelaskan fleksibilitas substrat pada beberapa jenis enzim. Berbeda dengan model Lock and Key yang mengharuskan kecocokan sempurna antara enzim dan substrat, model Induced Fit menunjukkan bahwa enzim dapat menyesuaikan diri terhadap substrat yang memiliki bentuk serupa, meskipun tidak identik.
Fenomena ini dijelaskan melalui gambar enzim hexokinase, yang ditampilkan dalam dua kondisi:
-
(a): struktur enzim tanpa substrat (glukosa) — bentuknya tampak terbuka dan belum sempurna.
-
(b): struktur enzim setelah berikatan dengan glukosa — enzim “menutup” sebagian situs aktifnya untuk memeluk substrat dengan rapat.
Perubahan bentuk ini menunjukkan bahwa enzim tidak harus memiliki bentuk kaku sejak awal, melainkan akan berubah menyesuaikan diri saat substrat masuk ke situs aktif. Dengan cara ini, hexokinase dapat mengenali dan bekerja tidak hanya pada glukosa, tetapi juga pada molekul yang mirip seperti fruktosa dan manosa, selama struktur dasarnya masih serupa (misalnya memiliki gugus hidroksil pada posisi tertentu).
Inilah alasan mengapa model Induced Fit menjelaskan mengapa beberapa enzim memiliki spesifisitas yang tidak absolut, tetapi spesifisitas kelompok (group specificity) — yaitu dapat bereaksi dengan beberapa substrat yang memiliki tipe kimia dan bentuk mirip.
Makna dari Gambar (Hexokinase):
-
Pada panel (a), enzim hexokinase berada dalam bentuk apoenzyme (tanpa substrat). Situs aktifnya masih terbuka.
-
Pada panel (b), setelah glukosa berikatan, terjadi perubahan besar pada konformasi domain enzim. Situs aktif menutup sebagian, membentuk ruang katalitik yang pas (precise catalytic pocket).
-
Perubahan ini bersifat dinamis dan reversibel, hanya terjadi selama substrat berikatan. Setelah reaksi selesai dan produk dilepaskan, enzim kembali ke bentuk awalnya dan siap berinteraksi dengan substrat baru.
Implikasi Biokimia:
-
Fleksibilitas enzim meningkatkan efisiensi biologis.
Dengan kemampuan menyesuaikan bentuk, enzim dapat mempercepat reaksi berbagai substrat tanpa kehilangan kontrol terhadap spesifisitas. -
Menjelaskan toleransi enzim terhadap analog substrat.
Beberapa analog (substrat buatan yang mirip secara kimia) masih dapat digunakan dalam penelitian biokimia karena enzim mampu menyesuaikan diri terhadap struktur yang sedikit berbeda — misalnya penggunaan analog ATP seperti AMPPNP dalam studi enzim kinase. -
Menjadi dasar desain obat (drug design).
Dalam farmakologi modern, model Induced Fit digunakan untuk merancang inhibitor yang mampu menyesuaikan diri dengan konformasi enzim saat berinteraksi dengan substratnya, sehingga lebih efektif dalam menghambat reaksi.
Anotasi [Pembaruan 2025]:
Penelitian terbaru berbasis cryo-electron microscopy (cryo-EM) dan molecular dynamics (MD) simulations telah memperlihatkan secara nyata perubahan konformasi ini pada banyak enzim, termasuk hexokinase, kinases, dan protease.
Konsep modern yang melengkapi Induced Fit adalah “conformational selection and population shift”, yaitu:
-
Enzim sebenarnya memiliki banyak bentuk konformasi yang berbeda (disebut conformational ensemble).
-
Substrat tidak membentuk konformasi baru, melainkan memilih bentuk enzim yang paling cocok dari populasi yang sudah ada, kemudian enzim menyesuaikan sedikit lagi (induced fit tambahan).
Model gabungan ini kini dianggap paling akurat dalam menggambarkan perilaku enzim di lingkungan sel nyata yang dinamis dan berfluktuasi.
Ringkasan:
Model Induced Fit menjelaskan bahwa enzim dapat mengubah bentuknya saat substrat berikatan, menciptakan situs aktif yang sesuai untuk reaksi. Berkat fleksibilitas ini, beberapa enzim mampu berinteraksi dengan berbagai substrat yang memiliki kemiripan struktural. Contoh nyata adalah enzim hexokinase, yang mengalami perubahan konformasi besar saat mengikat glukosa. Pemahaman ini memperluas konsep Lock and Key dengan menambahkan unsur dinamika molekuler sebagai faktor kunci dalam spesifisitas dan efisiensi katalitik enzim.
30 Syarah (Penjelasan) Slide ke-15
Daftar Faktor:
-
Substrate concentration
-
pH
-
Temperature
-
Inhibitors
1. Substrate Concentration (Konsentrasi Substrat)
Penjelasan:
Laju reaksi enzimatik sangat bergantung pada jumlah substrat yang tersedia. Pada konsentrasi substrat rendah, peningkatan jumlah substrat akan meningkatkan laju reaksi karena semakin banyak molekul substrat yang bertemu dan berikatan dengan situs aktif enzim.
Namun, pada titik tertentu, semua situs aktif enzim telah terisi — kondisi ini disebut enzim jenuh (enzyme saturation). Setelah jenuh, penambahan substrat lebih banyak tidak lagi meningkatkan laju reaksi karena jumlah enzim menjadi faktor pembatas.
Konteks kinetika:
Fenomena ini dijelaskan oleh persamaan Michaelis–Menten, yang menggambarkan hubungan antara kecepatan reaksi (v) dan konsentrasi substrat ([S]). Nilai Km (Michaelis constant) menunjukkan konsentrasi substrat yang menghasilkan setengah kecepatan maksimum (½ Vmax). Km yang kecil menandakan afinitas enzim yang tinggi terhadap substrat, artinya enzim bekerja efisien bahkan pada konsentrasi substrat rendah.
2. pH (Derajat Keasaman)
Penjelasan:
Setiap enzim memiliki pH optimum, yaitu nilai pH di mana struktur tiga dimensi dan muatan listrik pada situs aktif berada dalam kondisi ideal untuk reaksi.
Perubahan pH yang terlalu besar dari nilai optimum dapat:
-
Mengubah muatan gugus asam amino penting pada situs aktif.
-
Mengganggu ikatan hidrogen dan ikatan ionik yang mempertahankan struktur enzim.
-
Mengakibatkan denaturasi, yaitu hilangnya bentuk aktif enzim.
Sebagai contoh:
-
Enzim pepsin di lambung bekerja optimal pada pH sekitar 2 (lingkungan asam).
-
Enzim amilase di mulut memiliki pH optimum sekitar 7 (netral).
-
Enzim tripsin di usus bekerja optimal pada pH 8 (sedikit basa).
Dengan demikian, pH lingkungan sangat menentukan kestabilan dan efisiensi enzim.
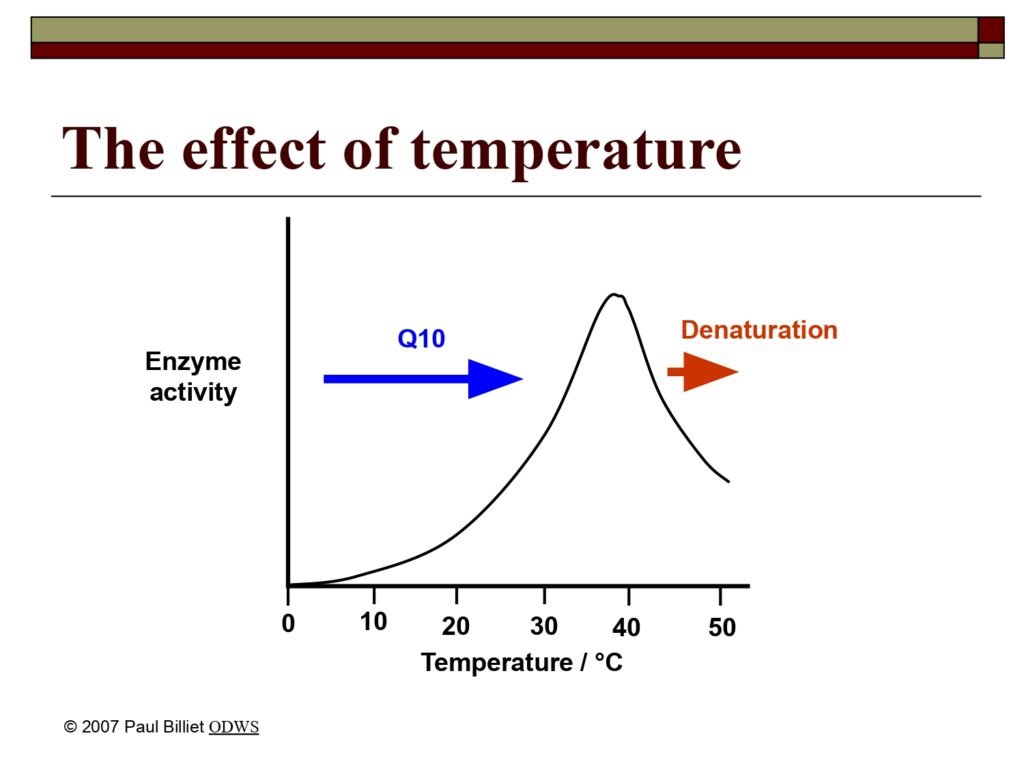
3. Temperature (Suhu)
Penjelasan:
Peningkatan suhu biasanya mempercepat reaksi enzimatik karena meningkatkan energi kinetik molekul — memperbesar kemungkinan tumbukan antara enzim dan substrat. Akan tetapi, kenaikan suhu hanya menguntungkan sampai suhu optimum, biasanya sekitar 37°C untuk enzim manusia.
Di atas suhu tersebut, ikatan non-kovalen yang menjaga struktur enzim mulai rusak, menyebabkan denaturasi termal. Ketika struktur tiga dimensi berubah, situs aktif kehilangan bentuknya dan tidak lagi cocok dengan substrat.
Sebaliknya, pada suhu terlalu rendah, energi kinetik berkurang dan reaksi berjalan lambat, tetapi enzim tidak rusak dan dapat aktif kembali saat suhu normal dipulihkan.
Ilustrasi biologis:
-
Suhu optimum manusia: ±37°C
-
Enzim dari bakteri termofilik (Thermus aquaticus): optimum pada ±70–80°C (misalnya enzim Taq polymerase, digunakan dalam PCR).
4. Inhibitors (Inhibitor / Penghambat)
Penjelasan:
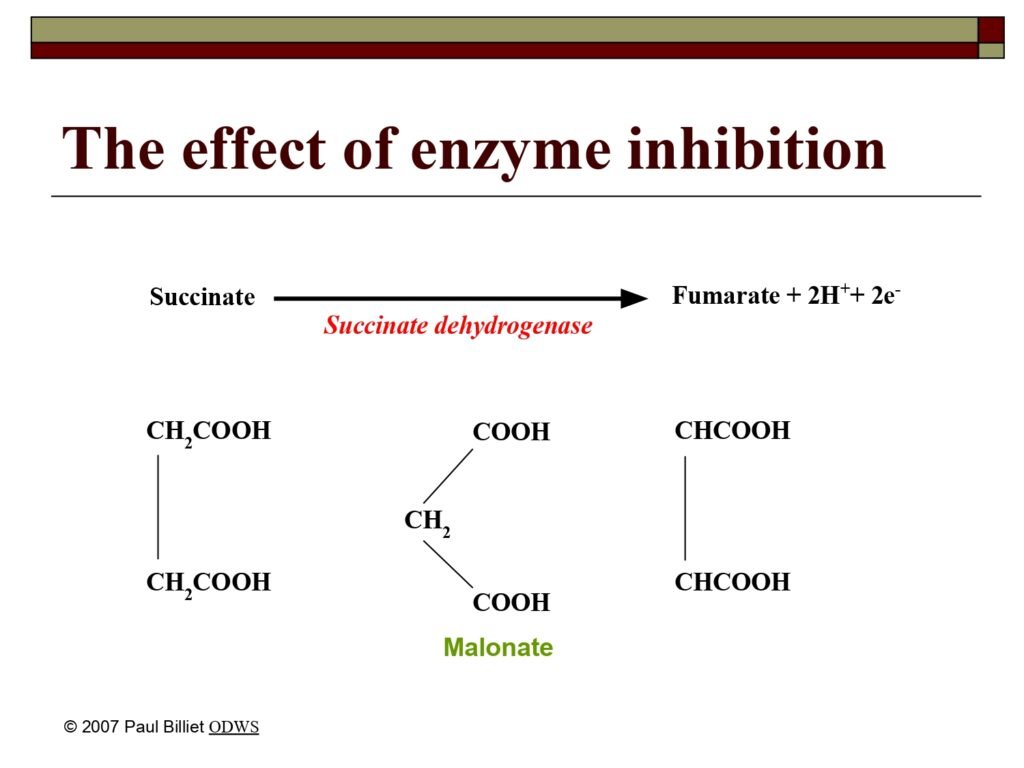
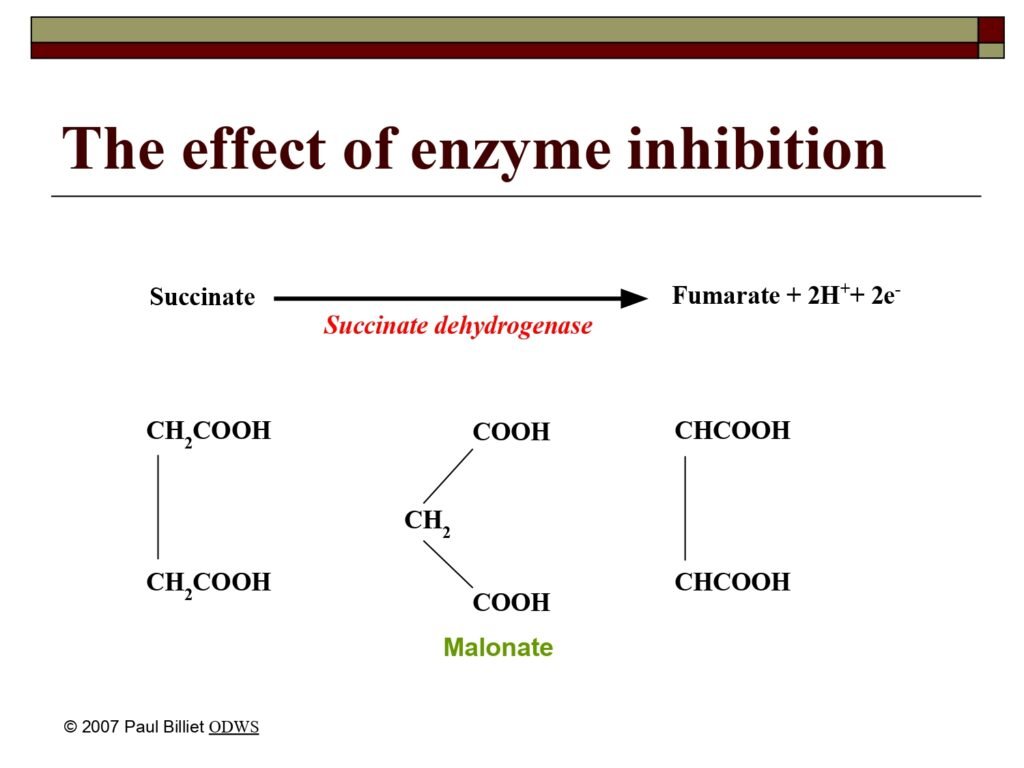
Inhibitor adalah zat yang mengurangi atau menghentikan aktivitas enzim dengan cara menghalangi interaksi antara enzim dan substrat. Ada dua tipe utama:
a. Inhibitor kompetitif (competitive inhibitor)
-
Struktur kimianya mirip dengan substrat.
-
Berkompetisi untuk menempati situs aktif.
-
Efek penghambatnya dapat dikurangi dengan menambah konsentrasi substrat.
-
Contoh: malonat menghambat suksinat dehidrogenase (karena mirip dengan suksinat).
b. Inhibitor non-kompetitif (non-competitive inhibitor)
-
Tidak berikatan pada situs aktif, melainkan pada situs alosterik (bagian lain dari enzim).
-
Mengubah bentuk konformasi enzim sehingga situs aktif tidak lagi cocok dengan substrat.
-
Efeknya tidak dapat diatasi dengan menambah substrat.
-
Contoh: sianida (CN⁻) yang mengikat Fe²⁺ pada enzim sitokrom oksidase di mitokondria.
Catatan:
Selain dua tipe utama ini, dikenal juga inhibitor unkompetitif (hanya berikatan dengan kompleks enzim–substrat) dan irreversible inhibitor yang menonaktifkan enzim secara permanen (misalnya logam berat seperti Hg²⁺ dan Pb²⁺).
Anotasi [Pembaruan 2025]:
Dalam biokimia modern, faktor-faktor ini kini dikaji tidak hanya secara makroskopik, tetapi juga secara molekuler dan kinetik:
-
pH microenvironment: setiap situs aktif memiliki mikrolingkungan pH internal yang bisa berbeda dari pH medium.
-
Thermal stability engineering: enzim dapat direkayasa genetik agar stabil pada suhu ekstrem (misalnya cold-adapted enzymes atau hyperthermostable enzymes).
-
Allosteric regulation: selain inhibitor, beberapa molekul justru menjadi aktivator alosterik yang meningkatkan aktivitas enzim.
-
Systems enzymology: kini dikenal juga efek lingkungan kompleks seperti tekanan osmotik, viskositas, dan crowding molekuler dalam sel yang turut memengaruhi aktivitas enzim in vivo.
Ringkasan:
Empat faktor utama yang memengaruhi aktivitas enzim adalah konsentrasi substrat, pH, suhu, dan inhibitor. Semua faktor ini bekerja dengan cara mengubah interaksi antara enzim, substrat, dan lingkungan kimiawi situs aktif. Enzim bekerja optimal hanya dalam kisaran kondisi tertentu, dan perubahan di luar batas ini dapat memperlambat atau menghentikan reaksi. Pemahaman tentang faktor-faktor ini sangat penting dalam bioteknologi, farmakologi, dan rekayasa industri enzimatik.
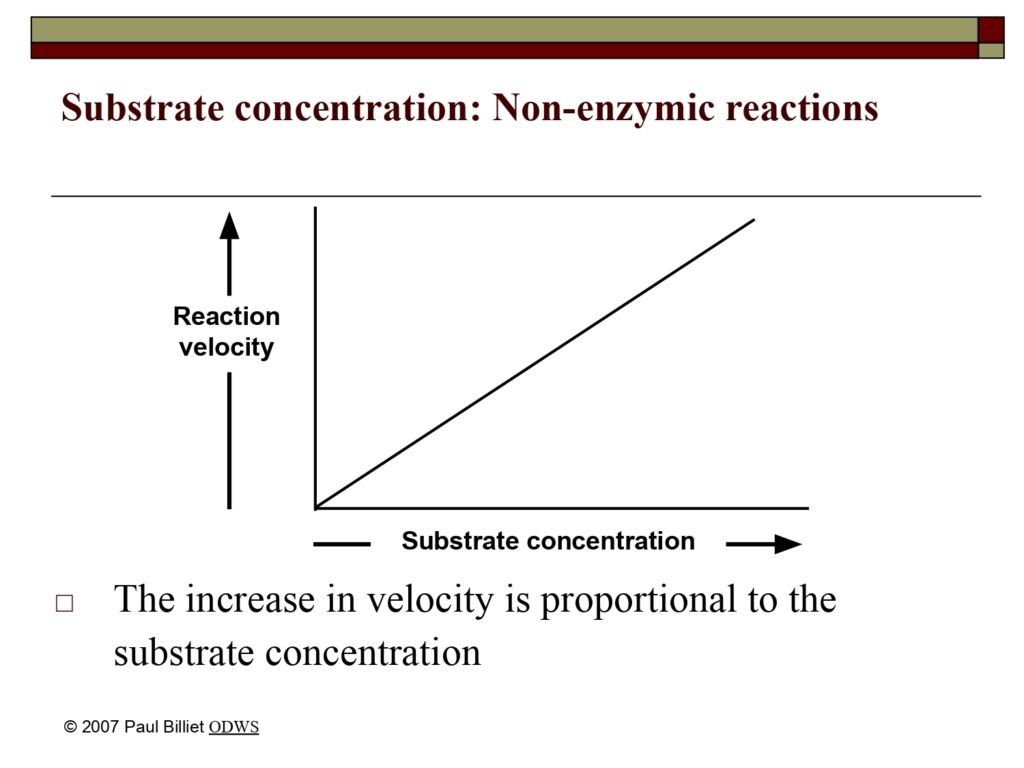
32 Syarah (Penjelasan) Slide ke-16
Statement:
The increase in velocity is proportional to the substrate concentration.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
The increase in velocity → peningkatan kecepatan (reaksi)
-
is proportional to → berbanding lurus dengan
-
the substrate concentration → konsentrasi substrat
Syarah (Penjelasan Komprehensif):
Slide ini menggambarkan hubungan antara konsentrasi substrat dan kecepatan reaksi (reaction velocity) pada reaksi non-enzimatik, yaitu reaksi kimia biasa yang tidak dikatalisis oleh enzim.
Pada reaksi non-enzimatik, laju reaksi meningkat secara linier dengan peningkatan konsentrasi substrat. Artinya, semakin banyak substrat yang tersedia, semakin sering terjadi tumbukan antar molekul reaktan, sehingga peluang terjadinya reaksi kimia juga meningkat.
Secara matematis, hubungan ini dapat dinyatakan dengan hukum kinetika dasar:
v=k[S]v = k[S]v=k[S]
di mana:
-
v = kecepatan reaksi,
-
k = konstanta laju reaksi,
-
[S] = konsentrasi substrat.
Hubungan linier ini menunjukkan bahwa reaksi masih berada dalam kondisi tidak jenuh, karena tidak ada faktor pembatas seperti situs aktif enzim atau kejenuhan katalitik. Selama energi aktivasi (Ea) tercapai, setiap molekul substrat memiliki peluang yang sama untuk bereaksi.
Makna dari Grafik pada Slide:
-
Sumbu X (horizontal): konsentrasi substrat (substrate concentration).
-
Sumbu Y (vertikal): kecepatan reaksi (reaction velocity).
-
Garis lurus naik: menggambarkan hubungan proporsional langsung.
Interpretasi grafik:
Ketika konsentrasi substrat meningkat dua kali lipat, maka kecepatan reaksi juga meningkat dua kali lipat — suatu hubungan proporsionalitas sempurna yang hanya berlaku pada reaksi tanpa katalis enzim atau reaksi di mana semua faktor lain tetap konstan.
Perbandingan dengan Reaksi Enzimatik:
Untuk memberikan konteks biokimia yang lebih dalam, penting dipahami bahwa reaksi non-enzimatik (seperti pada grafik ini) berbeda secara signifikan dengan reaksi enzimatik.
Pada reaksi yang dikatalisis enzim, hubungan antara [S] dan v tidak lagi linier karena enzim memiliki jumlah situs aktif yang terbatas. Ketika semua situs aktif telah terisi oleh substrat, laju reaksi mencapai titik maksimum yang disebut Vmax. Hubungan ini digambarkan oleh kurva Michaelis–Menten yang berbentuk hiperbola, bukan garis lurus.
Oleh karena itu, grafik pada slide ini merupakan model dasar (ideal) yang digunakan sebagai pembanding untuk memahami bagaimana enzim memperkenalkan batas kinetik alami terhadap laju reaksi.
Anotasi [Pembaruan 2025]:
Dalam konteks biokimia modern, perbedaan antara reaksi non-enzimatik dan enzimatik juga penting dalam memahami reaksi spontan di dalam tubuh yang berpotensi berbahaya.
Contoh:
-
Oksidasi glukosa spontan tanpa enzim sangat lambat, tetapi menghasilkan panas tinggi jika dilakukan secara langsung (misalnya pada pembakaran).
-
Oksidasi glukosa enzimatik melalui glikolisis berlangsung cepat namun terkontrol — energi dilepaskan sedikit demi sedikit dalam bentuk ATP, bukan panas.
Dengan demikian, peran enzim tidak hanya mempercepat reaksi, tetapi juga mengatur kecepatan dan arah reaksi agar sesuai dengan kebutuhan fisiologis organisme.
Ringkasan:
Pada reaksi non-enzimatik, peningkatan konsentrasi substrat akan secara langsung meningkatkan kecepatan reaksi secara proporsional. Hubungan ini bersifat linier karena tidak ada pembatas katalitik. Namun, dalam reaksi biologis yang dikatalisis oleh enzim, hubungan tersebut menjadi non-linier akibat keterbatasan jumlah situs aktif, yang akan dibahas pada slide berikutnya melalui kurva enzimatik (Michaelis–Menten kinetics).
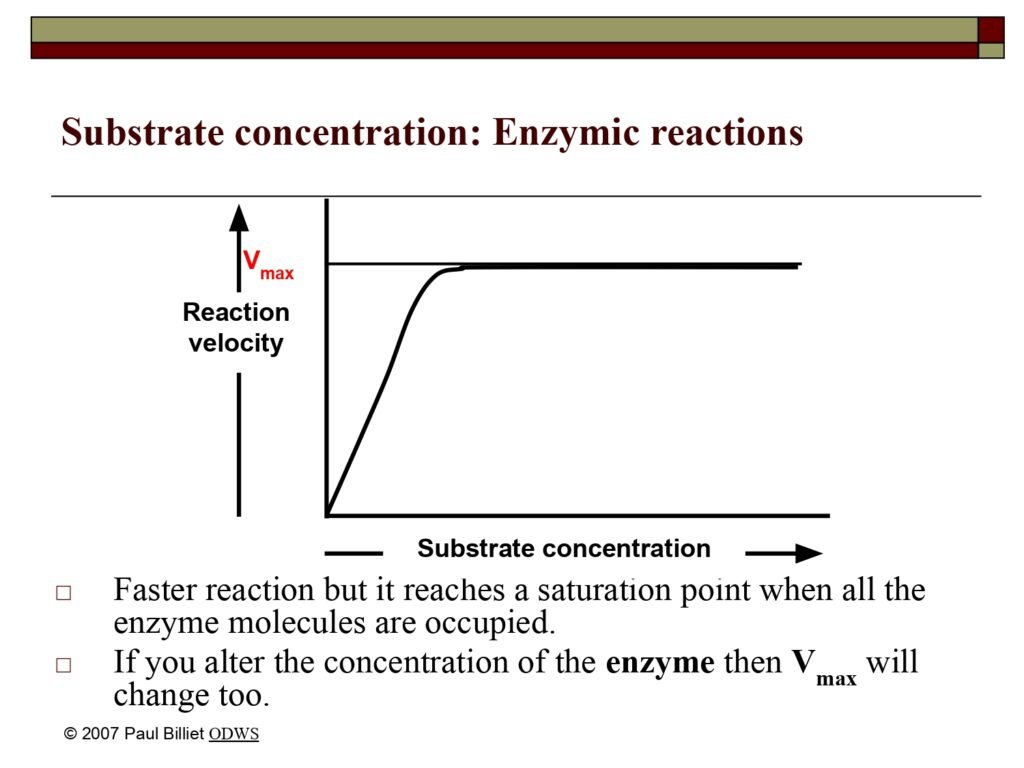
34 Syarah (Penjelasan) Slide ke-17
Statement 1:
Faster reaction but it reaches a saturation point when all the enzyme molecules are occupied.
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
Faster reaction → reaksi yang lebih cepat
-
but it reaches a saturation point → tetapi akan mencapai titik jenuh
-
when all the enzyme molecules are occupied → ketika semua molekul enzim telah terikat oleh substrat
Syarah (Penjelasan Komprehensif):
Slide ini menjelaskan hubungan antara konsentrasi substrat dan laju reaksi enzimatik, yang berbeda dengan reaksi non-enzimatik. Pada awalnya, peningkatan konsentrasi substrat menyebabkan peningkatan laju reaksi karena semakin banyak molekul substrat yang dapat berikatan dengan situs aktif enzim. Namun, hubungan ini tidak bersifat linier seperti pada reaksi kimia biasa.
Ketika konsentrasi substrat terus meningkat, jumlah enzim yang tersedia menjadi faktor pembatas. Setiap molekul enzim memiliki jumlah situs aktif terbatas, dan begitu semua situs aktif tersebut terisi (enzim dalam keadaan jenuh), laju reaksi mencapai kecepatan maksimum (Vmax). Pada titik ini, penambahan substrat tidak lagi meningkatkan laju reaksi karena semua enzim sudah bekerja secepat mungkin.
Kondisi ini dapat dianalogikan seperti jalur tol dengan jumlah gerbang masuk terbatas: pada awalnya, semakin banyak mobil yang datang (substrat), lalu lintas meningkat, tetapi saat semua gerbang tol penuh, arus kendaraan menjadi padat dan tidak bisa bertambah cepat lagi — meskipun jumlah mobil terus bertambah.
Secara matematis, hubungan ini dijelaskan oleh persamaan Michaelis–Menten:
v=Vmax[S]Km+[S]v = \frac{V_{max}[S]}{K_m + [S]}v=Km+[S]Vmax[S]
di mana:
-
v = kecepatan reaksi,
-
Vmax = kecepatan maksimum,
-
[S] = konsentrasi substrat,
-
Km = konstanta Michaelis, yaitu konsentrasi substrat yang menghasilkan laju reaksi sebesar setengah Vmax.
Statement 2:
If you alter the concentration of the enzyme then Vmax will change too.
Terjemah:
-
If you alter → jika Anda mengubah
-
the concentration of the enzyme → konsentrasi enzim
-
then Vmax will change too → maka nilai Vmax juga akan berubah
Syarah:
Kecepatan maksimum (Vmax) bergantung pada jumlah total enzim yang tersedia. Bila jumlah enzim meningkat, lebih banyak situs aktif tersedia untuk berikatan dengan substrat, sehingga Vmax meningkat secara proporsional. Sebaliknya, jika jumlah enzim berkurang (misalnya karena denaturasi, degradasi, atau adanya inhibitor), maka Vmax menurun.
Namun, nilai Km tidak berubah oleh perubahan jumlah enzim, karena Km mencerminkan afinitas enzim terhadap substrat, bukan jumlah total enzim. Afinitas ini merupakan sifat intrinsik dari interaksi enzim–substrat.
Dengan demikian, Vmax bergantung pada kuantitas enzim, sedangkan Km menggambarkan kualitas pengikatan substrat pada enzim.
Makna Grafik pada Slide:
Garis kurva pada grafik menunjukkan hubungan khas antara substrate concentration ([S]) pada sumbu X dan reaction velocity (v) pada sumbu Y.
Tahapan kurva dapat dijelaskan sebagai berikut:
-
Fase awal (linear region):
Saat [S] masih rendah, peningkatan substrat menghasilkan peningkatan laju reaksi hampir linier karena banyak enzim masih bebas. -
Fase transisi (intermediate region):
Ketika lebih banyak situs aktif mulai terisi, peningkatan laju reaksi mulai melambat. -
Fase jenuh (plateau):
Semua situs aktif telah terisi substrat — enzim dalam keadaan jenuh. Laju reaksi mencapai Vmax dan menjadi konstan meskipun [S] terus ditambah.
Konsep Biokimia Modern [Anotasi 2025]:
-
Keterbatasan Model Michaelis–Menten:
Model ini merupakan pendekatan ideal dan tidak selalu berlaku untuk enzim multimerik atau enzim dengan sifat alosterik. Enzim semacam itu mengikuti kinetika sigmoidal (bukan hiperbolik), seperti enzim hemoglobin atau fosfofruktokinase, yang diatur secara alosterik oleh molekul efektor. -
Single-Molecule Enzymology:
Penelitian terbaru menggunakan teknik fluorescence resonance energy transfer (FRET) dan molecular dynamics simulations menunjukkan bahwa Vmax tidak selalu konstan — dapat berfluktuasi karena dinamika konformasi enzim di tingkat molekul tunggal. -
Allosteric and Cooperative Effects:
Enzim kompleks dapat memiliki beberapa situs aktif yang saling mempengaruhi. Pengikatan substrat di satu situs dapat mempermudah (kooperatif positif) atau menghambat (kooperatif negatif) pengikatan di situs lain.
Ringkasan:
Hubungan antara konsentrasi substrat dan laju reaksi enzimatik bersifat non-linier, dengan peningkatan laju reaksi yang akhirnya mencapai titik maksimum (Vmax) saat enzim jenuh. Nilai Vmax dipengaruhi oleh jumlah enzim, sedangkan Km menggambarkan afinitas enzim terhadap substrat. Pemahaman ini menjadi dasar dari kinetika enzim Michaelis–Menten, yang berperan penting dalam farmakologi, metabolisme, dan desain biokatalis modern.
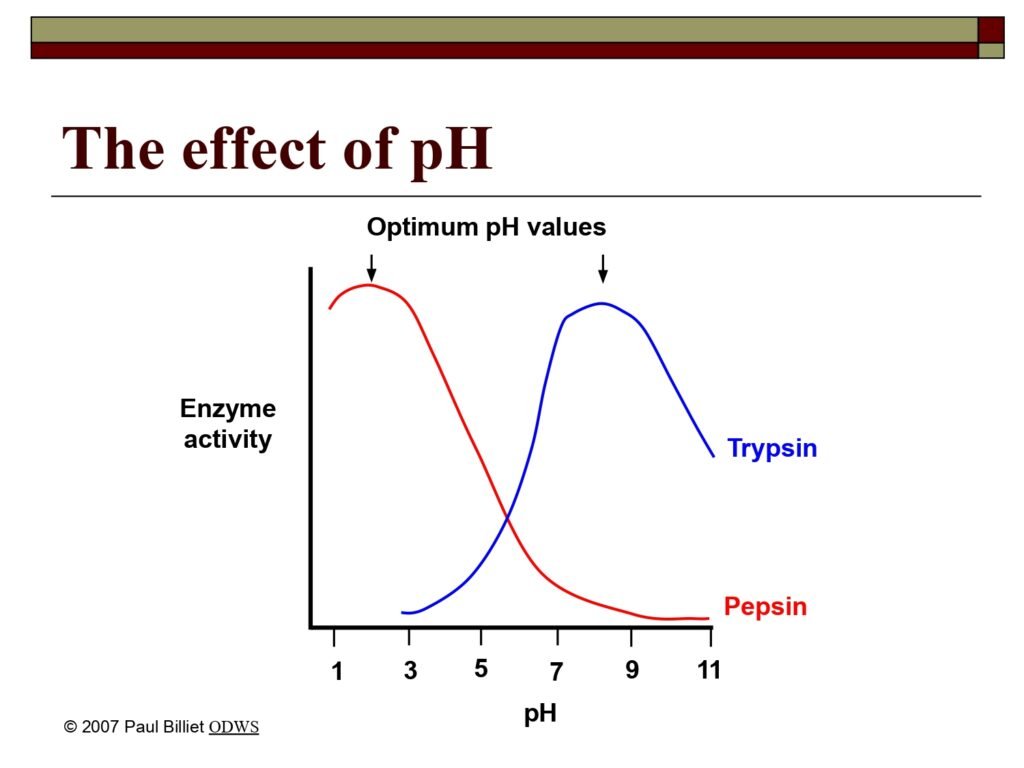
36 Syarah (Penjelasan) Slide ke-18
Elemen pada Grafik:
-
Sumbu X: pH (1–11)
-
Sumbu Y: Enzyme activity (aktivitas enzim)
-
Dua kurva utama:
-
Merah (Pepsin) → aktivitas optimum pada pH sekitar 2
-
Biru (Trypsin) → aktivitas optimum pada pH sekitar 8
-
-
Tanda panah di atas masing-masing puncak menandai optimum pH values
Terjemah Kata per Kata (Makna Bahasa Indonesia):
-
The effect of pH → pengaruh pH
-
Optimum pH values → nilai pH optimum (kondisi pH terbaik bagi aktivitas enzim)
Syarah (Penjelasan Komprehensif):
Slide ini menunjukkan bagaimana aktivitas enzim sangat dipengaruhi oleh pH lingkungan, dan bahwa setiap enzim memiliki pH optimum — yaitu nilai pH di mana enzim bekerja paling efisien.
Kurva merah menggambarkan enzim pepsin, sedangkan kurva biru menggambarkan enzim tripsin. Keduanya memiliki fungsi pencernaan, tetapi bekerja di lokasi berbeda dalam sistem pencernaan manusia:
-
Pepsin bekerja di lambung, yang memiliki suasana sangat asam (pH 1–3). Aktivitas optimalnya pada pH sekitar 2 mencerminkan adaptasinya terhadap lingkungan asam yang dihasilkan oleh asam lambung (HCl).
-
Pada pH netral atau basa, pepsin kehilangan bentuk aktifnya (terdenaturasi), sehingga tidak lagi mampu mengikat substrat protein.
-
-
Trypsin bekerja di usus halus, di mana kondisi lingkungan bersifat basa ringan (pH 7–9) karena adanya cairan pankreas yang mengandung bikarbonat.
-
pH optimum trypsin berada sekitar 8, menandakan bahwa residu asam amino di situs aktifnya memerlukan protonasi yang lebih rendah untuk berfungsi optimal dalam hidrolisis ikatan peptida.
-
Dengan demikian, kedua kurva menunjukkan spesifisitas fisiologis enzim terhadap pH, yang disesuaikan dengan lokasi dan fungsi biologisnya di dalam tubuh.
Penjelasan Ilmiah tentang Mekanisme Pengaruh pH:
Perubahan pH dapat memengaruhi aktivitas enzim melalui dua mekanisme utama:
-
Perubahan muatan ionik pada residu asam amino penting:
-
Situs aktif enzim sering mengandung gugus asam amino bermuatan (seperti –COOH atau –NH₂).
-
pH yang terlalu rendah atau tinggi dapat mengubah muatan gugus tersebut, sehingga mengganggu ikatan hidrogen, ikatan ionik, dan interaksi elektrostatik yang menjaga bentuk tiga dimensi enzim.
-
-
Perubahan struktur konformasi (denaturasi):
-
Pada pH ekstrem, enzim dapat kehilangan struktur tersier dan kuartenernya.
-
Denaturasi ini menyebabkan hilangnya bentuk spesifik situs aktif, sehingga substrat tidak lagi cocok untuk berikatan — seperti “kunci dan gembok” yang berubah bentuk.
-
Dengan demikian, pH optimum menandai kondisi di mana keseimbangan muatan, struktur konformasi, dan interaksi kimia dalam situs aktif berada pada keadaan paling stabil.
Makna Biologis dari Grafik:
Kurva yang ditunjukkan bersifat lonceng (bell-shaped curve), menggambarkan bahwa aktivitas enzim meningkat saat pH mendekati optimum dan menurun tajam saat pH terlalu asam atau terlalu basa.
Fenomena ini mencerminkan prinsip umum bahwa struktur menentukan fungsi, dan bahwa aktivitas enzim maksimum hanya dapat terjadi pada lingkungan kimia yang sesuai dengan karakter residu aktifnya.
Anotasi [Pembaruan 2025]:
Penelitian mutakhir menunjukkan bahwa efek pH tidak hanya disebabkan oleh perubahan muatan gugus pada permukaan protein, tetapi juga oleh mikrolingkungan pH di dalam situs aktif yang bisa berbeda dari pH medium luar.
Selain itu, teknologi constant-pH molecular dynamics (CpHMD) kini memungkinkan simulasi perubahan konformasi enzim pada berbagai kondisi pH, mengungkapkan bahwa:
-
Beberapa enzim memiliki multiple pH optima tergantung pada substrat yang digunakan.
-
Enzim dapat beradaptasi terhadap perubahan pH dengan melakukan micro-conformational shift tanpa kehilangan fungsi total.
Sebagai contoh, karbonik anhidrase dapat tetap aktif dalam rentang pH yang luas (6–10) karena memiliki residu aktif yang mampu menyesuaikan protonasi dinamisnya.
Ringkasan:
Grafik ini menunjukkan bahwa setiap enzim memiliki pH optimum, yaitu kondisi keasaman atau kebasaan di mana aktivitas katalitiknya paling tinggi. Pepsin beradaptasi untuk bekerja pada lingkungan asam di lambung (pH ≈ 2), sedangkan trypsin bekerja optimal di lingkungan basa ringan di usus halus (pH ≈ 8). Perubahan pH yang ekstrem dapat menurunkan atau menghentikan aktivitas enzim karena menyebabkan perubahan muatan atau denaturasi protein.
38 Syarah (Penjelasan) Slide ke-19
Statement 1:
Extreme pH levels will produce denaturation.
Terjemah Kata per Kata:
-
Extreme pH levels → tingkat pH yang ekstrem
-
will produce → akan menyebabkan / menghasilkan
-
denaturation → denaturasi (perubahan struktur protein)
Syarah:
pH ekstrem—baik sangat asam (pH < 3) maupun sangat basa (pH > 10)—dapat menyebabkan denaturasi enzim, yaitu proses di mana struktur tiga dimensi protein enzim rusak tanpa pemutusan ikatan kovalen utama (ikatan peptida).
Denaturasi ini terjadi karena perubahan pH memengaruhi gugus bermuatan dalam residu asam amino yang membentuk ikatan ionik, hidrogen, dan van der Waals di dalam enzim. Ketika ikatan-ikatan ini terganggu, lipatan alami protein terbuka, mengakibatkan kehilangan bentuk aktif (konformasi fungsional).
Akibatnya, enzim tidak lagi mampu mengikat substrat dengan tepat pada situs aktif, sehingga kehilangan kemampuan katalitiknya.
Statement 2:
The structure of the enzyme is changed.
Terjemah:
-
The structure → struktur
-
of the enzyme → dari enzim
-
is changed → mengalami perubahan
Syarah:
Struktur enzim yang dimaksud di sini meliputi struktur tersier dan kuartener, yang menentukan bentuk ruang situs aktif.
Ketika pH berubah drastis, ionisasi residu asam amino seperti histidin, aspartat, glutamat, lisin, dan arginin dapat terganggu. Perubahan muatan ini mengubah interaksi elektrostatik antarresidu, menyebabkan enzim menggulung secara berbeda atau bahkan terurai sebagian.
Dengan struktur yang berubah, komplemen bentuk antara enzim dan substrat tidak lagi sesuai, sehingga efisiensi katalisis menurun atau hilang total.
Statement 3:
The active site is distorted and the substrate molecules will no longer fit in it.
Terjemah:
-
The active site is distorted → situs aktif menjadi terdistorsi (berubah bentuk)
-
and the substrate molecules will no longer fit in it → dan molekul substrat tidak lagi dapat masuk atau berikatan dengan tepat
Syarah:
Situs aktif merupakan bagian kecil namun vital dari enzim tempat substrat berikatan. Ketika pH mengubah struktur tiga dimensi enzim, bentuk dan muatan permukaan situs aktif ikut berubah.
Akibatnya, substrat yang sebelumnya dapat berikatan secara spesifik kini tidak lagi cocok secara geometris atau elektrostatik, mirip seperti kunci yang berubah bentuk sehingga tidak dapat lagi masuk ke gemboknya.
Hal ini menjelaskan mengapa meskipun konsentrasi enzim tetap tinggi, aktivitas katalitik menurun drastis pada pH ekstrem.
Statement 4:
At pH values slightly different from the enzyme’s optimum value, small changes in the charges of the enzyme and its substrate molecules will occur.
Terjemah:
-
At pH values slightly different → pada nilai pH yang sedikit berbeda
-
from the enzyme’s optimum value → dari nilai pH optimum enzim
-
small changes in the charges → perubahan kecil pada muatan
-
of the enzyme and its substrate molecules → pada enzim dan molekul substrat
-
will occur → akan terjadi
Syarah:
Bahkan pergeseran kecil dari pH optimum dapat mengubah tingkat protonasi dari gugus fungsional pada enzim maupun substratnya.
Contohnya, gugus karboksilat (–COOH) dan amina (–NH₂) pada residu aktif dapat mengalami perubahan ionisasi menjadi –COO⁻ atau –NH₃⁺ tergantung pH lingkungan.
Perubahan muatan ini dapat mengubah gaya tarik-menarik elektrostatik antara enzim dan substrat, sehingga ikatan sementara (transient binding) di situs aktif menjadi kurang stabil.
Dengan kata lain, walaupun tidak menyebabkan denaturasi total, pH yang sedikit menyimpang dari optimum tetap dapat mengurangi kecepatan reaksi karena penurunan efisiensi pengikatan substrat.
Statement 5:
This change in ionisation will affect the binding of the substrate with the active site.
Terjemah:
-
This change in ionisation → perubahan tingkat ionisasi ini
-
will affect → akan memengaruhi
-
the binding of the substrate with the active site → pengikatan antara substrat dengan situs aktif
Syarah:
Perubahan ionisasi akibat pH tidak hanya mengubah bentuk (konformasi), tetapi juga mengganggu keseimbangan muatan listrik di situs aktif.
Jika muatan situs aktif menjadi tidak sesuai dengan muatan substrat, interaksi elektrostatik positif–negatif yang penting untuk pengikatan akan melemah atau hilang.
Sebagai contoh, enzim dengan situs aktif bermuatan negatif mungkin memerlukan substrat bermuatan positif agar dapat berikatan kuat. Jika pH berubah dan mengionisasi situs aktif menjadi netral, maka interaksi ini hilang dan kompleks enzim–substrat gagal terbentuk.
Dalam konteks fisiologis, pengaturan pH yang stabil di dalam sel—melalui sistem buffer biologis seperti bikarbonat, fosfat, dan protein plasma—berperan penting untuk menjaga agar enzim tetap berada pada pH kerjanya yang optimal.
Anotasi [Pembaruan 2025]:
Penelitian terbaru menunjukkan bahwa efek pH terhadap aktivitas enzim tidak hanya bersifat makroskopik (pada seluruh enzim), tetapi juga lokal (mikroskopik) di sekitar situs aktif.
Dengan teknik constant-pH molecular dynamics (CpHMD), ilmuwan kini mampu memetakan perubahan protonasi residu tunggal secara real-time.
Temuan modern juga mengungkapkan bahwa:
-
Beberapa enzim memiliki “pH microenvironment” yang dapat berbeda hingga 1–2 unit dari pH medium di sekitarnya.
-
Enzim adaptif seperti karbonik anhidrase dan DNA polimerase mampu mempertahankan aktivitas melalui penyesuaian konformasi lokal walau pH eksternal berubah.
Hal ini memperkuat pemahaman bahwa aktivitas enzim tidak hanya ditentukan oleh pH medium, tetapi juga oleh fleksibilitas struktural dan distribusi muatan internal enzim.
Ringkasan:
Perubahan pH, baik ekstrem maupun ringan, dapat memengaruhi struktur, muatan, dan fungsi enzim. Pada pH ekstrem, enzim mengalami denaturasi, kehilangan bentuk aslinya, dan tidak lagi dapat mengikat substrat. Pada pH yang hanya sedikit berbeda dari optimum, perubahan muatan pada gugus aktif enzim dan substrat menyebabkan penurunan efisiensi pengikatan. Akibatnya, aktivitas enzim berkurang bahkan sebelum struktur totalnya rusak. Oleh karena itu, pengaturan pH menjadi kunci penting dalam mempertahankan kestabilan dan efektivitas kerja enzim di dalam sistem biologis.
40 Syarah (Penjelasan) Slide ke-20
Statement 1:
Q10 (the temperature coefficient) = the increase in reaction rate with a 10°C rise in temperature.
Terjemah Kata per Kata:
-
Q10 (the temperature coefficient) → Q10 (koefisien suhu)
-
= the increase in reaction rate → adalah peningkatan laju reaksi
-
with a 10°C rise in temperature → akibat kenaikan suhu sebesar 10°C
Syarah:
Istilah Q10 (dibaca “kew-ten”) merupakan koefisien suhu, yaitu angka yang menunjukkan berapa kali lipat laju reaksi meningkat ketika suhu dinaikkan sebesar 10°C.
Dalam sistem biologis, Q10 digunakan untuk menilai sensitivitas reaksi biokimia terhadap perubahan suhu, baik untuk reaksi non-enzimatik maupun yang dikatalisis oleh enzim.
Secara matematis, Q10 dihitung dengan rumus:
Q10=k2k110T2−T1Q_{10} = \frac{k_2}{k_1}^{\frac{10}{T_2 - T_1}}Q10=k1k2T2−T110
di mana:
-
k₁ = laju reaksi pada suhu T₁,
-
k₂ = laju reaksi pada suhu T₂,
-
T₂ – T₁ = selisih suhu (biasanya 10°C).
Sebagai contoh, jika laju reaksi meningkat dua kali lipat ketika suhu naik dari 20°C ke 30°C, maka Q10 = 2.
Statement 2:
For chemical reactions the Q10 = 2 to 3 (the rate of the reaction doubles or triples with every 10°C rise in temperature).
Terjemah:
-
For chemical reactions → untuk reaksi kimia
-
the Q10 = 2 to 3 → nilai Q10 berkisar antara 2 hingga 3
-
(the rate of the reaction doubles or triples with every 10°C rise in temperature) → (artinya, laju reaksi menjadi dua atau tiga kali lebih cepat setiap kenaikan suhu 10°C)
Syarah:
Secara umum, reaksi kimia meningkat dua hingga tiga kali lipat untuk setiap kenaikan suhu 10°C. Hal ini karena kenaikan suhu meningkatkan energi kinetik molekul, memperbanyak tumbukan yang efektif antarreaktan, dan meningkatkan kemungkinan molekul mencapai energi aktivasi (Ea) yang dibutuhkan untuk memulai reaksi.
Namun, pada sistem biologis, peningkatan suhu yang terus menerus tidak selalu meningkatkan laju reaksi karena enzim sebagai katalis biologis memiliki batas kestabilan termal.
Statement 3:
Enzyme-controlled reactions follow this rule as they are chemical reactions.
Terjemah:
-
Enzyme-controlled reactions → reaksi yang dikendalikan oleh enzim
-
follow this rule → mengikuti aturan ini
-
as they are chemical reactions → karena pada dasarnya merupakan reaksi kimia
Syarah:
Reaksi enzimatik tetap mengikuti hukum kinetika kimia — semakin tinggi suhu, semakin besar energi kinetik dan semakin cepat laju reaksi.
Namun, perbedaan utama antara reaksi kimia biasa dan reaksi biologis adalah bahwa enzim bersifat termolabil (peka terhadap panas). Enzim bekerja optimal hanya pada suhu tertentu (biasanya 35–40°C untuk manusia).
Di bawah suhu ini, peningkatan suhu memang mempercepat reaksi sesuai nilai Q10, tetapi di atas suhu optimum, efek panas justru merusak struktur enzim.
Statement 4:
BUT at high temperatures proteins denature.
Terjemah:
-
BUT at high temperatures → namun pada suhu tinggi
-
proteins denature → protein mengalami denaturasi
Syarah:
Ketika suhu terlalu tinggi (biasanya di atas 45–50°C pada manusia), energi panas mulai memutus ikatan hidrogen dan ikatan non-kovalen yang mempertahankan struktur tersier enzim.
Proses ini disebut denaturasi termal, menyebabkan situs aktif kehilangan bentuk aslinya dan tidak lagi cocok dengan substrat.
Akibatnya, meskipun energi kinetik tinggi, laju reaksi justru turun drastis karena katalis biologisnya rusak.
Dalam sistem biologis, denaturasi bersifat irreversibel—enzim tidak dapat kembali ke bentuk semula setelah struktur tiga dimensinya hancur.
Statement 5:
The optimum temperature for an enzyme controlled reaction will be a balance between the Q10 and denaturation.
Terjemah:
-
The optimum temperature → suhu optimum
-
for an enzyme controlled reaction → bagi reaksi yang dikendalikan enzim
-
will be a balance → merupakan keseimbangan
-
between the Q10 and denaturation → antara efek Q10 (peningkatan laju) dan risiko denaturasi
Syarah:
Suhu optimum suatu enzim adalah titik keseimbangan dinamis antara dua efek yang berlawanan:
-
Efek Q10 → peningkatan suhu mempercepat reaksi karena energi kinetik meningkat.
-
Efek denaturasi → peningkatan suhu yang berlebihan merusak struktur enzim, menurunkan laju reaksi.
Pada suhu optimum, kedua efek ini seimbang: laju reaksi mencapai puncak maksimum sebelum enzim mulai rusak.
Untuk enzim manusia, suhu optimum biasanya sekitar 37°C, sesuai suhu tubuh. Untuk organisme ekstrem seperti Thermus aquaticus, suhu optimum bisa mencapai 70–80°C, karena enzimnya (misalnya Taq polymerase) tahan panas.
Anotasi [Pembaruan 2025]:
Penelitian terbaru menggunakan molecular dynamics simulations dan protein stability analysis menunjukkan bahwa:
-
Denaturasi termal tidak selalu terjadi secara total. Beberapa enzim mengalami local unfolding, yaitu pelepasan sebagian struktur pada domain tertentu, namun masih mempertahankan aktivitas parsial.
-
Enzim termostabil (misalnya dari arkea termofilik) memiliki jumlah ikatan ionik (salt bridge) dan interaksi hidrofobik lebih banyak, memberikan kestabilan ekstra terhadap panas.
-
Dalam konteks rekayasa protein, protein engineering kini memungkinkan peningkatan stabilitas termal melalui mutasi titik strategis pada residu asam amino yang menjaga integritas situs aktif pada suhu tinggi.
Dengan demikian, pemahaman tentang keseimbangan antara efek Q10 dan denaturasi kini digunakan dalam bioteknologi industri, seperti desain enzim tahan panas untuk proses fermentasi dan PCR.
Ringkasan:
Peningkatan suhu sebesar 10°C biasanya menggandakan atau melipatgandakan laju reaksi (Q10 = 2–3). Reaksi enzimatik mengikuti prinsip ini hingga suhu optimum tercapai. Namun, di atas suhu optimum, enzim mengalami denaturasi sehingga laju reaksi menurun. Oleh karena itu, suhu optimum suatu enzim merupakan hasil keseimbangan antara peningkatan laju reaksi akibat Q10 dan penurunan akibat denaturasi.
42 Syarah (Penjelasan) Slide ke-21
Elemen Grafik:
-
Sumbu X: Temperature (°C) → suhu dalam derajat Celcius.
-
Sumbu Y: Enzyme activity → aktivitas enzim.
-
Dua area diberi label:
-
Q10 (warna biru, arah ke kanan) — fase peningkatan aktivitas enzim seiring naiknya suhu.
-
Denaturation (warna merah, arah ke kanan) — fase penurunan aktivitas enzim akibat kerusakan struktur protein.
-
Syarah (Penjelasan Komprehensif):
Grafik ini menggambarkan hubungan khas antara suhu dan aktivitas enzim — dikenal sebagai kurva suhu-aktivitas enzim (temperature–activity curve). Bentuk kurva menyerupai lonceng (bell-shaped curve), menunjukkan bahwa aktivitas enzim meningkat secara bertahap pada suhu rendah hingga mencapai titik maksimum (suhu optimum), kemudian menurun tajam setelah melewati titik tersebut karena denaturasi.
1. Fase Peningkatan Aktivitas – Pengaruh Q10 (Kiri Grafik, Arah Panah Biru)
Pada suhu rendah (misalnya 0–35°C), peningkatan suhu menyebabkan peningkatan energi kinetik molekul. Akibatnya, jumlah tumbukan efektif antara enzim dan substrat meningkat, sehingga laju pembentukan kompleks enzim–substrat juga meningkat.
Fenomena ini dijelaskan oleh efek Q10, yaitu peningkatan dua hingga tiga kali lipat laju reaksi untuk setiap kenaikan suhu 10°C, sebagaimana dijelaskan pada slide sebelumnya.
Pada fase ini, struktur enzim masih stabil secara konformasi. Semua ikatan hidrogen, ionik, dan hidrofobik yang mempertahankan bentuk tiga dimensi enzim belum terganggu. Dengan demikian, setiap kenaikan suhu akan mempercepat katalisis hingga mencapai puncak aktivitas maksimum (optimum temperature).
2. Titik Optimum – Suhu Ideal Enzim
Puncak kurva menunjukkan suhu optimum enzim, yaitu suhu di mana enzim mencapai aktivitas tertinggi.
Untuk sebagian besar enzim manusia, suhu optimum berkisar sekitar 37°C, yaitu suhu normal tubuh. Pada titik ini, keseimbangan antara energi kinetik maksimum dan stabilitas struktur enzim berada pada kondisi ideal.
Enzim dari organisme lain memiliki suhu optimum yang berbeda — misalnya:
-
Enzim dari ikan kutub (psychrophilic enzymes) dapat bekerja optimal pada suhu 0–10°C.
-
Enzim dari bakteri termofilik (thermophilic enzymes), seperti Taq polymerase, bekerja optimal pada suhu sekitar 70–80°C.
3. Fase Penurunan Aktivitas – Denaturasi (Kanan Grafik, Arah Panah Merah)
Ketika suhu melampaui nilai optimum (biasanya di atas 40–45°C untuk enzim manusia), energi panas yang berlebih mulai menghancurkan ikatan non-kovalen yang menjaga struktur tersier dan kuartener enzim.
Proses ini disebut denaturasi termal, di mana:
-
Struktur tiga dimensi (3D) enzim terbuka (unfolding).
-
Situs aktif kehilangan bentuk spesifiknya.
-
Substrat tidak lagi dapat berikatan dengan tepat (loss of active site complementarity).
Pada tahap ini, meskipun energi kinetik tinggi, laju reaksi justru menurun drastis karena katalis biologisnya rusak. Bila denaturasi bersifat permanen, aktivitas enzim tidak dapat dipulihkan bahkan setelah suhu diturunkan kembali.
Hubungan antara Q10 dan Denaturasi:
Grafik ini secara visual menunjukkan keseimbangan dua proses:
-
Efek Q10 (menaikkan laju reaksi) — dominan pada suhu rendah hingga optimum.
-
Efek Denaturasi (menurunkan aktivitas enzim) — dominan setelah suhu optimum terlampaui.
Suhu optimum enzim merupakan titik pertemuan kedua efek ini, di mana peningkatan laju reaksi akibat kenaikan suhu tepat diimbangi oleh awal kerusakan struktur protein.
Interpretasi Biologis:
Kurva ini menjelaskan mengapa organisme hidup memiliki kisaran suhu fisiologis sempit untuk mempertahankan metabolisme yang efisien.
-
Pada suhu rendah → reaksi berjalan lambat, metabolisme melambat (misalnya pada kondisi hipotermia).
-
Pada suhu tinggi → enzim terdenaturasi, menyebabkan kegagalan sistem enzimatik penting (misalnya pada hipertermia).
Tubuh manusia menjaga suhu internal mendekati 37°C melalui mekanisme homeostasis agar aktivitas enzim tetap pada zona optimum.
Anotasi [Pembaruan 2025]:
Penelitian terkini dengan time-resolved fluorescence spectroscopy dan molecular dynamics simulations menunjukkan bahwa:
-
Denaturasi termal tidak terjadi secara serentak; terdapat tahap unfolding parsial di mana hanya domain tertentu yang kehilangan kestabilan terlebih dahulu.
-
Beberapa enzim dapat melipat kembali (refolding) ke bentuk aktif jika pendinginan dilakukan secara perlahan, terutama enzim yang memiliki chaperone protein atau sistem perbaikan lipatan.
-
Dalam bioteknologi modern, peningkatan stabilitas termal enzim menjadi fokus utama protein engineering melalui mutasi yang memperkuat ikatan hidrofobik, penambahan jembatan disulfida, atau substitusi residu polar dengan nonpolar di area inti protein.
Temuan-temuan ini memperluas pemahaman kita tentang bagaimana enzim dapat beradaptasi terhadap lingkungan ekstrem dan digunakan untuk industri bioteknologi suhu tinggi seperti PCR, fermentasi etanol, dan degradasi limbah biologis.
Ringkasan:
Grafik “The Effect of Temperature” menunjukkan bahwa aktivitas enzim meningkat dengan naiknya suhu karena efek Q10 hingga mencapai titik optimum, lalu menurun akibat denaturasi termal. Suhu optimum enzim merupakan keseimbangan antara percepatan reaksi akibat kenaikan energi kinetik dan kehilangan struktur akibat panas berlebih. Pemahaman ini penting untuk menjelaskan kestabilan fisiologis organisme dan penerapan enzim dalam teknologi modern.
44 Syarah (Penjelasan) Slide ke-22
Statement 1:
For most enzymes the optimum temperature is about 30°C.
Terjemah Kata per Kata:
-
For most enzymes → bagi sebagian besar enzim
-
the optimum temperature → suhu optimum
-
is about 30°C → adalah sekitar 30°C
Syarah:
Kalimat ini menjelaskan bahwa suhu optimum enzim secara umum berkisar di sekitar 30°C, terutama untuk organisme eukariot yang hidup di lingkungan sedang. Namun, perlu dicatat bahwa suhu optimum tidak bersifat universal — ia bergantung pada jenis organisme dan habitatnya.
Sebagai contoh, pada manusia, enzim bekerja paling efektif pada suhu tubuh normal (sekitar 37°C). Pada tumbuhan tropis atau organisme poikiloterm (bersuhu tubuh mengikuti lingkungan), nilai ini dapat sedikit lebih rendah, mendekati 30°C.
Suhu optimum merepresentasikan keseimbangan antara efek peningkatan energi kinetik (Q10) dan kestabilan struktur enzim, sebagaimana dijelaskan pada dua slide sebelumnya.
Statement 2:
Many are a lot lower, cold water fish will die at 30°C because their enzymes denature.
Terjemah Kata per Kata:
-
Many are a lot lower → banyak (enzim) memiliki suhu optimum yang jauh lebih rendah
-
cold water fish → ikan air dingin
-
will die at 30°C → akan mati pada suhu 30°C
-
because their enzymes denature → karena enzim-enzim mereka mengalami denaturasi
Syarah:
Pernyataan ini menyoroti fenomena adaptasi termal enzim terhadap habitat organisme.
Enzim ikan air dingin (misalnya ikan kutub) memiliki struktur yang lebih fleksibel agar tetap aktif pada suhu sangat rendah (0–10°C). Fleksibilitas ini dicapai dengan lebih sedikit ikatan ionik dan hidrofobik dibandingkan enzim organisme tropis.
Namun, akibatnya, enzim tersebut mudah terdenaturasi pada suhu lebih tinggi, karena ikatan lemah tersebut mudah terurai oleh energi panas.
Ketika ikan air dingin dipindahkan ke suhu sekitar 30°C, enzimnya kehilangan struktur tersier, situs aktif berubah bentuk, dan reaksi metabolisme penting berhenti, menyebabkan kematian.
Fenomena ini menjelaskan konsep psikrofilik (psychrophilic enzymes) — yaitu enzim yang beradaptasi bekerja optimal pada suhu rendah namun sangat rentan terhadap panas.
Statement 3:
A few bacteria have enzymes that can withstand very high temperatures up to 100°C.
Terjemah Kata per Kata:
-
A few bacteria → beberapa jenis bakteri
-
have enzymes that can withstand → memiliki enzim yang mampu bertahan terhadap
-
very high temperatures up to 100°C → suhu sangat tinggi hingga 100°C
Syarah:
Beberapa bakteri ekstrem, yang dikenal sebagai termofilik (thermophilic) dan hipertermofilik (hyperthermophilic), hidup di lingkungan panas seperti mata air panas vulkanik, ventilasi hidrotermal laut dalam, dan geyser.
Enzim-enzim mereka — misalnya Taq polymerase dari Thermus aquaticus atau DNA polymerase dari Pyrococcus furiosus — tetap aktif pada suhu tinggi karena memiliki stabilitas struktural luar biasa.
Karakteristik enzim termostabil ini antara lain:
-
Jumlah ikatan ionik (salt bridges) dan ikatan hidrofobik yang lebih banyak.
-
Inti protein yang lebih rapat dan lebih sedikit rongga air internal.
-
Adanya modifikasi asam amino yang mengurangi fleksibilitas rantai polipeptida.
Dengan adaptasi tersebut, enzim termostabil dapat berfungsi normal hingga mendekati titik didih air (100°C) tanpa kehilangan aktivitas.
Enzim-enzim seperti ini kini banyak dimanfaatkan dalam bioteknologi industri dan riset molekuler, contohnya pada reaksi PCR (Polymerase Chain Reaction) yang memerlukan suhu siklus tinggi.
Statement 4:
Most enzymes however are fully denatured at 70°C.
Terjemah Kata per Kata:
-
Most enzymes however → namun sebagian besar enzim
-
are fully denatured → terdenaturasi sepenuhnya
-
at 70°C → pada suhu 70°C
Syarah:
Pernyataan ini menegaskan batas umum kestabilan enzim pada organisme non-ekstrem.
Sebagian besar enzim biologis akan kehilangan struktur aktif sepenuhnya pada suhu sekitar 70°C.
Pada titik ini, ikatan hidrogen, van der Waals, dan hidrofobik yang menjaga bentuk protein telah terputus, dan enzim tidak dapat kembali ke bentuk aslinya walaupun didinginkan.
Fenomena ini disebut denaturasi irreversibel, dan menyebabkan hilangnya semua aktivitas katalitik.
Secara biologis, hal ini menjelaskan mengapa demam tinggi (di atas 41°C) bisa berbahaya bagi manusia: protein enzim dalam sel mulai kehilangan kestabilan, memperlambat atau menghentikan proses metabolisme vital.
Anotasi [Pembaruan 2025]:
Penelitian terbaru dalam bidang protein biophysics menunjukkan bahwa stabilitas termal enzim bukan hanya ditentukan oleh ikatan kimia internal, tetapi juga oleh lingkungan pelarut (solvent environment) dan ion-ion pendukung (cofactors).
-
Beberapa enzim dapat mempertahankan struktur lebih lama pada suhu tinggi jika berada dalam larutan dengan kadar garam tertentu (misalnya KCl atau Mg²⁺) yang membantu menjaga hidrasi protein.
-
Dalam sistem biologis alami, chaperone proteins seperti HSP (Heat Shock Proteins) berperan penting melindungi enzim dari denaturasi dengan menstabilkan lipatan protein saat terpapar panas.
-
Konsep ini menjadi dasar pengembangan enzim rekombinan tahan panas melalui pendekatan directed evolution dan rational mutagenesis, yang banyak diaplikasikan di industri farmasi, pangan, dan bioteknologi.
Ringkasan:
Setiap organisme memiliki enzim dengan kisaran suhu optimum berbeda sesuai adaptasi lingkungannya.
-
Enzim organisme mesofilik (seperti manusia) optimal di sekitar 30–37°C.
-
Enzim psikrofilik (ikan kutub, mikroba Arktik) aktif pada suhu rendah tetapi mudah rusak di atas 20–30°C.
-
Enzim termofilik dan hipertermofilik (misalnya dari bakteri vulkanik) mampu bertahan bahkan hingga 100°C.
Sebagian besar enzim biasa akan terdenaturasi total pada suhu 70°C, kehilangan struktur tiga dimensinya, dan tidak lagi dapat berfungsi.
46 Syarah (Penjelasan) Slide ke-23
Statement 1:
Inhibitors are chemicals that reduce the rate of enzymic reactions.
Terjemah Kata per Kata:
-
Inhibitors → inhibitor (penghambat)
-
are chemicals → adalah zat kimia
-
that reduce → yang menurunkan / mengurangi
-
the rate of enzymic reactions → laju reaksi enzimatik
Syarah:
Inhibitor adalah senyawa kimia yang memperlambat atau menghentikan reaksi yang dikatalisis oleh enzim. Dalam konteks biokimia, penghambatan enzim dapat terjadi melalui berbagai mekanisme — baik reversibel (dapat dilepaskan kembali) maupun irreversibel (mengikat permanen dan merusak enzim).
Perlambatan laju reaksi terjadi karena inhibitor mengganggu interaksi antara enzim dan substrat, baik dengan berkompetisi memperebutkan situs aktif, mengubah bentuk enzim, atau menonaktifkan kofaktor yang diperlukan.
Fungsi penghambatan enzim sangat penting dalam regulasi biologis alami (homeostasis) dan juga dimanfaatkan dalam farmakologi, misalnya untuk mengatur metabolisme yang berlebihan.
Statement 2:
They are usually specific and they work at low concentrations.
Terjemah Kata per Kata:
-
They are usually specific → mereka biasanya bersifat spesifik
-
and they work at low concentrations → dan bekerja pada konsentrasi rendah
Syarah:
Inhibitor enzim bersifat sangat spesifik, artinya setiap inhibitor biasanya hanya bekerja pada enzim tertentu atau bahkan pada situs spesifik dari enzim tersebut. Sifat spesifik ini disebabkan oleh komplementaritas bentuk molekul dan interaksi kimia antara inhibitor dan situs enzim.
Selain itu, inhibitor enzim bekerja efektif pada konsentrasi yang sangat kecil (mikromolar hingga nanomolar). Hal ini karena afinitasnya terhadap enzim sangat tinggi — artinya, walaupun jumlahnya sedikit, inhibitor dapat menempel kuat pada targetnya dan menghambat aktivitasnya secara signifikan.
Sebagai contoh, senyawa pestisida organofosfat dapat menghambat enzim asetilkolinesterase pada kadar yang sangat rendah, namun efeknya dapat menyebabkan kelumpuhan fatal karena sinyal saraf tidak dapat dihentikan.
Statement 3:
They block the enzyme but they do not usually destroy it.
Terjemah Kata per Kata:
-
They block the enzyme → mereka menghalangi enzim
-
but they do not usually destroy it → tetapi biasanya tidak merusaknya
Syarah:
Sebagian besar inhibitor tidak merusak struktur enzim secara permanen, melainkan menghalangi kerja katalitiknya untuk sementara waktu.
Pada penghambatan reversibel, inhibitor dapat terlepas kembali dari enzim sehingga aktivitas enzim dapat dipulihkan.
Contohnya adalah inhibitor kompetitif, yang bersaing dengan substrat untuk menempati situs aktif. Ketika konsentrasi substrat dinaikkan, substrat dapat “mengalahkan” inhibitor dan reaksi dapat berlangsung normal kembali.
Sebaliknya, inhibitor irreversibel (seperti logam berat: Hg²⁺, Pb²⁺, atau arsenik) dapat mengikat secara kovalen pada residu penting dalam enzim, menyebabkan kerusakan permanen.
Namun, pada konteks kalimat slide ini, istilah “tidak merusak” menekankan bahwa inhibitor umumnya bertindak seperti kunci penghambat sementara, bukan seperti racun destruktif yang menghancurkan protein katalitik.
Statement 4:
Many drugs and poisons are inhibitors of enzymes in the nervous system.
Terjemah Kata per Kata:
-
Many drugs and poisons → banyak obat dan racun
-
are inhibitors of enzymes → adalah penghambat enzim
-
in the nervous system → pada sistem saraf
Syarah:
Banyak obat dan racun bekerja dengan cara menghambat enzim penting dalam sistem saraf, sehingga memodifikasi transmisi impuls saraf.
Beberapa contoh penting:
-
Neostigmine dan Physostigmine → inhibitor asetilkolinesterase yang memperpanjang aksi neurotransmiter asetilkolin, digunakan untuk terapi miastenia gravis.
-
Organofosfat (misalnya sarin, parathion) → menghambat asetilkolinesterase secara irreversibel, menyebabkan penumpukan asetilkolin di sinapsis dan mengakibatkan kejang, paralisis, hingga kematian.
-
Monoamine oxidase inhibitors (MAOIs) → menghambat degradasi dopamin dan serotonin, digunakan untuk terapi depresi.
-
Caffeine dan theophylline → inhibitor enzim fosfodiesterase (PDE) yang meningkatkan kadar cAMP, menyebabkan stimulasi sistem saraf pusat.
Dengan demikian, penghambatan enzim pada sistem saraf dapat bersifat terapeutik (obat) atau toksik (racun), tergantung pada dosis, durasi, dan spesifisitas target.
Anotasi [Pembaruan 2025]:
Dalam biokimia modern, inhibitor diklasifikasikan lebih rinci berdasarkan mekanisme ikatan molekuler dan dinamika situs enzim:
-
Competitive inhibitor — bersaing dengan substrat pada active site (misalnya metotreksat terhadap dihidrofolat reduktase).
-
Noncompetitive inhibitor — mengikat pada allosteric site, mengubah konformasi enzim tanpa menghalangi ikatan substrat (misalnya ion logam berat).
-
Uncompetitive inhibitor — hanya mengikat kompleks enzim–substrat, menurunkan baik Vmax maupun Km.
-
Allosteric inhibitors — berperan dalam regulasi metabolisme, misalnya ATP menghambat fosfofruktokinase dalam glikolisis.
Selain itu, bidang drug design kini banyak mengembangkan reversible covalent inhibitors dan transition-state mimetics, yang meniru keadaan transisi substrat sehingga mampu menghambat enzim dengan afinitas sangat tinggi, namun tetap reversible — strategi ini banyak digunakan dalam desain obat kanker dan anti-virus modern.
Ringkasan:
Inhibitor adalah zat kimia yang mengurangi laju reaksi enzimatik dengan cara menghalangi interaksi antara enzim dan substrat. Mereka bekerja secara spesifik pada konsentrasi rendah dan biasanya tidak menghancurkan enzim, hanya memblokir aktivitasnya sementara. Banyak obat dan racun bekerja sebagai inhibitor pada sistem saraf, dan konsep ini menjadi dasar penting bagi pengembangan farmakologi dan toksikologi modern.
48 Syarah (Penjelasan) Slide ke-24
Statement 1:
Irreversible inhibitors: Combine with the functional groups of the amino acids in the active site, irreversibly.
Terjemah Kata per Kata:
-
Irreversible inhibitors → inhibitor ireversibel (penghambat yang tidak dapat dipulihkan)
-
combine with → berikatan dengan
-
the functional groups → gugus fungsi
-
of the amino acids → dari asam-asam amino
-
in the active site → yang berada di situs aktif
-
irreversibly → secara permanen / tidak dapat dipisahkan kembali
Syarah:
Inhibitor ireversibel adalah zat kimia yang berikatan secara permanen dengan enzim, biasanya melalui pembentukan ikatan kovalen kuat pada gugus fungsi dari residu asam amino penting yang terdapat di situs aktif.
Akibat ikatan ini, struktur aktif enzim berubah secara permanen sehingga enzim kehilangan kemampuan katalitiknya — bahkan setelah inhibitor dihilangkan, aktivitas enzim tidak dapat dipulihkan.
Gugus fungsi yang paling sering menjadi target inhibitor ireversibel adalah:
-
Gugus –OH (hidroksil) pada residu serin atau tirosin,
-
Gugus –SH (sulfhidril) pada residu sistein,
-
Gugus imidazol pada histidin,
-
Gugus karboksil (-COOH) pada asam glutamat atau asam aspartat.
Ikatan kovalen yang terbentuk antara inhibitor dan gugus fungsi tersebut mengubah konformasi aktif enzim, menghalangi substrat untuk berikatan, dan pada akhirnya menghentikan total reaksi enzimatik.
Inhibitor jenis ini berbeda dengan inhibitor reversibel, yang dapat lepas dari enzim tanpa merusak struktur aktif. Pada inhibitor ireversibel, efeknya bersifat toksik dan kumulatif, karena enzim yang rusak hanya dapat digantikan melalui sintesis protein baru oleh sel.
Statement 2:
Examples: nerve gases and pesticides, containing organophosphorus, combine with serine residues in the enzyme acetylcholine esterase.
Terjemah Kata per Kata:
-
Examples → contoh
-
nerve gases and pesticides → gas saraf dan pestisida
-
containing organophosphorus → yang mengandung senyawa organofosfor
-
combine with serine residues → berikatan dengan residu serin
-
in the enzyme acetylcholine esterase → pada enzim asetilkolinesterase
Syarah:
Contoh klasik inhibitor ireversibel adalah gas saraf dan pestisida organofosfat, yang bekerja dengan mengikat residu serin pada enzim asetilkolinesterase (AChE) secara permanen.
Asetilkolinesterase adalah enzim penting dalam sistem saraf, berfungsi untuk menghidrolisis neurotransmiter asetilkolin (ACh) di celah sinapsis setelah impuls saraf ditransmisikan.
Jika enzim ini dihambat secara ireversibel, asetilkolin akan menumpuk di sinapsis, menyebabkan stimulasi berlebihan pada neuron postsinaptik.
Akibat fisiologis dari akumulasi asetilkolin:
-
Kejang otot hebat (spasme), diikuti oleh kelumpuhan.
-
Gangguan pernapasan, karena otot diafragma terus berkontraksi tanpa relaksasi.
-
Kematian, jika aktivitas enzim tidak dapat dipulihkan dengan cepat.
Beberapa contoh spesifik senyawa yang termasuk inhibitor ireversibel jenis ini:
-
Sarin (GB) dan VX nerve gas, digunakan sebagai senjata kimia.
-
Parathion dan malathion, pestisida organofosfat yang menghambat asetilkolinesterase pada serangga maupun manusia.
Secara mekanistik, gugus fosforil dari organofosfat menyerang gugus hidroksil pada residu serin, membentuk ikatan fosfoester yang stabil. Ikatan ini hampir mustahil terhidrolisis secara spontan, sehingga menyebabkan enzim benar-benar tidak aktif.
Anotasi [Pembaruan 2025]:
Penelitian modern dalam enzimologi toksikologi dan farmakologi molekuler menunjukkan bahwa:
-
Inhibitor ireversibel tidak hanya bekerja pada enzim sistem saraf, tetapi juga dapat menargetkan enzim metabolik (misalnya CYP450) dan enzim protease dalam jaringan tertentu.
-
Antidotum (obat penawar) seperti pralidoksim (2-PAM) dikembangkan untuk mereaktivasi asetilkolinesterase yang terfosforilasi, dengan memutus ikatan kovalen fosfat–serin sebelum proses “aging” (penguatan ikatan kimia irreversibel) terjadi.
-
Protein engineering modern kini menciptakan varian enzim yang resisten terhadap organofosfat, terutama untuk aplikasi bioremediasi pestisida.
Selain itu, inhibitor ireversibel juga dimanfaatkan secara terapeutik dalam pengobatan tertentu, misalnya:
-
Aspirin (asam asetilsalisilat) bekerja dengan mengasetilasi residu serin pada enzim COX (cyclooxygenase), menghambat pembentukan prostaglandin penyebab nyeri dan inflamasi.
-
Penicillin bekerja sebagai inhibitor ireversibel enzim transpeptidase bakteri, yang berperan dalam pembentukan dinding sel — sehingga menyebabkan kematian bakteri.
Dengan demikian, meskipun berpotensi toksik, konsep inhibisi ireversibel juga menjadi dasar bagi desain obat modern dengan efek farmakologis yang diinginkan dan target enzim yang spesifik.
Ringkasan:
Inhibitor ireversibel bekerja dengan membentuk ikatan kovalen permanen pada gugus fungsi residu asam amino penting di situs aktif enzim, menyebabkan hilangnya aktivitas katalitik secara total. Contoh utama adalah senyawa organofosfat dalam gas saraf dan pestisida yang berikatan dengan residu serin pada enzim asetilkolinesterase.
Konsep ini menjelaskan dasar keracunan saraf, mekanisme kerja beberapa obat analgesik dan antibiotik, serta strategi desain inhibitor spesifik dalam bioteknologi modern.
50 Syarah (Penjelasan) Slide ke-25
Statement 1:
Reversible inhibitors: These can be washed out of the solution of enzyme by dialysis.
Terjemah Kata per Kata:
-
Reversible inhibitors → inhibitor reversibel (penghambat yang dapat dipulihkan kembali)
-
These can be washed out → zat ini dapat dicuci keluar / dihilangkan
-
of the solution of enzyme → dari larutan enzim
-
by dialysis → melalui proses dialisis
Syarah:
Inhibitor reversibel adalah jenis penghambat enzim yang berinteraksi secara sementara dengan enzim, biasanya melalui gaya non-kovalen seperti ikatan hidrogen, gaya Van der Waals, atau interaksi elektrostatik lemah. Karena ikatannya tidak permanen, inhibitor ini dapat dilepaskan dari enzim, dan aktivitas enzim dapat dipulihkan sepenuhnya setelah inhibitor dihilangkan — misalnya dengan pengenceran, pencucian, atau dialisis.
Dialisis adalah proses yang digunakan untuk memisahkan molekul kecil (seperti inhibitor) dari molekul besar (seperti protein enzim) melalui membran semi-permeabel. Jika inhibitor benar-benar reversibel, maka setelah dialisis, enzim akan kembali aktif karena molekul penghambatnya telah terpisah dari larutan.
Dengan demikian, istilah “reversible inhibitor” tidak hanya mengacu pada sifat ikatan yang lemah, tetapi juga pada kemampuan sistem biologis atau eksperimental untuk memulihkan aktivitas enzim tanpa perlu mensintesis enzim baru.
Statement 2:
There are two categories.
Terjemah Kata per Kata:
-
There are two categories → ada dua kategori
Syarah:
Secara klasik, inhibitor reversibel dibagi menjadi dua kategori utama berdasarkan mekanisme interaksinya terhadap enzim dan substrat:
-
Competitive inhibition (inhibisi kompetitif)
-
Inhibitor bersaing langsung dengan substrat untuk menempati active site enzim.
-
Karena bentuk dan muatannya mirip dengan substrat, inhibitor menempati tempat yang seharusnya digunakan substrat untuk berikatan.
-
Akibatnya, tidak terbentuk kompleks enzim–substrat, dan reaksi tertunda.
-
Namun, jika konsentrasi substrat dinaikkan, maka substrat dapat “mengalahkan” inhibitor untuk mengakses active site.
-
Contoh: Penghambatan enzim succinate dehydrogenase oleh malonate, karena struktur malonate menyerupai succinate.
-
Ciri kinetik: Nilai Vmax tetap, tetapi Km meningkat.
-
-
Noncompetitive inhibition (inhibisi nonkompetitif)
-
Inhibitor tidak berikatan pada active site, melainkan pada allosteric site (situs lain di enzim).
-
Ikatan ini menyebabkan perubahan konformasi enzim, sehingga situs aktif tidak lagi cocok untuk mengikat substrat.
-
Dalam kasus ini, peningkatan konsentrasi substrat tidak dapat mengatasi efek inhibitor, karena struktur enzimnya sendiri telah berubah.
-
Contoh: Penghambatan enzim cytochrome oxidase oleh ion sianida (CN⁻) atau karbon monoksida (CO).
-
Ciri kinetik: Nilai Vmax menurun, tetapi Km tetap.
-
Penjelasan Tambahan: Konteks Biologis dan Eksperimental
Dalam sistem biologis, inhibisi reversibel merupakan mekanisme alami pengaturan metabolisme. Sel menggunakan inhibitor jenis ini untuk mengontrol laju reaksi metabolik tanpa harus menghentikan seluruh fungsi enzim. Misalnya, pada mekanisme feedback inhibition (umpan balik negatif):
-
Produk akhir dari suatu jalur metabolisme dapat bertindak sebagai inhibitor allosterik terhadap enzim awal dalam jalur yang sama.
-
Contoh klasiknya adalah isoleusin yang menghambat enzim threonine deaminase dalam biosintesis asam amino — suatu strategi efisien untuk mencegah kelebihan produksi.
Secara eksperimental, konsep inhibitor reversibel juga sangat penting dalam penelitian farmakologi dan bioteknologi, karena banyak obat modern dirancang agar menghambat secara sementara tanpa merusak enzim target secara permanen. Misalnya:
-
Metotreksat → inhibitor kompetitif terhadap enzim dihidrofolat reduktase (DFHR), digunakan sebagai kemoterapi antikanker.
-
Allopurinol → inhibitor kompetitif terhadap xantin oksidase, digunakan untuk mengobati gout (asam urat tinggi).
-
Rivastigmine dan donepezil → inhibitor reversibel asetilkolinesterase, digunakan dalam terapi Alzheimer.
Anotasi [Pembaruan 2025]:
Menurut pendekatan enzimokinetik modern (Michaelis–Menten kinetics), efek inhibitor reversibel dapat digambarkan melalui perubahan nilai Km dan Vmax, yang memungkinkan analisis kuantitatif melalui Lineweaver–Burk plot atau Eadie–Hofstee plot.
Selain dua kategori klasik, kini dikenal juga uncompetitive inhibition, di mana inhibitor hanya mengikat kompleks enzim–substrat, bukan enzim bebas. Jenis ini mengurangi kedua nilai Km dan Vmax secara proporsional, dan menjadi salah satu indikator khas dalam analisis kinetik lanjutan.
Dalam drug design modern, konsep reversible covalent inhibitors juga diperkenalkan — inhibitor yang membentuk ikatan kovalen sementara yang dapat terurai kembali (contohnya pada desain obat antivirus dan antikanker). Pendekatan ini menjembatani keunggulan dua dunia: kekuatan ikatan seperti inhibitor ireversibel, tetapi dengan keamanan farmakologis seperti inhibitor reversibel.
Ringkasan:
Inhibitor reversibel adalah penghambat enzim yang berikatan sementara dengan enzim dan dapat dilepaskan kembali melalui dialisis atau pengenceran. Mereka dibagi menjadi dua kategori utama — kompetitif dan nonkompetitif — yang masing-masing memengaruhi parameter kinetik enzim secara berbeda.
Konsep ini sangat penting dalam memahami regulasi metabolisme alami, mekanisme kerja obat, dan strategi desain inhibitor dalam riset biomedis modern.
52 Syarah (Penjelasan) Slide ke-26
Statement 1:
Competitive: These compete with the substrate molecules for the active site.
Terjemah Kata per Kata:
-
Competitive → kompetitif
-
These compete with → zat ini bersaing dengan
-
the substrate molecules → molekul substrat
-
for the active site → untuk mendapatkan situs aktif
Syarah:
Inhibisi kompetitif terjadi ketika molekul inhibitor dan substrat memiliki kemiripan struktur (baik bentuk maupun muatan), sehingga saling bersaing untuk mengikat situs aktif enzim. Situs aktif adalah bagian dari enzim tempat substrat seharusnya berikatan dan mengalami reaksi kimia. Karena inhibitor memiliki bentuk yang menyerupai substrat, ia dapat “menipu” enzim dan menempati situs aktif sementara, membentuk kompleks enzim–inhibitor (EI).
Pada kondisi ini, enzim tidak dapat mengikat substrat, sehingga laju reaksi enzimatik menurun. Namun, karena ikatan inhibitor bersifat reversibel (dapat dilepas kembali), maka peningkatan konsentrasi substrat akan memungkinkan substrat untuk “mengalahkan” inhibitor dalam kompetisi tersebut. Dengan kata lain, efek penghambatan kompetitif dapat diatasi dengan meningkatkan jumlah substrat.
Statement 2:
The inhibitor’s action is proportional to its concentration.
Terjemah Kata per Kata:
-
The inhibitor’s action → aksi atau efek penghambat
-
is proportional to → berbanding lurus dengan
-
its concentration → konsentrasinya
Syarah:
Efek penghambatan dari inhibitor kompetitif berbanding lurus dengan konsentrasinya. Artinya, semakin tinggi jumlah inhibitor yang tersedia dalam sistem, semakin besar pula kemungkinan inhibitor untuk menempati situs aktif dibandingkan dengan substrat, sehingga laju reaksi semakin menurun. Sebaliknya, pada konsentrasi inhibitor rendah, substrat memiliki peluang lebih besar untuk berikatan dengan enzim, dan aktivitas katalitik dapat berjalan mendekati normal.
Secara kinetik, hal ini tergambar pada persamaan Michaelis–Menten, di mana nilai Km (Michaelis constant) meningkat karena dibutuhkan lebih banyak substrat untuk mencapai setengah kecepatan maksimum (½ Vmax). Namun, Vmax tidak berubah, karena pada konsentrasi substrat yang sangat tinggi, inhibitor tidak lagi efektif bersaing dengan substrat.
Statement 3:
Resembles the substrate’s structure closely.
Terjemah Kata per Kata:
-
Resembles → menyerupai
-
the substrate’s structure → struktur dari substrat
-
closely → secara sangat mirip atau dekat
Syarah:
Ciri khas inhibitor kompetitif adalah kesamaan bentuk struktural dengan substrat alami enzim. Kemiripan ini dapat berupa kesamaan pada bagian gugus fungsi, distribusi muatan listrik, atau konfigurasi spasial molekul. Hal ini memungkinkan inhibitor untuk berikatan dengan tepat pada situs aktif enzim, seolah-olah ia adalah substrat sejati.
Namun, karena inhibitor tidak dapat mengalami reaksi katalitik, maka ia hanya menghalangi akses substrat sejati ke situs aktif tanpa menghasilkan produk. Fenomena ini dikenal sebagai blocking mechanism, dan merupakan prinsip dasar dalam banyak obat-obatan modern.
Diagram Penjelas (dari slide):
Rumus reaksi yang tercantum menunjukkan mekanisme reversibel:
E+I⇌EIE + I \rightleftharpoons EIE+I⇌EI
-
E = Enzyme (enzim bebas)
-
I = Inhibitor (penghambat)
-
EI = Enzyme–Inhibitor complex (kompleks enzim–inhibitor)
-
Panah dua arah (↔) menandakan bahwa ikatan ini bersifat reversibel, yaitu inhibitor dapat berikatan dan lepas kembali dari enzim.
Penjelasan Tambahan (Konteks Biologis & Farmakologis):
-
Contoh klasik:
-
Malonate adalah inhibitor kompetitif terhadap enzim succinate dehydrogenase dalam siklus Krebs.
Struktur malonate hampir identik dengan succinate, tetapi tidak dapat dioksidasi menjadi fumarate, sehingga reaksi berhenti pada tahap ini. -
Methotrexate adalah inhibitor kompetitif terhadap dihydrofolate reductase (DHFR), enzim yang penting dalam sintesis DNA. Oleh karena itu, methotrexate digunakan sebagai obat kemoterapi untuk menghambat pembelahan sel kanker.
-
Statin (misalnya atorvastatin, simvastatin) adalah inhibitor kompetitif dari HMG-CoA reductase, yang menghambat sintesis kolesterol di hati.
-
-
Implikasi fisiologis:
Mekanisme kompetitif sering dimanfaatkan oleh tubuh untuk mengatur jalur metabolisme melalui inhibisi umpan balik (feedback inhibition). Produk akhir suatu jalur biosintesis dapat bertindak sebagai inhibitor kompetitif terhadap enzim awal jalur tersebut, menjaga keseimbangan metabolik sel. -
Analisis kinetik (pembaruan 2025):
Dalam plot Lineweaver–Burk, garis-garis dari reaksi dengan berbagai konsentrasi inhibitor berpotongan pada sumbu Y, menunjukkan bahwa Vmax tetap konstan, sementara Km meningkat.
Kajian terbaru dalam enzimokinetika kuantitatif juga memperkenalkan konsep mixed competitive inhibition, yaitu kondisi di mana inhibitor memiliki afinitas baik terhadap enzim bebas maupun kompleks enzim–substrat, memberikan efek kinetik gabungan antara kompetitif dan nonkompetitif.
Anotasi [Pembaruan 2025]:
Dalam riset bioinformatika modern, interaksi inhibitor kompetitif kini dapat diprediksi secara in silico melalui molecular docking dan virtual screening.
Perangkat lunak seperti AutoDock Vina dan PyRx memungkinkan ilmuwan memvisualisasikan energi ikatan inhibitor di situs aktif, mengidentifikasi hydrogen bond donors/acceptors, serta menentukan binding affinity (ΔG) antara inhibitor dan enzim target.
Pendekatan ini penting dalam drug repurposing — menemukan obat lama yang dapat bertindak sebagai inhibitor kompetitif baru untuk penyakit lain (misalnya TB, kanker, atau infeksi virus).
Ringkasan:
Inhibisi kompetitif terjadi ketika inhibitor bersaing dengan substrat untuk mengikat situs aktif enzim karena kemiripan strukturnya dengan substrat. Efek penghambatan ini dapat diatasi dengan menambah konsentrasi substrat, sehingga nilai Km meningkat sementara Vmax tetap.
Konsep ini menjadi landasan bagi pemahaman mekanisme regulasi enzim dalam metabolisme dan desain obat berbasis enzyme inhibition di era modern.
54 Syarah (Penjelasan) Slide ke-27
Statement utama dari slide
Reaksi kimia yang ditampilkan:
Succinate → (Succinate dehydrogenase) → Fumarate + 2H⁺ + 2e⁻
Dan di bawahnya tampak tiga struktur kimia:
-
Succinate (CH₂COOH–CH₂COOH)
-
Fumarate (CHCOOH–CHCOOH)
-
Malonate (HOOC–CH₂–COOH)
Makna Kata dan Frasa
-
Succinate → suksinat, yaitu bentuk tereduksi dari asam fumarat dalam siklus Krebs.
-
Fumarate → fumarat, bentuk teroksidasi setelah dua elektron dan dua proton dilepaskan.
-
Succinate dehydrogenase → enzim yang berfungsi mengkatalisis oksidasi suksinat menjadi fumarat (enzim ini merupakan bagian dari kompleks II rantai transpor elektron).
-
Malonate → senyawa analog (mirip struktur) dengan suksinat, yang bertindak sebagai competitive inhibitor terhadap enzim suksinat dehidrogenase.
Syarah (Penjelasan dalam format naratif)
Reaksi yang digambarkan dalam slide ini menunjukkan proses penting dalam Siklus Krebs (Citric Acid Cycle), di mana enzim suksinat dehidrogenase (SDH) mengkatalisis konversi suksinat menjadi fumarat. Reaksi ini melibatkan transfer dua elektron dan dua proton (2H⁺ + 2e⁻) ke koenzim FAD, menghasilkan FADH₂ yang kemudian berperan dalam rantai transpor elektron untuk menghasilkan energi dalam bentuk ATP.
Namun, proses ini dapat dihambat oleh senyawa malonat, yang strukturnya sangat mirip dengan suksinat. Karena kesamaan bentuk dan jarak antar gugus karboksilat (-COOH), malonat dapat berkompetisi secara langsung dengan suksinat untuk mengikat situs aktif enzim suksinat dehidrogenase. Akibatnya, malonat menempati tempat yang seharusnya digunakan oleh suksinat, tetapi tidak dapat menjalani oksidasi menjadi fumarat karena kekurangan satu gugus metilena (-CH₂) yang penting untuk reaksi tersebut.
Dengan demikian, terbentuklah kompleks enzim–malonat yang tidak produktif, dan laju reaksi berkurang drastis. Namun karena ikatan ini bersifat reversibel, penambahan konsentrasi suksinat dalam jumlah besar dapat menggeser kesetimbangan, memungkinkan suksinat “mengalahkan” malonat untuk mengakses situs aktif — sesuai dengan prinsip kompetisi kinetik yang dijelaskan dalam model Michaelis–Menten.
Analisis Mekanistik
-
Enzim yang terlibat:
-
Succinate dehydrogenase adalah satu-satunya enzim dalam siklus Krebs yang terikat pada membran dalam mitokondria.
-
Mengandung kofaktor FAD (Flavin Adenine Dinucleotide) dan Fe–S cluster yang membantu dalam transfer elektron ke ubiquinone (CoQ).
-
-
Mekanisme kompetitif:
-
Substrat asli: suksinat (HOOC–CH₂–CH₂–COOH).
-
Inhibitor: malonat (HOOC–CH₂–COOH).
-
Karena malonat kekurangan satu gugus CH₂, enzim tidak dapat mengubahnya menjadi fumarat.
-
Ikatan malonat pada situs aktif menghambat sementara aktivitas katalitik enzim tanpa merusak strukturnya.
-
-
Konsekuensi fisiologis:
-
Dalam sistem biologis, penghambatan SDH oleh malonat akan menyebabkan akumulasi suksinat dan penurunan pembentukan fumarat, sehingga menghambat seluruh siklus Krebs dan mengurangi produksi energi (ATP).
-
Eksperimen klasik menggunakan malonat digunakan untuk membuktikan keberadaan SDH dalam mitokondria dan menjelaskan mekanisme kerja inhibitor kompetitif secara biokimia.
-
Analisis Struktural (Visual dari Slide)
Struktur kimia yang ditampilkan pada slide menunjukkan:
-
Suksinat: memiliki dua gugus –CH₂ di antara dua gugus karboksilat (–COOH).
-
Fumarat: hasil oksidasi suksinat, mengandung ikatan rangkap C=C di antara gugus karboksilat.
-
Malonat: hanya memiliki satu gugus –CH₂ di antara dua gugus karboksilat, sehingga tidak dapat menjalani oksidasi menjadi fumarat.
Dengan kata lain, malonat menyerupai substrat tetapi “cacat fungsi”. Ia dapat berikatan tetapi tidak dapat bereaksi — sebuah ciri khas dari inhibitor kompetitif.
Anotasi [Pembaruan 2025]:
-
Signifikansi bioenergetik modern:
Succinate dehydrogenase kini diketahui tidak hanya berperan dalam siklus Krebs, tetapi juga dalam regulasi redoks seluler dan produksi reactive oxygen species (ROS). Inhibisi SDH oleh senyawa seperti malonat atau derivatnya digunakan dalam penelitian neuroprotektif, karena dapat mengurangi stres oksidatif berlebih pada sel saraf. -
Pemodelan in silico terkini:
Studi molecular docking menunjukkan bahwa afinitas pengikatan malonat terhadap SDH dapat dimodifikasi dengan substitusi gugus fungsional tertentu (misalnya penggantian salah satu gugus –COOH dengan –SO₃H atau –NH₂), menghasilkan inhibitor turunan yang lebih selektif. Temuan ini menjadi dasar bagi pengembangan obat antikanker dan antimikroba baru yang menargetkan jalur respirasi mitokondria patogen. -
Relevansi eksperimental:
Malonate juga digunakan dalam eksperimen toksikologi untuk meniru kondisi ischaemia/reperfusion injury di otak dan jantung, karena penghambatan SDH meniru penumpukan suksinat yang ditemukan pada jaringan yang kekurangan oksigen.
Ringkasan
Malonat merupakan inhibitor kompetitif klasik bagi enzim suksinat dehidrogenase. Ia bersaing dengan suksinat pada situs aktif karena kesamaan struktur, tetapi tidak dapat mengalami reaksi oksidasi menjadi fumarat. Akibatnya, laju reaksi berkurang, dan efeknya dapat diatasi dengan peningkatan konsentrasi suksinat.
Konsep ini tidak hanya penting untuk memahami mekanisme dasar enzimologi, tetapi juga menjadi model biologis dan farmakologis dalam studi penghambatan metabolik dan pengembangan obat berbasis inhibitor kompetitif.
56 Syarah (Penjelasan) Slide ke-28
Statement utama dari slide
-
Non-competitive: These are not influenced by the concentration of the substrate. It inhibits by binding irreversibly to the enzyme but not at the active site.
-
Examples:
-
Cyanide combines with the Iron in the enzyme cytochrome oxidase.
-
Heavy metals, Ag or Hg, combine with –SH groups.
-
These can be removed by using a chelating agent such as EDTA.
-
Makna Kata dan Frasa
-
Non-competitive → penghambatan non-kompetitif, yaitu kondisi ketika inhibitor berikatan dengan enzim pada lokasi selain situs aktif (allosteric site), sehingga tetap menghambat aktivitas katalitik meskipun substrat tersedia dalam jumlah banyak.
-
Not influenced by substrate concentration → efek penghambatan tidak dapat diatasi dengan menaikkan konsentrasi substrat.
-
Irreversibly → ikatan inhibitor bersifat kuat atau permanen, sehingga sulit atau tidak dapat dilepaskan.
-
Cytochrome oxidase → enzim mitokondria pada kompleks IV rantai transpor elektron yang bertanggung jawab terhadap transfer elektron ke oksigen.
-
–SH groups → gugus sulfhidril (thiol) dari residu sistein pada enzim yang penting untuk menjaga struktur tiga dimensi dan fungsi katalitik.
-
Chelating agent (EDTA) → senyawa pengikat ion logam (chelating) yang dapat menetralkan efek logam berat dengan membentuk kompleks stabil dan larut air.
Syarah (Penjelasan naratif mendalam)
Penghambatan non-kompetitif merupakan salah satu mekanisme regulasi enzim yang tidak terjadi pada situs aktif. Dalam mekanisme ini, inhibitor berikatan pada bagian lain dari enzim yang disebut situs alosterik, yang letaknya berbeda dari situs pengikatan substrat. Ikatan ini menyebabkan perubahan konformasi (bentuk tiga dimensi) enzim, sehingga situs aktif kehilangan kemampuan optimalnya dalam mengikat substrat atau melakukan katalisis.
Berbeda dengan inhibitor kompetitif seperti malonat pada suksinat dehidrogenase, inhibitor non-kompetitif tidak bersaing secara langsung dengan substrat. Oleh sebab itu, meskipun konsentrasi substrat ditingkatkan, laju reaksi tidak akan kembali ke nilai maksimum (Vmax). Hal ini karena jumlah enzim aktif yang tersisa telah berkurang akibat sebagian enzim terikat inhibitor secara permanen.
Salah satu contoh klasik dari penghambatan non-kompetitif adalah keracunan sianida (CN⁻). Ion sianida berikatan dengan atom besi (Fe³⁺) di dalam enzim sitosrom oksidase (cytochrome c oxidase) — enzim penting dalam kompleks IV rantai transpor elektron mitokondria. Ikatan ini menghambat transfer elektron ke oksigen, menyebabkan berhentinya respirasi seluler dan akhirnya menghambat produksi ATP. Akibatnya, jaringan tubuh mengalami hipoksia histotoksik, di mana oksigen tersedia namun tidak dapat digunakan oleh sel. Kondisi ini menyebabkan kematian dalam hitungan menit pada dosis tinggi.
Contoh lain yang diberikan adalah logam berat seperti perak (Ag⁺) dan merkuri (Hg²⁺). Kedua logam ini memiliki afinitas tinggi terhadap gugus sulfhidril (-SH) dari residu asam amino sistein. Gugus –SH ini biasanya berperan dalam menjaga struktur protein atau dalam pembentukan jembatan disulfida yang penting untuk kestabilan konformasi enzim. Ketika logam berat mengikat gugus –SH, struktur enzim berubah dan aktivitas katalitiknya hilang (denaturasi parsial atau total).
Untuk menetralkan efek logam berat, digunakan senyawa pengkelat (chelating agents) seperti EDTA (ethylenediaminetetraacetic acid). EDTA memiliki beberapa gugus donor elektron yang dapat mengikat ion logam dengan kuat, membentuk kompleks stabil yang larut air, sehingga ion logam tersebut dapat diekskresikan dari tubuh. Prinsip ini digunakan dalam terapi keracunan logam berat seperti merkuri atau timbal.
Analisis Mekanistik (Biokimia dan Energetika)
-
Lokasi ikatan inhibitor:
Inhibitor non-kompetitif berikatan di luar situs aktif, tetapi interaksi ini mengubah bentuk konformasi enzim, termasuk orientasi residu di situs aktif. Akibatnya, substrat mungkin masih dapat berikatan, tetapi reaksi katalitik tidak dapat berlangsung. -
Efek kinetik terhadap parameter Michaelis–Menten:
-
Nilai Km (konstanta Michaelis) tidak berubah karena afinitas enzim terhadap substrat tetap sama.
-
Nilai Vmax menurun, karena jumlah total enzim aktif berkurang akibat sebagian enzim telah terinaktivasi oleh inhibitor.
-
-
Contoh mekanisme spesifik:
-
Sianida (CN⁻): berikatan dengan Fe³⁺ dalam heme a₃ enzim cytochrome oxidase.
-
Hg²⁺: membentuk ikatan kovalen dengan gugus –SH dari residu sistein dalam berbagai enzim metabolik, seperti gliseraldehida-3-fosfat dehidrogenase (enzim dalam glikolisis).
-
Analisis Struktural dan Fungsional
Pada tingkat struktural, ikatan inhibitor non-kompetitif menimbulkan distorsi alosterik, yang mengubah posisi atom penting dalam situs aktif, termasuk residu katalitik seperti histidin, serin, atau aspartat. Gangguan ini menyebabkan energi aktivasi meningkat kembali (tidak terjadi penurunan energi aktivasi seperti pada kondisi normal), sehingga reaksi menjadi tidak efisien.
Dari sisi fisiologis, penghambatan non-kompetitif bersifat lebih berbahaya dibanding kompetitif, karena pengikatan inhibitor sering bersifat irreversibel dan merusak fungsi vital enzim.
Anotasi [Pembaruan 2025]
-
Relevansi toksikologi modern:
Penghambatan non-kompetitif menjadi dasar bagi banyak mekanisme toksisitas logam berat. Studi terbaru menunjukkan bahwa paparan kronis terhadap logam seperti Hg²⁺, Cd²⁺, dan Pb²⁺ dapat menginduksi stres oksidatif dan disfungsi mitokondria melalui inaktivasi enzim yang mengandung –SH dan Fe–S cluster. -
Relevansi farmakologis:
Beberapa obat modern juga menggunakan prinsip non-competitive allosteric inhibition, misalnya:-
Ketoconazole dan fluconazole menghambat cytochrome P450 pada fungi.
-
Memantine menghambat reseptor NMDA pada otak secara non-kompetitif (terapi Alzheimer).
Hal ini menunjukkan bahwa konsep yang awalnya bersifat toksik kini dapat dimanfaatkan secara terapeutik jika dikendalikan secara selektif.
-
-
Inovasi dalam penelitian enzimologi:
Penelitian mutakhir menggunakan pendekatan molecular dynamics simulation mengungkapkan bahwa inhibitor non-kompetitif dapat bekerja dengan menstabilkan konformasi inaktif enzim, bukan hanya dengan menutup situs aktif. Hal ini membuka peluang dalam desain obat yang menargetkan allosteric pocket secara spesifik.
Ringkasan
Inhibitor non-kompetitif berikatan dengan enzim pada situs selain situs aktif, menyebabkan perubahan konformasi yang menghambat aktivitas katalitik. Efek ini tidak dapat diatasi dengan peningkatan konsentrasi substrat. Contohnya meliputi sianida yang mengikat Fe pada cytochrome oxidase, serta logam berat seperti Ag⁺ dan Hg²⁺ yang bereaksi dengan gugus –SH. Walaupun berbahaya, prinsip penghambatan non-kompetitif kini dimanfaatkan dalam desain obat-obatan allosterik modern.
58 Syarah (Penjelasan) Slide ke-29
Isi utama slide
-
Negative feedback: end point or end product inhibition
-
Poisons: snake bite, plant alkaloids and nerve gases
-
Medicine: antibiotics, sulphonamides, sedatives and stimulants
Makna kata dan frasa
-
Inhibitors → zat penghambat yang menurunkan atau menghentikan aktivitas enzim.
-
Negative feedback → umpan balik negatif; mekanisme pengaturan di mana produk akhir (end product) dari suatu reaksi biokimia menghambat enzim pada tahap awal jalur tersebut, untuk menjaga keseimbangan metabolik.
-
End product inhibition → penghambatan oleh produk akhir; istilah lain untuk negative feedback inhibition.
-
Poisons → racun biologis atau kimia yang menghambat kerja enzim vital, seperti enzim pernapasan seluler.
-
Plant alkaloids → senyawa alami basa nitrogen dari tumbuhan (misalnya morfin, atropin, nikotin) yang memiliki aktivitas penghambatan enzim atau reseptor.
-
Nerve gases → gas saraf (seperti sarin, soman, VX) yang merupakan inhibitor enzim acetylcholinesterase, menyebabkan kelumpuhan sistem saraf.
-
Sulphonamides → antibiotik sintetis pertama (misalnya sulfadiazine), bekerja sebagai kompetitif inhibitor terhadap enzim dalam sintesis asam folat bakteri.
-
Sedatives dan stimulants → obat penenang dan perangsang yang memodulasi aktivitas enzim atau neurotransmiter (misalnya monoamine oxidase atau MAO).
Syarah (Penjelasan mendalam)
Enzim inhibitor memiliki peranan luas dalam biologi, toksikologi, dan kedokteran, bukan hanya sebagai racun, tetapi juga sebagai alat regulasi alami maupun bahan terapeutik modern. Slide ini menyoroti tiga konteks utama aplikasi inhibitor, yaitu dalam regulasi metabolisme (negative feedback), dalam toksikologi (poisons), dan dalam farmakologi (medicine).
1. Negative Feedback (End Product Inhibition)
Dalam sel hidup, tidak semua jalur metabolisme dibiarkan berjalan tanpa kendali. Tubuh memiliki mekanisme cerdas untuk menjaga homeostasis biokimia dengan cara menonaktifkan enzim secara sementara ketika produk akhir sudah mencukupi.
Sebagai contoh klasik, pada biosintesis isoleusin dari treonin di dalam bakteri E. coli, enzim pertama pada jalur tersebut — treonine deaminase — dihambat oleh isoleusin sebagai produk akhir. Ketika konsentrasi isoleusin meningkat, ia akan menempel pada situs alosterik enzim treonine deaminase, mengubah konformasi enzim dan menurunkan aktivitasnya.
Mekanisme ini disebut negative feedback inhibition karena produk akhir “memberi umpan balik” untuk menghentikan jalannya reaksi yang menghasilkannya sendiri. Konsep ini sangat penting dalam pengaturan sintesis asam amino, hormon, dan nukleotida di semua organisme.
2. Poisons (Racun Enzimatik)
Banyak racun biologis bekerja dengan menghambat enzim-enzim vital, sehingga mengganggu proses biokimia yang esensial bagi kehidupan.
-
Gigitan ular (snake venom) sering mengandung enzim phospholipase A₂, protease, atau neurotoxin yang menghambat transmisi sinyal saraf dengan memblokir reseptor asetilkolin atau kanal ion, menyebabkan kelumpuhan otot.
-
Plant alkaloids seperti atropin, nikotin, dan morfin mempengaruhi sistem saraf dengan cara menghambat atau meniru aktivitas enzim dan reseptor tertentu. Misalnya, atropin bersifat antagonis terhadap reseptor muskarinik asetilkolin, sementara nikotin dapat mengikat reseptor nikotinik dan mengganggu homeostasis saraf.
-
Nerve gases seperti sarin (GB), soman (GD), dan VX adalah inhibitor kuat enzim acetylcholinesterase (AChE). Enzim ini bertugas menguraikan neurotransmiter asetilkolin di celah sinaptik. Jika AChE terhambat, asetilkolin menumpuk, menyebabkan kontraksi otot terus-menerus, gagal napas, dan kematian. Inhibisi oleh senyawa ini bersifat irreversibel karena membentuk ikatan kovalen dengan residu serin di situs aktif AChE.
3. Medicine (Aplikasi dalam bidang kedokteran dan farmasi)
Dalam bidang farmakologi modern, inhibitor digunakan secara terkontrol dan selektif untuk mengobati penyakit tertentu. Prinsip kerja obat-obatan modern sering kali didasarkan pada penghambatan spesifik terhadap enzim target yang berperan dalam patogenesis suatu penyakit.
-
Antibiotics: bekerja dengan menghambat enzim spesifik bakteri. Misalnya, penisilin menghambat enzim transpeptidase yang membentuk ikatan silang pada dinding sel bakteri.
-
Sulphonamides: inhibitor kompetitif terhadap enzim dihydropteroate synthase pada jalur sintesis asam folat di bakteri. Karena manusia tidak mensintesis asam folat (mendapatkannya dari makanan), inhibitor ini selektif terhadap bakteri tanpa mengganggu sel manusia.
-
Sedatives dan stimulants: bekerja melalui penghambatan atau aktivasi enzim neurotransmiter. Misalnya, inhibitor monoamine oxidase (MAOIs) meningkatkan kadar dopamin dan serotonin di otak, digunakan untuk terapi depresi.
-
Chemotherapeutic inhibitors: seperti methotrexate, menghambat dihydrofolate reductase, sehingga menghambat sintesis DNA pada sel kanker.
Analisis Mekanistik dan Molekuler
-
Feedback inhibition melibatkan ikatan reversibel pada situs alosterik. Produk akhir bertindak sebagai “sensor metabolik” yang menurunkan efisiensi enzim upstream tanpa menghentikan total aktivitasnya, memastikan sistem tetap fleksibel terhadap perubahan kebutuhan sel.
-
Racun (poisons) bekerja secara irreversibel dengan membentuk ikatan kovalen atau kompleks logam-enzim yang stabil.
-
Obat (medicinal inhibitors) sering dirancang secara struktur analog (structure-based design) agar menyerupai substrat alami namun tidak dapat diproses oleh enzim, menyebabkan efek penghambatan spesifik dan terkendali.
Anotasi [Pembaruan 2025]
-
Perluasan konsep inhibitor alami dan sintetis
Studi modern menunjukkan bahwa banyak senyawa bioaktif tumbuhan (flavonoid, polifenol, terpenoid) berfungsi sebagai modulator enzim alami, misalnya quercetin sebagai inhibitor tyrosinase (antioksidan dan pencerah kulit), atau resveratrol sebagai inhibitor cyclooxygenase (COX) (antiinflamasi alami). -
Inhibitor dalam terapi presisi (precision medicine)
Teknologi modern seperti AI-driven drug discovery dan molecular docking memungkinkan identifikasi inhibitor spesifik terhadap target enzim manusia dan patogen, termasuk desain allosteric inhibitors yang lebih selektif dibanding inhibitor kompetitif klasik. -
Negative feedback di era bioteknologi
Dalam rekayasa genetika, prinsip end-product inhibition kini dimanipulasi untuk meningkatkan produksi metabolit sekunder (misalnya antibiotik atau asam amino) dengan cara menonaktifkan gen penghambat feedback. Ini menjadi strategi kunci dalam metabolic engineering dan synthetic biology.
Ringkasan Syarah
Slide ini menunjukkan bahwa inhibitor tidak selalu bersifat merusak, tetapi justru memiliki peran sentral dalam mengatur, melindungi, dan menyembuhkan.
-
Dalam biologi, inhibitor menjaga keseimbangan metabolik melalui mekanisme feedback inhibition.
-
Dalam toksikologi, racun seperti sianida, gas saraf, dan logam berat menunjukkan potensi mematikan melalui penghambatan enzim vital.
-
Dalam kedokteran, prinsip penghambatan enzim dimanfaatkan secara terapeutik untuk mengobati infeksi, kanker, gangguan saraf, hingga penyakit metabolik.
Dengan demikian, konsep inhibitor menjembatani pemahaman antara mekanisme biokimia dasar dan penerapannya dalam dunia medis dan industri farmasi.
60 Syarah (Penjelasan) Slide ke-30
1. Konsep Dasar Reaksi Kimia dan Energi Aktivasi
Semua reaksi kimia, baik yang terjadi di laboratorium maupun di dalam sel hidup, membutuhkan energi awal untuk memulai prosesnya. Energi awal ini disebut energi aktivasi (activation energy). Energi ini berfungsi untuk melemahkan ikatan dalam molekul reaktan sehingga dapat bereaksi membentuk produk baru.
Selama proses ini, molekul-molekul reaktan berada dalam kondisi tidak stabil yang disebut keadaan transisi (transition state). Keadaan ini bersifat sementara dan membutuhkan energi yang cukup tinggi agar reaksi dapat berlanjut menuju pembentukan produk yang lebih stabil.
2. Jalur Reaksi dan Energi Bebas
Jika digambarkan dalam grafik (reaction pathway), energi bebas reaktan akan meningkat terlebih dahulu hingga mencapai puncak energi aktivasi, lalu menurun drastis setelah produk terbentuk.
-
Reaktan (Reactants) → energi awal.
-
Transition state → titik puncak energi aktivasi.
-
Produk (Products) → energi akhir yang lebih rendah dibanding reaktan, menandakan reaksi bersifat eksergonik (melepaskan energi).
Semakin tinggi energi aktivasi yang diperlukan, semakin lambat reaksi berlangsung. Oleh karena itu, organisme hidup memerlukan enzim untuk menurunkan energi aktivasi tanpa menaikkan suhu sistem.
3. Percepatan Reaksi oleh Enzim
Peningkatan suhu memang mempercepat reaksi kimia karena molekul bergerak lebih cepat dan peluang tumbukan meningkat. Namun, sistem biologis sangat sensitif terhadap suhu — suhu tinggi dapat merusak protein.
Enzim berfungsi sebagai katalis biologis, yaitu molekul (biasanya protein) yang mempercepat reaksi dengan cara menurunkan energi aktivasi tanpa mengubah suhu dan tanpa ikut habis bereaksi.
Dengan demikian, enzim menciptakan jalur reaksi alternatif (new reaction pathway) yang lebih singkat dan lebih efisien dibandingkan reaksi kimia non-enzimatik.
4. Enzim dan Jalur Reaksi Terkatalisis
Dalam reaksi terkatalisis enzim, energi aktivasi jauh lebih rendah dibandingkan reaksi tanpa enzim.
-
Tanpa enzim: reaksi lambat karena energi aktivasi tinggi.
-
Dengan enzim: reaksi berlangsung jutaan hingga miliaran kali lebih cepat (10⁸–10¹¹ kali lipat).
Enzim bertindak sebagai “pemandu reaksi” yang mengarahkan reaktan menuju keadaan transisi dengan energi minimum.
5. Struktur Enzim
Enzim adalah protein globular kompleks dengan struktur tiga dimensi (3D) yang sangat spesifik. Bentuk globular ini memungkinkan terbentuknya situs aktif (active site) — area kecil dalam struktur enzim tempat substrat berikatan.
Contohnya adalah human pancreatic amylase, enzim pencernaan yang mengubah pati menjadi maltosa. Struktur enzim terdiri atas lipatan α-heliks dan β-sheet yang membentuk rongga reaktif di mana reaksi berlangsung.
6. Situs Aktif dan Lingkungan Kimia
Situs aktif merupakan bagian paling penting dari enzim karena:
-
Memiliki bentuk (shape) spesifik yang sesuai dengan substrat.
-
Memiliki lingkungan kimia (chemical environment) yang unik, misalnya keasaman atau gugus fungsional tertentu, yang memfasilitasi reaksi kimia.
Interaksi antara enzim dan substrat bersifat spesifik dan reversibel, membentuk kompleks enzim-substrat (enzyme-substrate complex).
7. Kofaktor dan Koenzim
Tidak semua enzim dapat bekerja sendiri. Beberapa memerlukan bantuan molekul non-protein yang disebut kofaktor.
-
Kofaktor → molekul tambahan non-protein yang membantu aktivitas enzim.
-
Jika kofaktor terikat kuat → disebut kelompok prostetik (prosthetic group).
-
Jika mudah lepas dan terikat kembali → disebut koenzim (coenzyme).
Banyak vitamin berperan sebagai koenzim, contohnya vitamin B-kompleks. Sebagai ilustrasi, enzim nitrogenase memerlukan kofaktor Fe, Mo, dan ADP untuk fungsinya dalam fiksasi nitrogen.
8. Substrat dan Spesifisitas Enzim
Substrat adalah reaktan spesifik yang diubah oleh enzim menjadi produk. Setiap enzim bersifat spesifik terhadap substratnya, artinya hanya substrat dengan bentuk dan sifat kimia yang sesuai dapat dikenali oleh situs aktif enzim.
Spesifisitas ini ditentukan oleh bentuk tiga dimensi situs aktif, yang berfungsi seperti kunci yang hanya cocok untuk gembok tertentu.
9. Hipotesis Lock and Key
Model “Lock and Key Hypothesis” menjelaskan bahwa enzim dan substrat berinteraksi secara pas sempurna, layaknya kunci dan gembok.
-
Enzim = kunci
-
Substrat = anak kunci
Ketika substrat masuk ke situs aktif, terbentuk kompleks enzim-substrat. Setelah reaksi berlangsung, produk dengan bentuk berbeda dilepaskan, dan enzim dapat digunakan kembali.
Model ini menjelaskan spesifisitas enzim dan hilangnya aktivitas akibat denaturasi, karena perubahan bentuk enzim akan membuat “kunci” tidak lagi pas dengan “gembok”.
10. Hipotesis Induced Fit
Model yang lebih modern, “Induced Fit Hypothesis”, menyatakan bahwa enzim tidak selalu memiliki bentuk situs aktif yang kaku. Sebaliknya, ketika substrat mendekat, enzim berubah bentuk sedikit (konformasi) agar sesuai dengan substrat.
Perubahan ini:
-
Membentuk lingkungan kimia yang optimal bagi reaksi.
-
Menegangkan ikatan pada substrat, sehingga lebih mudah putus.
-
Menurunkan energi aktivasi secara signifikan.
Contohnya, enzim hexokinase akan menutup sebagian situs aktifnya saat berikatan dengan glukosa, memastikan reaksi fosforilasi berlangsung efisien.
11. Faktor-Faktor yang Mempengaruhi Aktivitas Enzim
Aktivitas enzim dapat dipengaruhi oleh berbagai faktor, di antaranya:
a. Konsentrasi Substrat
-
Dalam reaksi non-enzimatik, peningkatan konsentrasi substrat menyebabkan peningkatan kecepatan reaksi secara linier.
-
Dalam reaksi enzimatik, kecepatan meningkat cepat di awal, tetapi akhirnya mencapai titik jenuh (Vmax) ketika seluruh enzim terikat substrat. Setelah itu, penambahan substrat tidak mempercepat reaksi lagi.
b. pH
Setiap enzim memiliki pH optimum di mana aktivitasnya paling tinggi.
-
Enzim pepsin (di lambung) bekerja optimal pada pH asam (sekitar 2).
-
Enzim trypsin (di usus) bekerja optimal pada pH basa (sekitar 8).
Perubahan pH yang ekstrem menyebabkan denaturasi, yaitu perubahan struktur tiga dimensi enzim, sehingga situs aktifnya rusak dan tidak dapat mengikat substrat.
c. Suhu (Temperature)
-
Pada kenaikan suhu moderat (10°C), laju reaksi meningkat 2–3 kali lipat (Q10).
-
Namun, suhu tinggi akan menyebabkan denaturasi protein.
-
Sebagian besar enzim manusia bekerja optimal pada sekitar 30–40°C, sedangkan bakteri termofilik dapat bertahan hingga 100°C.
12. Inhibitor Enzim
Inhibitor adalah senyawa kimia yang mengurangi laju reaksi enzimatik.
-
Bekerja dengan cara menghambat pembentukan kompleks enzim-substrat.
-
Umumnya spesifik dan efektif pada konsentrasi rendah.
-
Tidak selalu merusak enzim secara permanen.
Contohnya: banyak obat-obatan dan racun bekerja sebagai inhibitor enzim di sistem saraf.
13. Jenis-Jenis Inhibitor
a. Irreversible Inhibitors
Bergabung secara permanen dengan gugus fungsional enzim (misalnya residu serin) di situs aktif.
Contoh: gas saraf dan pestisida organofosfat yang menghambat acetylcholinesterase, menyebabkan kegagalan transmisi impuls saraf.
b. Reversible Inhibitors
Terikat sementara dan dapat dilepaskan, misalnya dengan dialisis.
Terdapat dua tipe utama:
-
Competitive inhibitors → bersaing dengan substrat untuk situs aktif. Biasanya mirip struktur kimianya dengan substrat (contoh: malonat menghambat succinate dehydrogenase).
-
Non-competitive inhibitors → mengikat enzim di lokasi lain (allosteric site), mengubah bentuk situs aktif. Contoh: sianida (mengikat Fe pada cytochrome oxidase), dan logam berat seperti Ag atau Hg yang berikatan dengan gugus –SH.
14. Aplikasi Inhibitor
Inhibitor memiliki peran penting dalam berbagai bidang:
-
Negative feedback → mekanisme pengendalian metabolisme alami, di mana produk akhir menghambat enzim pertama dalam jalur biosintesisnya.
-
Poisons → berbagai racun (bisa ular, gas saraf, dan alkaloid) menghambat enzim penting dalam sistem saraf atau respirasi.
-
Medicine → obat-obatan seperti antibiotik, sulfonamida, dan antidepresan bekerja sebagai inhibitor spesifik terhadap enzim target, menjadikannya dasar farmakoterapi modern.
🧩 Kesimpulan Umum
Enzim adalah biokatalis esensial yang memungkinkan kehidupan berlangsung pada suhu dan kondisi fisiologis yang normal. Mereka bekerja dengan:
-
Menurunkan energi aktivasi,
-
Memfasilitasi pembentukan keadaan transisi,
-
Menentukan arah dan kecepatan reaksi biokimia secara selektif.
Aktivitas enzim dikendalikan oleh faktor-faktor internal (struktur, kofaktor, pH, suhu) dan eksternal (inhibitor, konsentrasi substrat).
Pemahaman mendalam tentang mekanisme kerja enzim dan penghambatnya (inhibitor) telah membuka jalan bagi kemajuan dalam bidang bioteknologi, farmakologi, dan rekayasa metabolik — dari terapi penyakit hingga rekayasa industri berbasis enzim.