© Tim Dosen Biokimia (Biologi, FMIPA, Universitas Negeri Surabaya)
2 Syarah (Penjelasan) Slide ke-1 (Cover)
Slide ini berfungsi sebagai slide judul untuk topik "Karbohidrat" dalam mata kuliah Biokimia yang disusun oleh Tim Biokimia dari Jurusan Biologi, FMIPA, Universitas Negeri Surabaya (UNESA).
Karbohidrat adalah salah satu makromolekul utama yang menjadi sumber energi utama bagi makhluk hidup. Istilah "karbohidrat" berasal dari dua kata, yaitu "karbo" yang merujuk pada unsur karbon (C) dan "hidrat" yang berasal dari kata hidrogen (H) dan oksigen (O), yang menyiratkan bahwa struktur dasar karbohidrat terdiri dari karbon yang berikatan dengan hidrogen dan oksigen dalam rasio tertentu, biasanya mendekati perbandingan 2:1 seperti dalam molekul air (H₂O).
Dalam konteks biokimia, karbohidrat memainkan peran vital dalam metabolisme seluler. Karbohidrat dapat diklasifikasikan menjadi tiga kelompok utama berdasarkan kompleksitas strukturnya, yaitu:
-
Monosakarida – merupakan unit dasar atau molekul gula tunggal seperti glukosa, fruktosa, dan galaktosa.
-
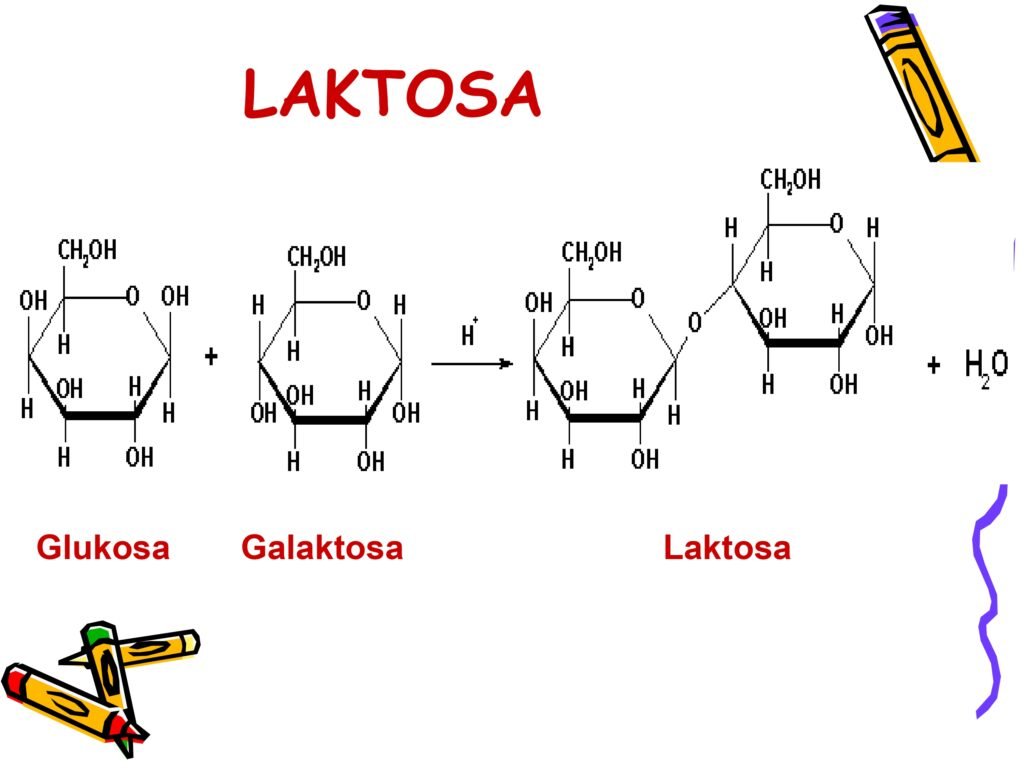
Disakarida – merupakan kombinasi dua monosakarida, seperti sukrosa (glukosa + fruktosa) dan laktosa (glukosa + galaktosa).
-
Polisakarida – merupakan polimer kompleks yang terdiri dari banyak monosakarida, seperti pati, glikogen, dan selulosa.
Karbohidrat merupakan bagian esensial dalam metabolisme karena berfungsi sebagai sumber energi utama melalui jalur metabolisme seperti glikolisis, siklus asam sitrat (siklus Krebs), dan rantai transpor elektron. Selain sebagai sumber energi, karbohidrat juga memiliki fungsi struktural, misalnya dalam pembentukan dinding sel tumbuhan (selulosa) dan matriks ekstraseluler (glikosaminoglikan). Karbohidrat juga berperan dalam proses pengenalan sel, sebagai bagian dari glikoprotein dan glikolipid pada permukaan sel.
4 Syarah (Penjelasan) Slide ke-2
Slide ini menjelaskan tentang struktur dasar karbohidrat dan bagaimana karbohidrat dapat diklasifikasikan berdasarkan kelompok fungsional yang dikandungnya, yaitu aldehid atau keton.
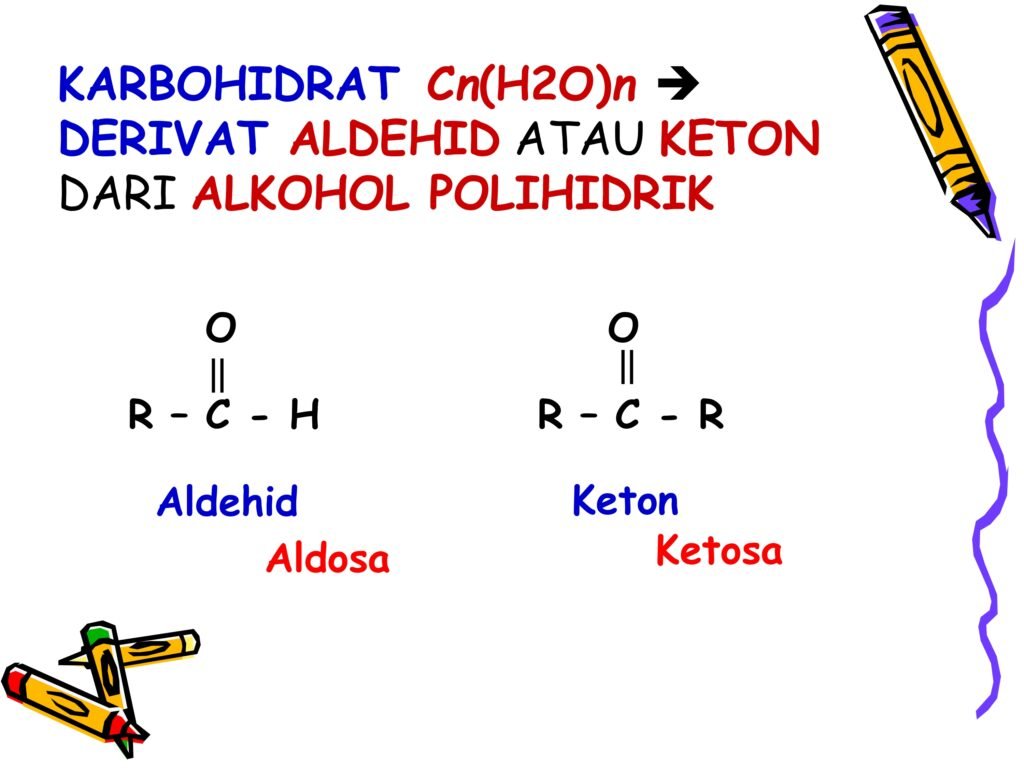
Karbohidrat secara umum memiliki rumus molekul dasar Cₙ(H₂O)ₙ, yang menunjukkan bahwa karbohidrat terdiri dari karbon (C), hidrogen (H), dan oksigen (O) dalam perbandingan yang menyerupai air (H₂O). Hal ini menjadi dasar mengapa senyawa ini disebut sebagai karbohidrat (karbo = karbon, hidrat = air).
Karbohidrat pada dasarnya merupakan derivat (turunan) dari aldehid atau keton yang berasal dari alkohol polihidrik (senyawa yang memiliki lebih dari satu gugus hidroksil -OH). Berikut adalah penjelasan tentang aldehid dan keton dalam konteks karbohidrat:
-
Aldehid
Struktur aldehid ditunjukkan dalam bentuk:O=C−H\text{O} = \text{C} - \text{H}O=C−H
Gugus aldehid terdiri dari atom karbon (C) yang terikat dengan oksigen (O) melalui ikatan rangkap dan terikat dengan satu atom hidrogen (H). Karbohidrat yang mengandung gugus aldehid ini disebut sebagai aldosa.
-
Contoh aldosa yang umum adalah glukosa, galaktosa, dan manosa.
-
Aldosa memiliki sifat pereduksi karena gugus aldehidnya mudah teroksidasi menjadi gugus karboksil (-COOH).
-
-
Keton
Struktur keton ditunjukkan dalam bentuk:O=C−R\text{O} = \text{C} - \text{R}O=C−R
Gugus keton terdiri dari atom karbon (C) yang berikatan rangkap dengan oksigen (O) dan berikatan dengan dua gugus alkil atau aril (R). Karbohidrat yang mengandung gugus keton disebut sebagai ketosa.
-
Contoh ketosa yang umum adalah fruktosa.
-
Ketosa kurang reaktif dibandingkan aldosa karena gugus keton tidak mudah teroksidasi secara langsung.
-
Kaitan dengan Alkohol Polihidrik
Karbohidrat adalah polihidroksi aldehid atau polihidroksi keton karena selain memiliki gugus aldehid atau keton, mereka juga memiliki banyak gugus hidroksil (-OH). Gugus hidroksil ini menyebabkan karbohidrat memiliki sifat polar dan larut dalam air karena dapat membentuk ikatan hidrogen dengan molekul air.
Implikasi dalam Biokimia
Karbohidrat yang berperan dalam metabolisme sel, seperti glukosa (aldosa) dan fruktosa (ketosa), akan masuk ke dalam jalur metabolisme melalui proses seperti glikolisis dan siklus Krebs. Aldosa dan ketosa memiliki perbedaan dalam hal reaktivitas enzimatik dan jalur metabolisme yang dilalui. Sebagai contoh:
-
Glukosa (aldosa) cenderung dikatabolisme melalui jalur glikolisis.
-
Fruktosa (ketosa) memerlukan fosforilasi awal sebelum masuk ke jalur glikolisis.
6 Syarah (Penjelasan) Slide ke-3
Slide ini menyajikan contoh spesifik dari dua jenis karbohidrat berdasarkan gugus fungsional yang dikandungnya, yaitu aldosa dan ketosa. Pemahaman tentang perbedaan struktural antara aldosa dan ketosa sangat penting karena keduanya memiliki jalur metabolisme dan fungsi biologis yang berbeda.
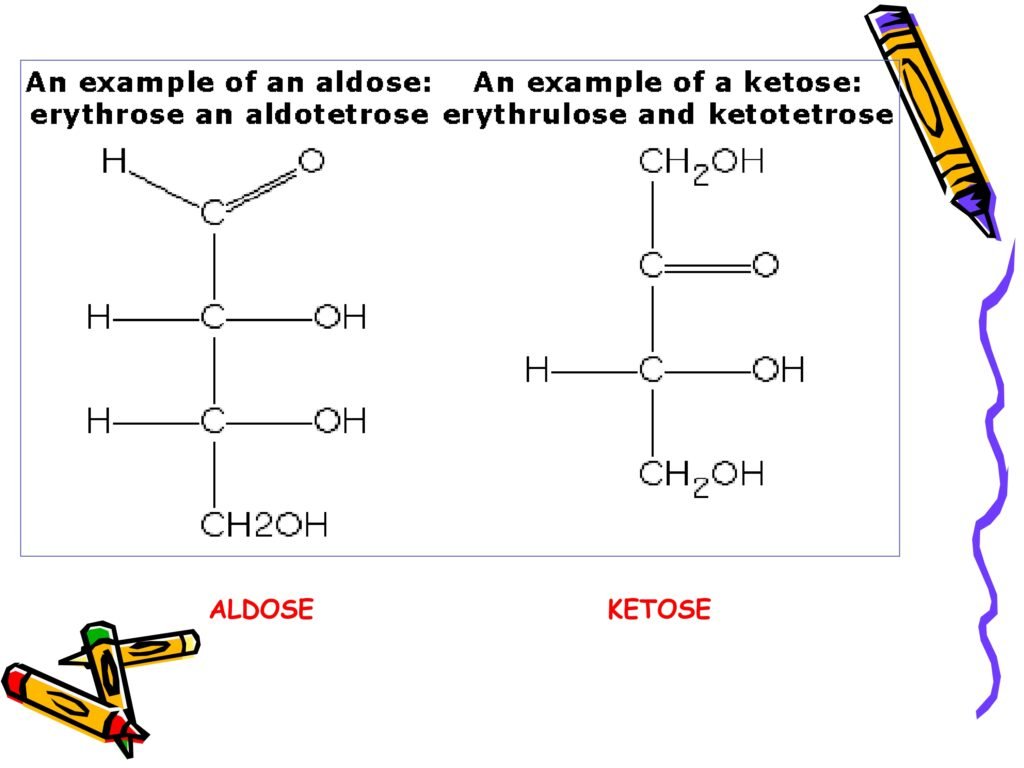
1. An example of an aldose: Erythrose (an aldotetrose)
Pada bagian kiri slide ditunjukkan struktur kimia dari erythrose, yang merupakan contoh dari aldosa dengan 4 atom karbon (tetrose).
-
Istilah example berarti contoh.
-
Aldose adalah karbohidrat yang memiliki gugus aldehid (-CHO) pada posisi ujung molekul.
-
Erythrose adalah anggota dari kelompok aldotetrose, yaitu aldosa dengan 4 atom karbon dalam rantai utamanya.
-
Gugus aldehid pada erythrose ditandai dengan keberadaan gugus karbonil (C=O) yang berikatan dengan satu atom hidrogen (H).
-
Rumus kimia erythrose adalah C₄H₈O₄.
Dalam konteks metabolisme, erythrose merupakan prekursor dalam jalur jalur pentosa fosfat (pentose phosphate pathway, PPP), yang berperan dalam produksi NADPH dan pembentukan ribosa yang penting dalam sintesis nukleotida.
2. An example of a ketose: Erythrulose (a ketotetrose)
Pada bagian kanan slide ditunjukkan struktur kimia dari erythrulose, yang merupakan contoh dari ketosa dengan 4 atom karbon (tetrose).
-
Example berarti contoh.
-
Ketose adalah karbohidrat yang memiliki gugus keton (C=O) yang terletak di posisi kedua dari ujung rantai karbon.
-
Erythrulose adalah anggota dari kelompok ketotetrose, yaitu ketosa dengan 4 atom karbon dalam rantai utamanya.
-
Gugus keton pada erythrulose terletak di posisi karbon kedua dari rantai utama.
-
Rumus kimia erythrulose adalah C₄H₈O₄ (sama seperti erythrose, namun posisi gugus karbonil berbeda).
Erythrulose memiliki kepentingan biologis dalam konteks metabolisme dan reaksi biokimia tertentu. Dalam kosmetik, erythrulose juga digunakan sebagai agen penggelap kulit (self-tanning) karena mampu bereaksi dengan asam amino pada lapisan kulit untuk menghasilkan warna cokelat alami.
Perbedaan utama antara Aldose dan Ketose
-
Aldosa memiliki gugus aldehid pada posisi ujung dari rantai karbon.
-
Ketosa memiliki gugus keton pada posisi kedua dari rantai karbon.
-
Dalam metabolisme, aldosa dan ketosa memiliki jalur metabolisme yang berbeda. Misalnya:
-
Glukosa (aldosa) adalah sumber utama energi melalui jalur glikolisis.
-
Fruktosa (ketosa) harus diubah terlebih dahulu menjadi glukosa atau diubah menjadi senyawa antara dalam jalur glikolisis sebelum dimetabolisme lebih lanjut.
-
8 Syarah (Penjelasan) Slide ke-4
Slide ini berfokus pada identifikasi tipe karbohidrat berdasarkan keberadaan gugus fungsionalnya, apakah merupakan aldosa atau ketosa. Pemahaman tentang struktur ini penting karena mempengaruhi reaktivitas dan jalur metabolisme yang akan dilalui oleh karbohidrat tersebut dalam tubuh. Mari kita analisis satu per satu senyawa yang disajikan dalam slide ini:
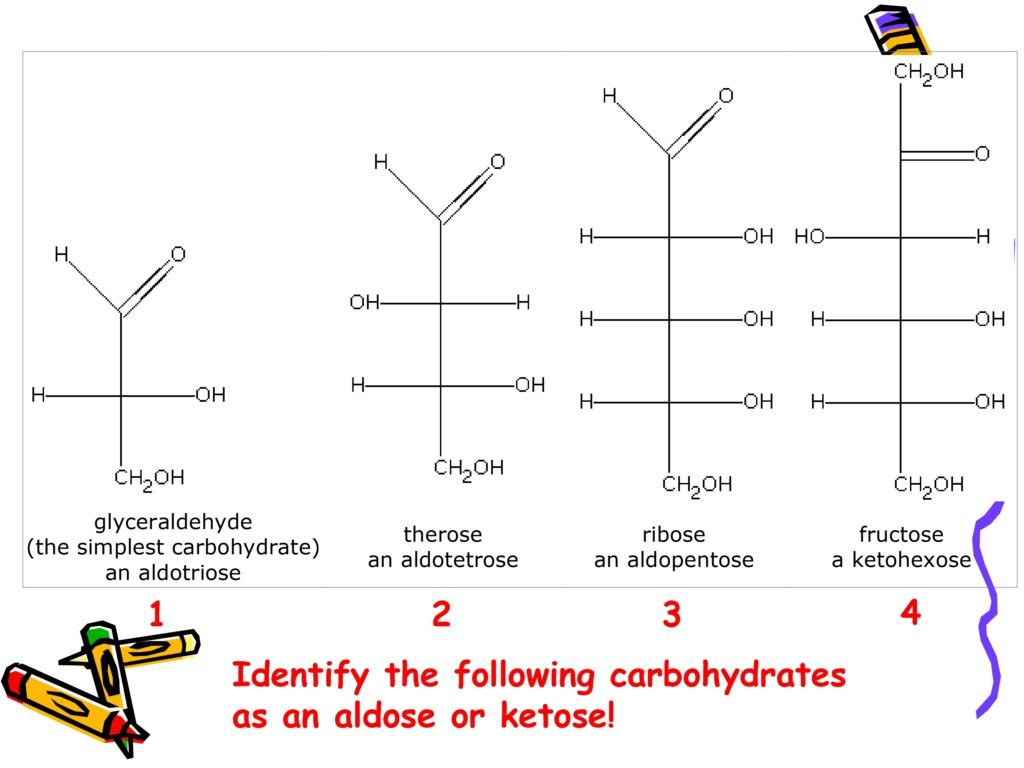
1. Glyceraldehyde (the simplest carbohydrate) – an aldotriose
-
Glyceraldehyde adalah karbohidrat paling sederhana yang termasuk ke dalam golongan aldosa karena mengandung gugus aldehid (-CHO) di posisi karbon pertama (ujung rantai).
-
Nama "aldotriose" berasal dari:
-
"Aldo" → menunjukkan adanya gugus aldehid.
-
"Triose" → menunjukkan bahwa senyawa ini memiliki tiga atom karbon (C₃H₆O₃).
-
-
Glyceraldehyde adalah prekursor penting dalam jalur metabolisme glikolisis dan jalur pentosa fosfat.
-
Dalam bentuk stereoisomer, terdapat D-glyceraldehyde dan L-glyceraldehyde, di mana bentuk D-glyceraldehyde lebih banyak ditemukan dalam sistem biologis.
👉 Kesimpulan: Glyceraldehyde adalah aldosa karena memiliki gugus aldehid pada karbon pertama.
2. Threose – an aldotetrose
-
Threose adalah karbohidrat dengan empat atom karbon, sehingga masuk dalam golongan tetrose.
-
Kehadiran gugus aldehid (-CHO) di ujung rantai menunjukkan bahwa senyawa ini merupakan aldosa.
-
Threose termasuk dalam golongan aldotetrose, yang berarti mengandung empat karbon dengan gugus aldehid sebagai gugus fungsional utama.
-
Threose berperan dalam jalur metabolisme tertentu dan dapat berperan sebagai prekursor dalam pembentukan gula lainnya.
👉 Kesimpulan: Threose adalah aldosa karena memiliki gugus aldehid pada ujung rantai karbon.
3. Ribose – an aldopentose
-
Ribose adalah karbohidrat yang terdiri dari lima atom karbon (pentosa).
-
Gugus aldehid pada posisi karbon pertama menunjukkan bahwa ribose termasuk dalam kelompok aldosa.
-
Ribose adalah komponen utama dalam asam ribonukleat (RNA) dan juga merupakan bagian dari nukleotida seperti ATP (adenosin trifosfat), NADH, dan FADH₂.
-
Ribosa memiliki konfigurasi stereoisomer dalam bentuk D-ribose yang merupakan bentuk aktif secara biologis.
👉 Kesimpulan: Ribose adalah aldosa karena memiliki gugus aldehid pada karbon pertama.
4. Fructose – a ketohexose
-
Fruktosa adalah karbohidrat dengan enam atom karbon (hexose).
-
Fruktosa memiliki gugus keton (-C=O) yang terletak pada karbon kedua dari rantai utama.
-
Hal ini menjadikan fruktosa sebagai ketosa.
-
Fruktosa adalah gula yang banyak ditemukan dalam buah-buahan dan madu.
-
Dalam metabolisme, fruktosa dapat diubah menjadi glukosa atau senyawa antara dalam jalur glikolisis melalui fosforilasi awal oleh enzim fruktokinase.
👉 Kesimpulan: Fruktosa adalah ketosa karena memiliki gugus keton pada posisi karbon kedua.
Pola Umum yang Dapat Dipahami:
-
Aldosa → Memiliki gugus aldehid (-CHO) di posisi karbon pertama.
-
Ketosa → Memiliki gugus keton (-C=O) di posisi karbon kedua.
-
Karbohidrat dapat diklasifikasikan lebih lanjut berdasarkan jumlah karbon:
-
Triose → 3 karbon (contoh: glyceraldehyde)
-
Tetrose → 4 karbon (contoh: threose)
-
Pentose → 5 karbon (contoh: ribose)
-
Hexose → 6 karbon (contoh: glukosa dan fruktosa)
-
10 Syarah (Penjelasan) Slide ke-5
Slide ini meminta untuk mengidentifikasi tipe karbohidrat berdasarkan:
-
Jumlah atom karbon – apakah termasuk tetrosa (4 karbon), pentosa (5 karbon), atau heksosa (6 karbon).
-
Gugus fungsional – apakah termasuk aldosa atau ketosa berdasarkan keberadaan gugus aldehid (-CHO) atau gugus keton (C=O).
Mari kita analisis dua struktur yang disajikan dalam slide ini:
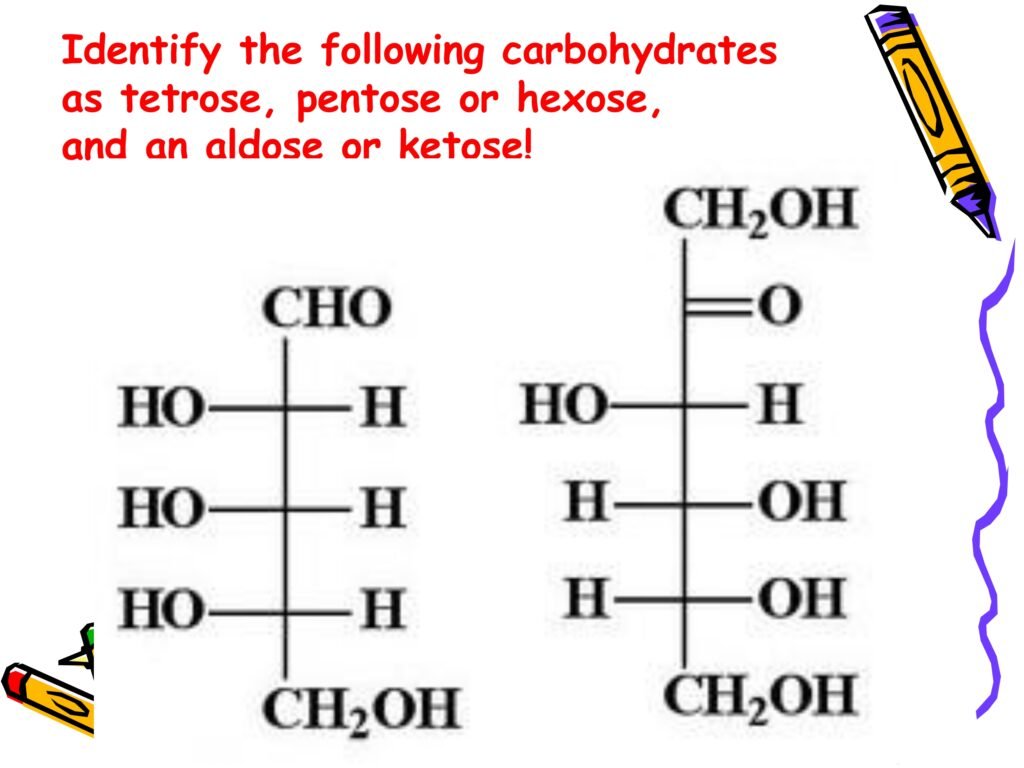
1. Struktur di Sebelah Kiri
-
Pada struktur ini, terdapat 6 atom karbon (dapat dihitung dari rantai utama).
-
Gugus karbonil (C=O) terletak di posisi pertama dari rantai karbon dan berikatan dengan atom hidrogen (H), sehingga menunjukkan bahwa ini adalah gugus aldehid.
-
Karbohidrat yang memiliki gugus aldehid disebut sebagai aldosa.
-
Karena memiliki 6 atom karbon, maka karbohidrat ini termasuk heksosa.
👉 Karbohidrat ini adalah aldoheksosa (contoh yang paling umum adalah glukosa).
2. Struktur di Sebelah Kanan
-
Pada struktur ini, terdapat 6 atom karbon (dapat dihitung dari rantai utama).
-
Gugus karbonil (C=O) terletak di posisi kedua, yang berarti ini adalah gugus keton.
-
Karbohidrat yang memiliki gugus keton disebut sebagai ketosa.
-
Karena memiliki 6 atom karbon, maka karbohidrat ini termasuk heksosa.
👉 Karbohidrat ini adalah ketoheksosa (contoh yang paling umum adalah fruktosa).
Jawaban untuk Pertanyaan di Slide:
-
Struktur kiri → Aldosa dan heksosa → Aldoheksosa (contohnya glukosa)
-
Struktur kanan → Ketosa dan heksosa → Ketoheksosa (contohnya fruktosa)
Perbedaan Kunci antara Aldosa dan Ketosa:
-
Aldosa memiliki gugus aldehid (-CHO) di ujung rantai.
-
Ketosa memiliki gugus keton (-C=O) di posisi kedua rantai.
-
Keduanya memiliki sifat metabolik yang berbeda:
-
Aldosa seperti glukosa langsung masuk ke dalam jalur glikolisis.
-
Ketosa seperti fruktosa memerlukan enzim tambahan (seperti fruktokinase) untuk masuk ke jalur metabolisme.
-
12 Syarah (Penjelasan) Slide ke-6
Slide ini menjelaskan tentang fungsi utama karbohidrat dalam sistem biologis, yang dapat diklasifikasikan menjadi dua peran utama, yaitu sebagai sumber energi dan sebagai komponen struktural. Karbohidrat merupakan makromolekul yang memiliki peran sentral dalam metabolisme dan fungsi seluler. Penjelasan terperinci mengenai dua fungsi utama tersebut adalah sebagai berikut:
1. Bahan Bakar (Sumber Energi)
Karbohidrat adalah sumber energi utama bagi organisme hidup karena dapat dipecah melalui jalur metabolisme menjadi ATP (adenosin trifosfat), yang merupakan mata uang energi seluler. Karbohidrat yang berperan sebagai sumber energi meliputi:
-
Glukosa
Glukosa adalah monosakarida utama yang digunakan dalam metabolisme energi melalui proses glikolisis. Dalam glikolisis, glukosa (C₆H₁₂O₆) dipecah menjadi dua molekul asam piruvat (C₃H₄O₃) yang kemudian memasuki siklus asam sitrat (siklus Krebs) untuk menghasilkan ATP, NADH, dan FADH₂ yang digunakan dalam rantai transpor elektron untuk menghasilkan energi dalam bentuk ATP.
➡️ Reaksi utama dalam glikolisis adalah:
Glukosa+2ADP+2Pi+2NAD+→2Piruvat+2ATP+2NADH+2H+\text{Glukosa} + 2 \text{ADP} + 2 \text{Pi} + 2 \text{NAD}^+ \rightarrow 2 \text{Piruvat} + 2 \text{ATP} + 2 \text{NADH} + 2 \text{H}^+Glukosa+2ADP+2Pi+2NAD+→2Piruvat+2ATP+2NADH+2H+
-
Glikogen
Glikogen adalah polisakarida yang berperan sebagai cadangan energi dalam sel hewan dan manusia. Glikogen terutama disimpan di hati dan otot rangka. Saat kadar glukosa darah turun, glikogen akan dipecah melalui proses glikogenolisis untuk melepaskan glukosa ke dalam darah.
➡️ Reaksi utama dalam glikogenolisis adalah:
Glikogen+nPi→nGlukosa-1-fosfat\text{Glikogen} + n \text{P}_{i} \rightarrow n \text{Glukosa-1-fosfat}Glikogen+nPi→nGlukosa-1-fosfat
Dalam tubuh manusia, energi yang dihasilkan dari glikolisis adalah sekitar 2 ATP per molekul glukosa. Jika glukosa masuk ke dalam siklus Krebs dan rantai transpor elektron, total energi yang dihasilkan dapat mencapai 30–32 ATP.
👉 Implikasi Biologis:
-
Glukosa adalah sumber energi utama bagi sel saraf dan otot.
-
Ketika kadar glukosa rendah, tubuh memanfaatkan glikogen yang disimpan di hati dan otot untuk menjaga keseimbangan metabolik.
-
Jika simpanan glikogen habis, tubuh akan mulai memecah lemak dan protein untuk menghasilkan energi.
2. Bahan Penyusun Struktur Sel
Karbohidrat juga berperan sebagai komponen struktural penting dalam sel dan jaringan. Beberapa karbohidrat utama yang berperan dalam struktur seluler meliputi:
-
Selulosa
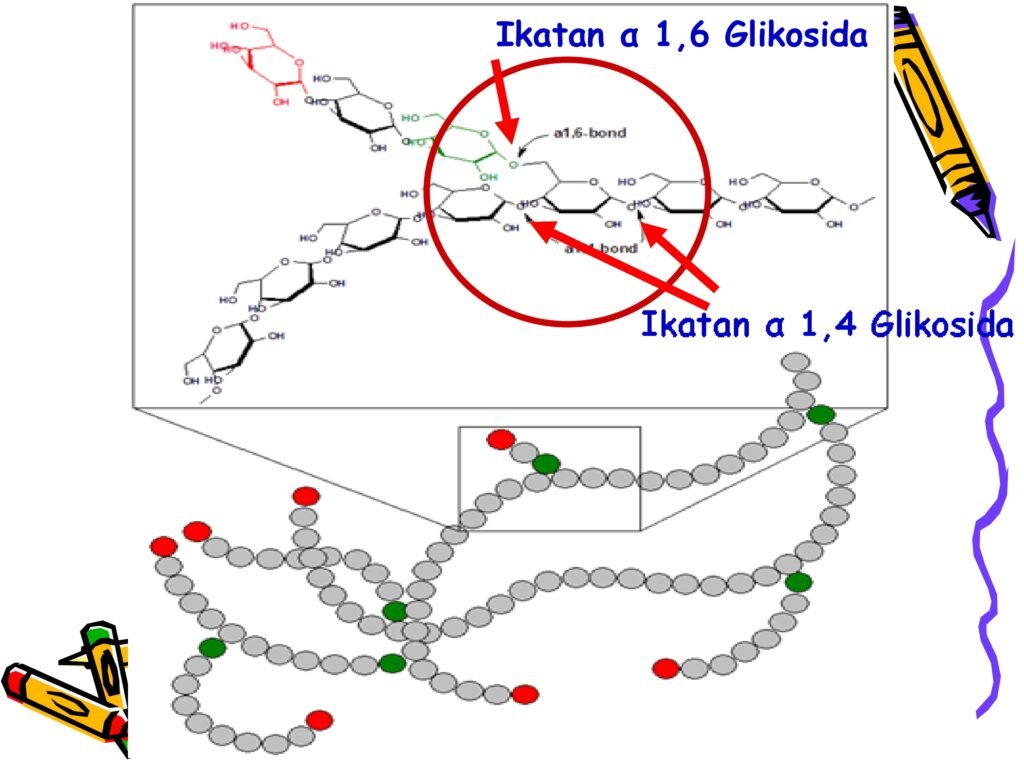
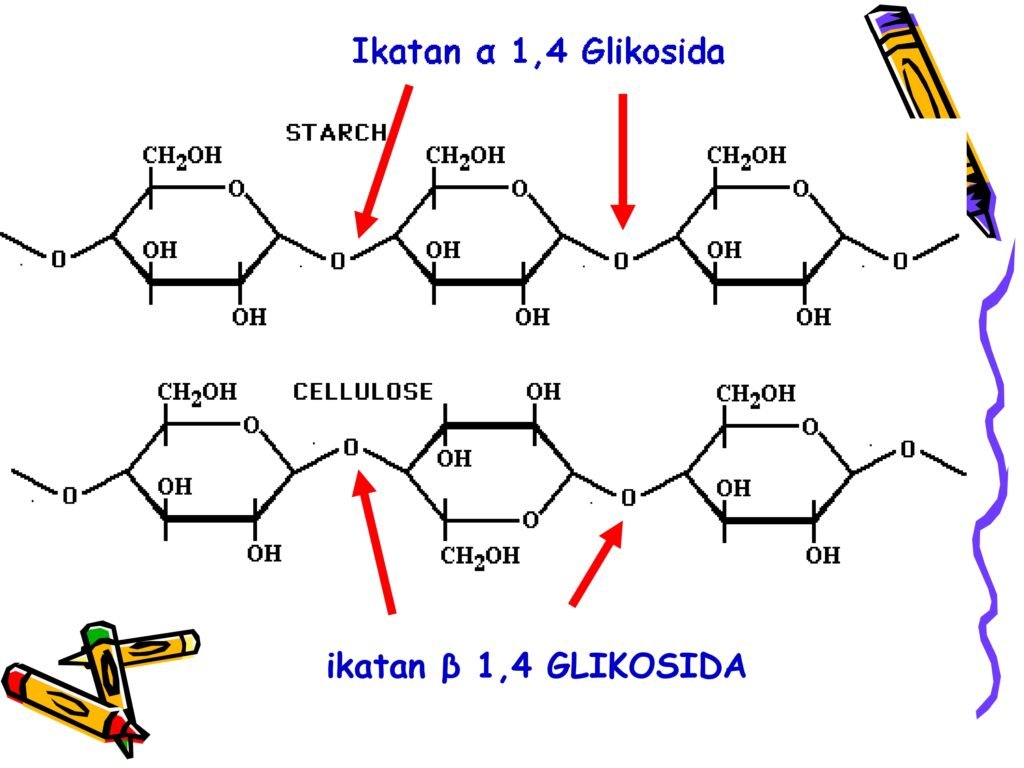
Selulosa adalah polisakarida yang tersusun dari unit-unit β-D-glukosa yang dihubungkan oleh ikatan β(1→4)-glikosidik. Selulosa adalah komponen utama dinding sel tumbuhan dan memberikan kekuatan mekanis pada sel tumbuhan.
➡️ Selulosa tidak dapat dicerna oleh manusia karena tidak memiliki enzim selulase untuk memecah ikatan β-glikosidik. Namun, hewan ruminansia seperti sapi memiliki mikroba dalam rumen yang menghasilkan enzim selulase untuk memecah selulosa menjadi glukosa. -
Kitin
Kitin adalah polisakarida yang tersusun dari N-asetilglukosamin (GlcNAc) yang dihubungkan oleh ikatan β(1→4)-glikosidik. Kitin adalah komponen struktural utama dalam eksoskeleton serangga dan dinding sel jamur.
➡️ Kitin memiliki struktur yang kuat dan tahan terhadap degradasi karena ikatan β-glikosidik dan gugus amina memberikan kestabilan tambahan. -
Pektin
Pektin adalah polisakarida yang terdiri dari asam galakturonat dan ditemukan dalam dinding sel tumbuhan. Pektin berfungsi untuk memberikan kekuatan dan fleksibilitas pada jaringan tumbuhan.
➡️ Pektin juga berperan dalam proses pematangan buah karena dapat mengatur tekstur dan konsistensi dinding sel.
👉 Implikasi Biologis:
-
Selulosa memberikan struktur dan perlindungan pada sel tumbuhan dari tekanan osmotik dan kekeringan.
-
Kitin melindungi serangga dan jamur dari serangan fisik dan mikroba.
-
Pektin menjaga integritas jaringan pada tumbuhan dan memberikan tekstur tertentu pada buah yang sudah matang.
Analisis dan Koreksi Berdasarkan Literatur Terbaru:
-
Selulosa → Selulosa tidak dapat dicerna oleh manusia karena tubuh manusia tidak memiliki enzim selulase. Namun, serat selulosa penting untuk kesehatan sistem pencernaan karena dapat meningkatkan pergerakan usus dan mempercepat waktu transit makanan dalam saluran pencernaan.
-
Kitin → Kitin tidak hanya ditemukan dalam eksoskeleton serangga, tetapi juga ditemukan dalam dinding sel fungi dan beberapa alga.
-
Pektin → Pektin memiliki peran penting dalam proses pengawetan dan pembuatan jeli karena mampu membentuk gel dengan ion kalsium (Ca²⁺).
Kesimpulan:
Karbohidrat memiliki dua fungsi utama dalam sistem biologis:
-
Sebagai sumber energi melalui glukosa dan glikogen yang dapat dipecah untuk menghasilkan ATP dalam jalur metabolisme.
-
Sebagai penyusun struktur sel melalui selulosa, kitin, dan pektin yang memberikan kekuatan mekanik dan perlindungan bagi sel.
👉 Glukosa dan glikogen → Sumber energi utama dalam tubuh.
👉 Selulosa, kitin, dan pektin → Berperan dalam mempertahankan struktur dan fungsi sel.
14 Syarah (Penjelasan) Slide ke-7
Slide ini menjelaskan penggolongan karbohidrat berdasarkan jumlah satuan penyusunnya. Karbohidrat dapat diklasifikasikan menjadi empat kelompok utama, yaitu monosakarida, disakarida, oligosakarida, dan polisakarida. Penggolongan ini didasarkan pada jumlah unit monosakarida yang menyusun struktur dasar karbohidrat. Pemahaman tentang penggolongan ini penting untuk memahami bagaimana karbohidrat disintesis, dipecah, dan dimanfaatkan dalam metabolisme sel. Berikut adalah penjelasan rinci dari masing-masing kelompok:
1. Monosakarida (Terbentuk dari 1 satuan penyusun)
Monosakarida adalah karbohidrat paling sederhana yang terdiri dari satu unit gula. Monosakarida merupakan blok penyusun utama dari disakarida, oligosakarida, dan polisakarida.
-
Rumus umum monosakarida adalah (CH₂O)ₙ.
-
Monosakarida dapat diklasifikasikan berdasarkan:
-
Jumlah atom karbon → triose (3 karbon), tetrose (4 karbon), pentose (5 karbon), dan heksosa (6 karbon).
-
Jenis gugus fungsi → aldosa (memiliki gugus aldehid) atau ketosa (memiliki gugus keton).
-
Contoh monosakarida:
-
Glukosa → aldoheksosa, merupakan sumber energi utama dalam metabolisme.
-
Fruktosa → ketoheksosa, banyak ditemukan dalam buah-buahan dan madu.
-
Galaktosa → aldoheksosa, berperan dalam pembentukan laktosa (gula susu).
-
Ribosa → aldopentosa, merupakan komponen utama dalam RNA dan ATP.
👉 Implikasi Biologis:
-
Monosakarida adalah bentuk karbohidrat yang paling mudah diserap oleh usus dan langsung digunakan dalam metabolisme.
-
Glukosa adalah monosakarida utama yang digunakan sebagai sumber energi dalam jalur glikolisis.
2. Disakarida (Terbentuk dari 2 satuan penyusun)
Disakarida adalah karbohidrat yang terdiri dari dua unit monosakarida yang dihubungkan oleh ikatan glikosidik. Proses sintesis disakarida melibatkan reaksi kondensasi (pelepasan molekul air), sedangkan pemecahannya melalui hidrolisis (penambahan molekul air).
Contoh disakarida:
-
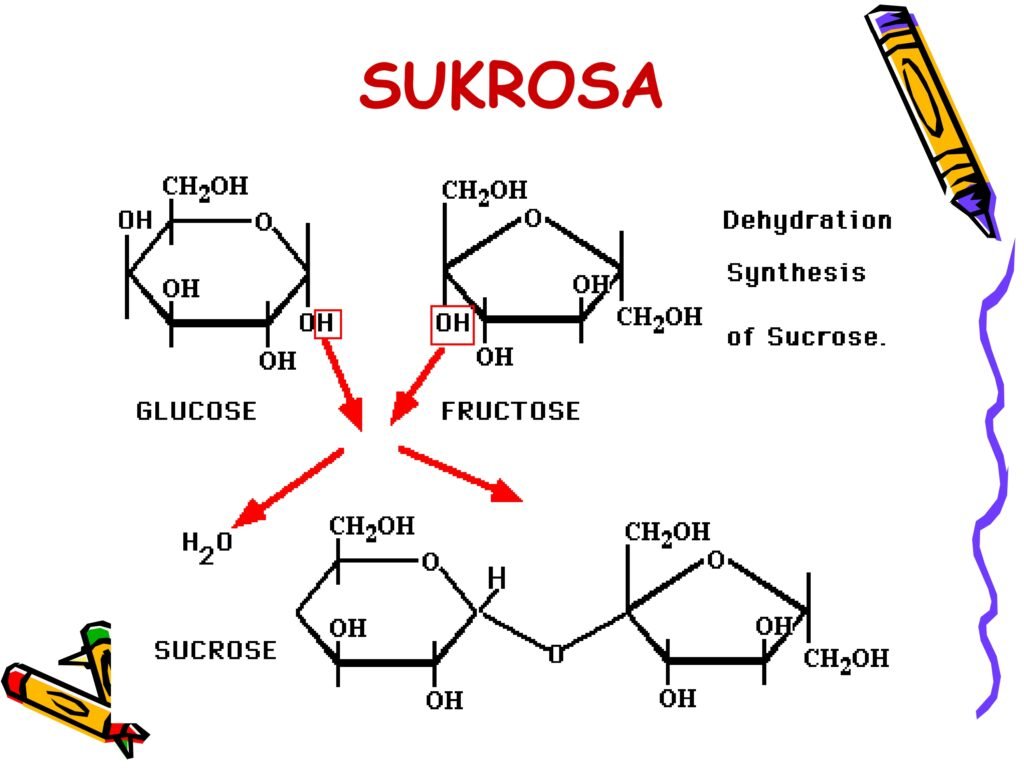
Sukrosa → glukosa + fruktosa (gula tebu)
-
Laktosa → glukosa + galaktosa (gula susu)
-
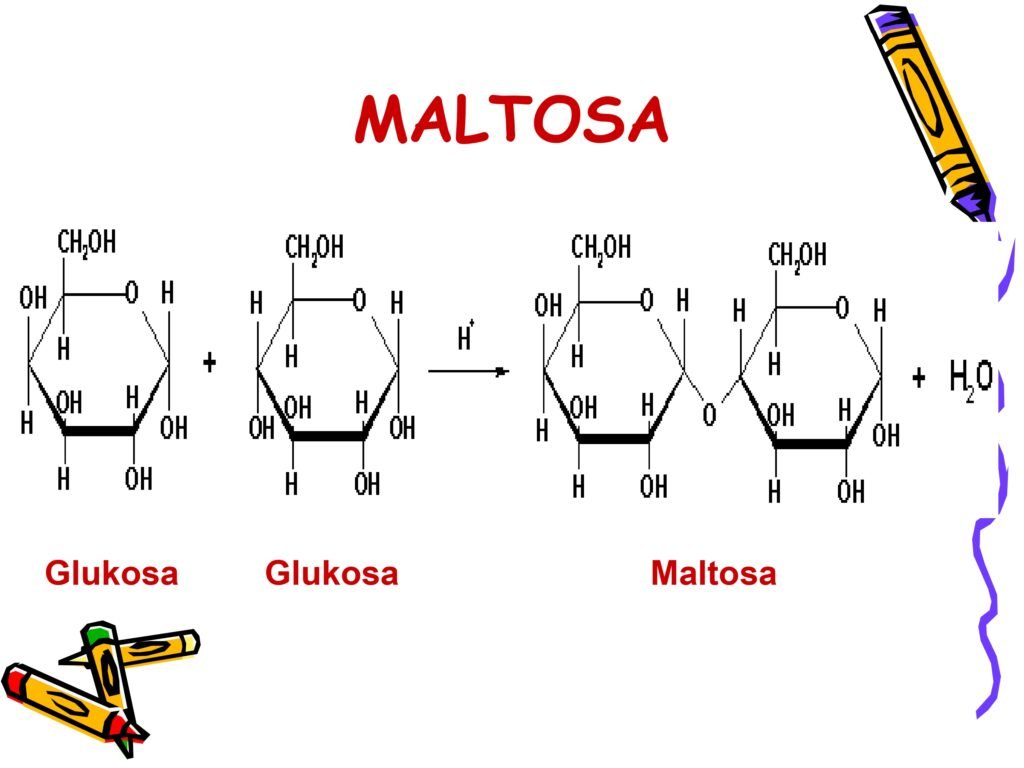
Maltosa → glukosa + glukosa (hasil pemecahan pati)
👉 Implikasi Biologis:
-
Sukrosa adalah sumber utama energi dalam makanan.
-
Laktosa dapat dipecah oleh enzim laktase di usus halus, tetapi pada individu dengan intoleransi laktosa, enzim ini tidak diproduksi dalam jumlah cukup.
-
Maltosa dihasilkan dari pemecahan pati melalui kerja enzim amilase.
3. Oligosakarida (Terbentuk dari 3–6 satuan penyusun)
Oligosakarida adalah karbohidrat yang terdiri dari 3–6 unit monosakarida yang dihubungkan oleh ikatan glikosidik. Oligosakarida sering ditemukan dalam membran sel dan berperan dalam pengenalan sel dan respons imun.
Contoh oligosakarida:
-
Rafinosa → terdiri dari galaktosa + glukosa + fruktosa.
-
Stakiosa → terdiri dari dua molekul galaktosa + glukosa + fruktosa.
👉 Implikasi Biologis:
-
Oligosakarida dalam membran sel berperan sebagai glikoprotein dan glikolipid yang memungkinkan pengenalan sel dan interaksi antar sel.
-
Rafinosa dan stakiosa ditemukan dalam kacang-kacangan dan sayuran. Oligosakarida ini dapat menyebabkan fermentasi di usus karena manusia tidak memiliki enzim untuk mencerna oligosakarida kompleks ini.
4. Polisakarida (Terbentuk dari >6 satuan penyusun)
Polisakarida adalah polimer karbohidrat yang terdiri dari lebih dari 6 unit monosakarida yang dihubungkan oleh ikatan glikosidik. Polisakarida dapat dibagi menjadi dua kelompok utama:
-
Polisakarida penyimpan energi → dapat dipecah menjadi unit glukosa untuk digunakan sebagai energi.
-
Polisakarida struktural → berperan sebagai komponen penyusun sel dan jaringan.
Contoh polisakarida:
-
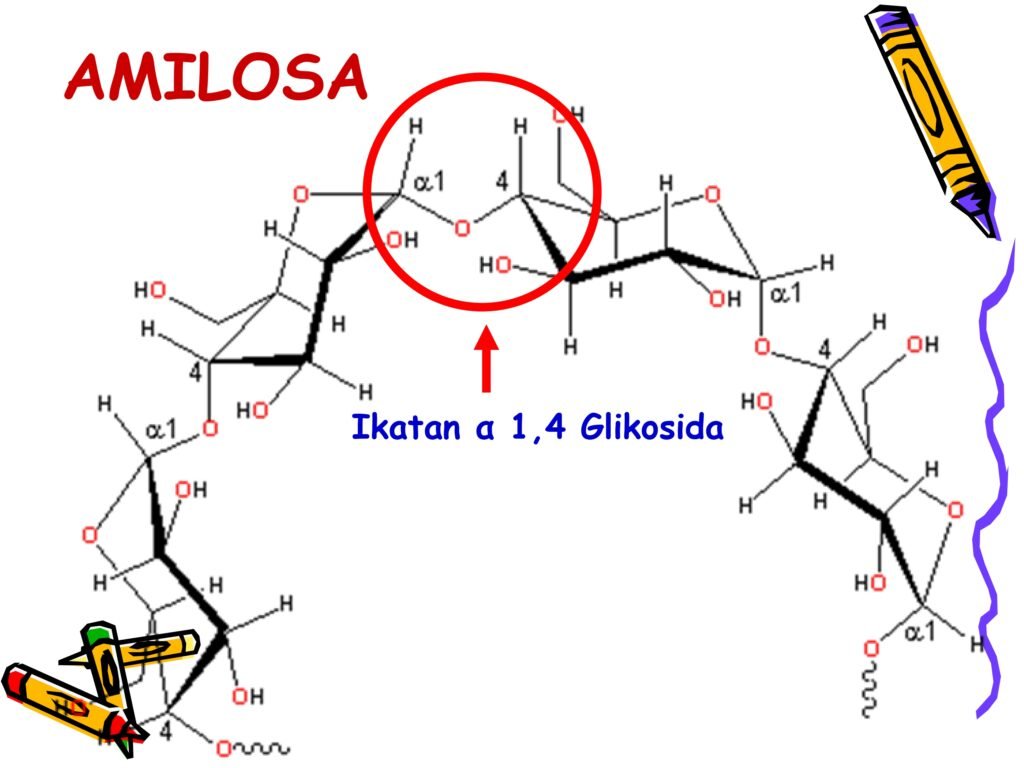
Amilum (pati) → polisakarida penyimpan energi utama pada tumbuhan.
-
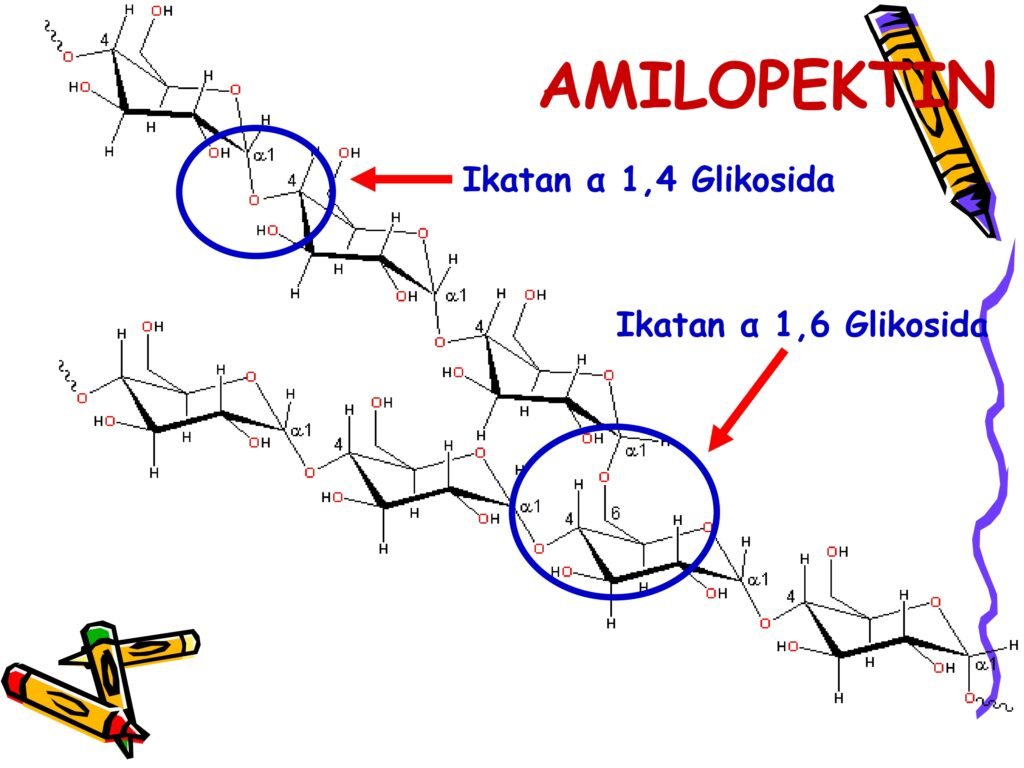
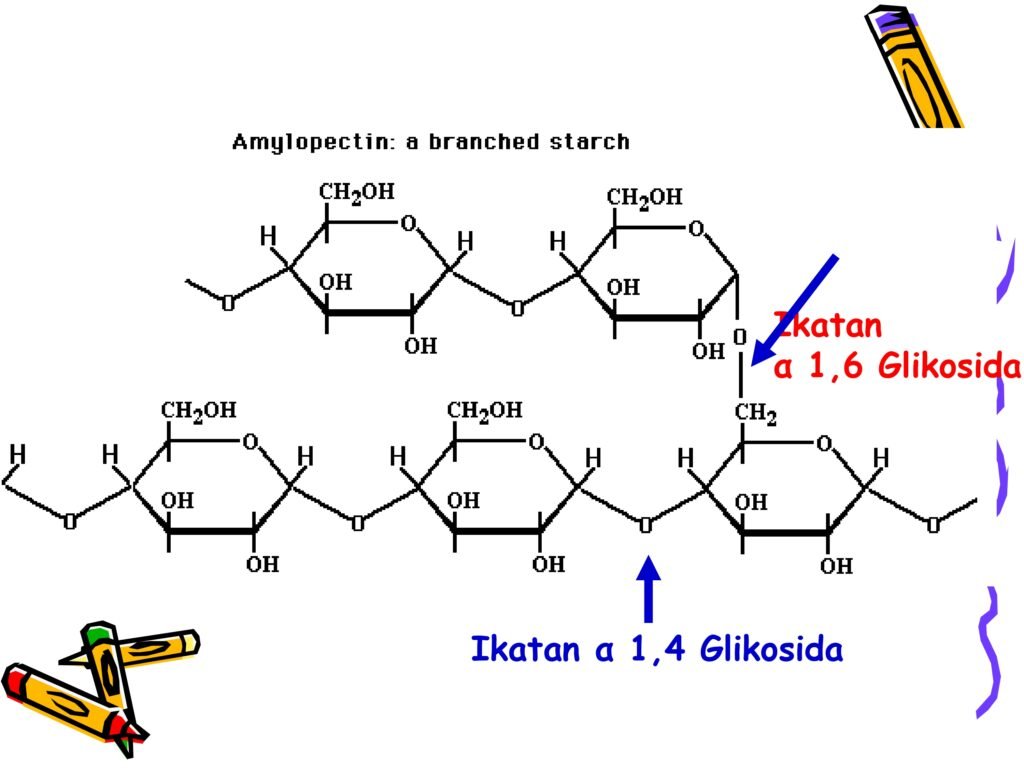
Glikogen → polisakarida penyimpan energi utama pada hewan.
-
Selulosa → polisakarida struktural utama dalam dinding sel tumbuhan.
-
Kitin → polisakarida penyusun eksoskeleton serangga dan dinding sel fungi.
👉 Implikasi Biologis:
-
Polisakarida penyimpan energi dapat dipecah melalui proses glikogenolisis atau amilolisis untuk menghasilkan glukosa sebagai bahan bakar metabolisme.
-
Polisakarida struktural seperti selulosa dan kitin memberikan kekuatan mekanik dan perlindungan bagi sel dan jaringan.
Perbedaan Kunci antar Kelas Karbohidrat:
| Kelas Karbohidrat | Satuan Penyusun | Peran dalam Metabolisme |
|---|---|---|
| Monosakarida | 1 | Sumber energi utama (glukosa, fruktosa) |
| Disakarida | 2 | Sumber energi cepat (sukrosa, laktosa) |
| Oligosakarida | 3–6 | Pengenalan sel dan respons imun |
| Polisakarida | >6 | Penyimpan energi (amilum, glikogen) dan struktur sel (selulosa, kitin) |
Anotasi Tambahan:
-
Monosakarida adalah bentuk paling sederhana dan satu-satunya yang dapat langsung diserap oleh usus.
-
Disakarida memerlukan enzim spesifik untuk dipecah sebelum diserap (misalnya: enzim laktase untuk laktosa).
-
Oligosakarida terlibat dalam interaksi seluler dan proses imunologi.
-
Polisakarida memiliki struktur kompleks yang memungkinkan penyimpanan energi jangka panjang dan memberikan kekuatan mekanik pada sel.
Kesimpulan:
Slide ini menjelaskan penggolongan karbohidrat yang merupakan dasar penting dalam biokimia dan metabolisme.
-
Monosakarida adalah unit dasar dan langsung digunakan dalam metabolisme.
-
Disakarida adalah kombinasi dua monosakarida yang memberikan energi cepat.
-
Oligosakarida memiliki peran dalam interaksi sel dan sistem kekebalan tubuh.
-
Polisakarida adalah penyimpan energi jangka panjang dan komponen struktural utama dalam sel.
16 Syarah (Penjelasan) Slide ke-8
Slide ini menjelaskan tentang monosakarida, yang merupakan unit dasar atau bentuk paling sederhana dari karbohidrat. Monosakarida dikenal sebagai gula sederhana karena tidak dapat dihidrolisis menjadi bentuk yang lebih kecil. Monosakarida berperan penting dalam metabolisme sebagai sumber energi utama dan sebagai prekursor dalam sintesis biomolekul lainnya.
1. Definisi Monosakarida
Monosakarida adalah unit dasar dari karbohidrat yang terdiri dari rantai karbon dengan rumus umum (CH₂O)ₙ. Setiap molekul monosakarida memiliki satu gugus karbonil yang dapat berupa:
-
Aldehid (-CHO) → Jika gugus karbonil berada di ujung rantai karbon → disebut aldosa.
-
Keton (-C=O) → Jika gugus karbonil berada di posisi kedua dari rantai karbon → disebut ketosa.
Monosakarida memiliki sifat larut dalam air karena memiliki banyak gugus hidroksil (-OH) yang bersifat polar dan mampu membentuk ikatan hidrogen dengan molekul air.
2. Klasifikasi Monosakarida Berdasarkan Jumlah Atom Karbon
Monosakarida dapat diklasifikasikan berdasarkan jumlah atom karbon dalam rantainya:
-
Triosa → 3 atom karbon
-
Tetrosa → 4 atom karbon
-
Pentosa → 5 atom karbon
-
Heksosa → 6 atom karbon
Semakin banyak jumlah atom karbon dalam rantai, semakin kompleks struktur dan sifat kimianya.
3. Contoh Monosakarida
Pada slide ini, monosakarida diklasifikasikan menjadi aldosa dan ketosa berdasarkan gugus fungsionalnya:
A. Aldosa
Aldosa memiliki gugus aldehid (-CHO) pada ujung rantai karbon. Berikut adalah contoh aldosa berdasarkan jumlah atom karbon:
-
Gliserosa → merupakan aldotriosa, yaitu aldosa dengan tiga atom karbon (C₃H₆O₃).
-
Eritrosa → merupakan aldotetrosa, yaitu aldosa dengan empat atom karbon (C₄H₈O₄).
-
Ribosa → merupakan aldopentosa, yaitu aldosa dengan lima atom karbon (C₅H₁₀O₅). Ribosa adalah komponen utama dalam RNA dan ATP.
-
Glukosa → merupakan aldoheksosa, yaitu aldosa dengan enam atom karbon (C₆H₁₂O₆). Glukosa adalah sumber energi utama dalam metabolisme sel.
👉 Relevansi Biologis:
-
Glukosa adalah monosakarida yang paling banyak digunakan dalam metabolisme sel.
-
Ribosa adalah komponen utama dalam nukleotida yang membentuk DNA dan RNA.
-
Eritrosa adalah prekursor dalam jalur pentosa fosfat.
B. Ketosa
Ketosa memiliki gugus keton (-C=O) di posisi kedua dari rantai karbon. Berikut adalah contoh ketosa berdasarkan jumlah atom karbon:
-
Dihidroksi Aseton → merupakan ketotriosa, yaitu ketosa dengan tiga atom karbon (C₃H₆O₃). Dihidroksi aseton adalah produk antara dalam glikolisis.
-
Eritrulosa → merupakan ketotetrosa, yaitu ketosa dengan empat atom karbon (C₄H₈O₄).
-
Ribulosa → merupakan ketopentosa, yaitu ketosa dengan lima atom karbon (C₅H₁₀O₅). Ribulosa adalah prekursor dalam jalur metabolisme fotosintesis (siklus Calvin).
-
Fruktosa → merupakan ketoheksosa, yaitu ketosa dengan enam atom karbon (C₆H₁₂O₆). Fruktosa adalah gula utama dalam buah dan madu.
👉 Relevansi Biologis:
-
Dihidroksi aseton adalah hasil antara dalam proses glikolisis dan dapat diubah menjadi gliseraldehida-3-fosfat untuk digunakan dalam siklus Krebs.
-
Fruktosa dapat masuk ke jalur glikolisis setelah diubah menjadi fruktosa-6-fosfat oleh enzim fruktokinase.
-
Ribulosa adalah molekul kunci dalam siklus Calvin selama proses fotosintesis.
4. Perbedaan Aldosa dan Ketosa
| Karakteristik | Aldosa | Ketosa |
|---|---|---|
| Gugus Fungsional | Aldehid (-CHO) di ujung rantai | Keton (-C=O) di posisi kedua |
| Contoh | Glukosa, Ribosa, Eritrosa | Fruktosa, Ribulosa, Eritrulosa |
| Sifat Reaktif | Mudah teroksidasi menjadi asam karboksilat | Lebih stabil, kurang reaktif |
| Peran Metabolisme | Glukosa adalah substrat utama dalam glikolisis | Fruktosa masuk ke glikolisis setelah dikonversi menjadi fruktosa-6-fosfat |
👉 Implikasi Metabolisme:
-
Aldosa lebih mudah dioksidasi karena gugus aldehid lebih reaktif dibandingkan gugus keton.
-
Glukosa (aldosa) adalah sumber utama energi dalam metabolisme.
-
Fruktosa (ketosa) memiliki jalur metabolisme khusus di hati sebelum masuk ke glikolisis.
5. Relevansi Monosakarida dalam Biologi
-
Glukosa adalah sumber energi utama yang dipecah melalui jalur glikolisis dan siklus Krebs untuk menghasilkan ATP.
-
Ribosa merupakan bagian dari RNA, ATP, dan nukleotida lainnya yang penting dalam sintesis protein dan transfer energi.
-
Fruktosa adalah komponen utama dalam buah dan madu, dan dapat dikonversi menjadi glukosa dalam hati.
-
Dihidroksi aseton adalah molekul antara dalam glikolisis yang dapat diubah menjadi gliseraldehida-3-fosfat untuk masuk ke dalam siklus Krebs.
Anotasi Tambahan:
-
Dihidroksi aseton adalah ketosa paling sederhana dan memiliki peran utama dalam glikolisis dan jalur metabolisme lainnya.
-
Ribulosa adalah substrat utama dalam proses fiksasi karbon pada tumbuhan selama siklus Calvin.
-
Fruktosa memiliki indeks glikemik lebih rendah dibandingkan glukosa, sehingga menyebabkan peningkatan kadar glukosa darah yang lebih lambat.
-
Dalam konteks metabolisme, glukosa dan fruktosa memiliki jalur metabolisme yang berbeda, tetapi keduanya berperan dalam produksi energi seluler.
6. Kesimpulan
Slide ini memberikan dasar penting tentang monosakarida, yang merupakan unit dasar dari karbohidrat. Monosakarida dibedakan berdasarkan:
-
Jumlah atom karbon (triosa, tetrosa, pentosa, heksosa)
-
Jenis gugus fungsi → aldosa dan ketosa
👉 Aldosa → Glukosa, ribosa, eritrosa, gliserosa
👉 Ketosa → Fruktosa, ribulosa, dihidroksi aseton
18 Syarah (Penjelasan) Slide ke-9
Slide ini menjelaskan karakteristik fisik dan kimia monosakarida, khususnya glukosa, sebagai contoh utama dari monosakarida yang paling banyak ditemukan dan digunakan dalam metabolisme. Monosakarida adalah unit dasar dari karbohidrat yang memainkan peran penting dalam produksi energi dan biosintesis makromolekul.
1. Sifat Fisik Monosakarida
Monosakarida memiliki sifat fisik yang khas karena struktur kimianya yang mengandung banyak gugus hidroksil (-OH) dan gugus karbonil (-CHO atau -C=O). Berikut adalah karakteristik fisik utama monosakarida:
-
Tidak berwarna → Monosakarida murni dalam bentuk kristal biasanya tidak berwarna atau memiliki warna yang sangat pucat karena struktur molekulnya yang sederhana dan tidak memiliki kromofor (gugus penyerap cahaya).
-
Kristal padat → Monosakarida dalam bentuk murni biasanya berbentuk kristal padat karena adanya interaksi antarmolekul melalui ikatan hidrogen antara gugus hidroksil (-OH) dan gugus karbonil (-CHO atau -C=O).
-
Bebas larut dalam air → Monosakarida bersifat hidrofilik karena memiliki banyak gugus hidroksil (-OH) yang bersifat polar dan dapat membentuk ikatan hidrogen dengan molekul air.
-
Sebagai contoh, glukosa, fruktosa, dan galaktosa sangat larut dalam air karena dapat membentuk ikatan hidrogen dengan molekul air.
-
-
Tidak larut dalam pelarut non-polar → Monosakarida tidak larut dalam pelarut non-polar seperti benzena dan kloroform karena sifatnya yang polar.
-
Gugus hidroksil (-OH) dan gugus karbonil (-CHO) menyebabkan monosakarida memiliki momen dipol yang tinggi, sehingga tidak kompatibel dengan pelarut non-polar yang bersifat hidrofobik.
-
👉 Implikasi Biologis:
-
Sifat larut dalam air memungkinkan monosakarida untuk dengan mudah berdifusi dalam cairan tubuh dan masuk ke dalam sel melalui transporter spesifik (seperti GLUT – glucose transporter).
-
Ketidaklarutan dalam pelarut non-polar memastikan bahwa monosakarida terdistribusi secara selektif dalam lingkungan biologis yang berair, seperti plasma darah dan sitoplasma sel.
2. Sifat Organoleptik Monosakarida
-
Rasanya manis → Monosakarida memiliki rasa manis karena mampu berinteraksi dengan reseptor rasa manis pada lidah (T1R2/T1R3).
-
Fruktosa adalah monosakarida dengan rasa paling manis, diikuti oleh glukosa dan galaktosa.
-
Glukosa memiliki rasa manis yang ringan tetapi lebih stabil dalam tubuh dibandingkan fruktosa.
-
👉 Implikasi Biologis:
-
Rasa manis dari monosakarida seperti fruktosa dan glukosa menjadi sinyal bagi tubuh untuk mengatur asupan makanan dan keseimbangan energi.
-
Rasa manis juga berperan dalam mekanisme ketergantungan pada makanan manis, yang berhubungan dengan pelepasan dopamin di otak.
3. Contoh Monosakarida
Pada slide ini disebutkan tiga contoh monosakarida utama:
-
Glukosa
-
Dikenal sebagai gula darah karena merupakan monosakarida utama dalam sirkulasi darah manusia.
-
Glukosa adalah aldoheksosa (mengandung 6 karbon dan gugus aldehid).
-
Glukosa merupakan sumber energi utama dalam metabolisme sel melalui jalur glikolisis.
-
-
Fruktosa
-
Dikenal sebagai gula buah karena banyak ditemukan dalam buah dan madu.
-
Fruktosa adalah ketoheksosa (mengandung 6 karbon dan gugus keton).
-
Fruktosa memiliki rasa lebih manis daripada glukosa dan dipecah melalui jalur metabolisme fruktosa di hati.
-
-
Galaktosa
-
Komponen utama dalam laktosa (gula susu).
-
Galaktosa adalah aldoheksosa (mirip dengan glukosa, tetapi berbeda dalam konfigurasi stereoisomer pada karbon ke-4).
-
Galaktosa digunakan dalam sintesis glikolipid dan glikoprotein di sel.
-
👉 Implikasi Biologis:
-
Glukosa adalah substrat utama dalam metabolisme energi sel.
-
Fruktosa dipecah dalam hati sebelum masuk ke jalur glikolisis.
-
Galaktosa digunakan dalam pembentukan laktosa pada kelenjar susu dan glikokonjugat dalam membran sel.
4. D-Glukosa
D-Glukosa adalah bentuk biologis aktif dari glukosa dan memiliki peran penting dalam metabolisme:
-
Gula penyusun tubuh → Glukosa adalah komponen utama dalam struktur glikogen (pada hewan) dan pati (pada tumbuhan).
-
Bahan penghasil energi → Glukosa adalah substrat utama dalam jalur glikolisis dan siklus Krebs untuk menghasilkan ATP.
-
Penyusun glikogen → Glukosa disimpan dalam bentuk glikogen di hati dan otot untuk menyediakan cadangan energi jangka pendek.
-
Heksosa yang paling umum → Glukosa adalah heksosa paling melimpah di alam dan merupakan sumber energi utama untuk sel manusia.
👉 Implikasi Biologis:
-
Konsentrasi glukosa dalam darah dijaga ketat melalui mekanisme homeostasis yang dikendalikan oleh hormon insulin dan glukagon.
-
Jika kadar glukosa darah meningkat (hiperglikemia), pankreas akan melepaskan insulin untuk meningkatkan penyerapan glukosa oleh sel.
-
Jika kadar glukosa darah rendah (hipoglikemia), pankreas akan melepaskan glukagon untuk memecah glikogen menjadi glukosa melalui proses glikogenolisis.
5. Perbedaan Biologis Glukosa, Fruktosa, dan Galaktosa
| Karakteristik | Glukosa | Fruktosa | Galaktosa |
|---|---|---|---|
| Jenis | Aldosa (aldoheksosa) | Ketosa (ketoheksosa) | Aldosa (aldoheksosa) |
| Sumber | Madu, pati, glikogen | Buah, madu | Laktosa (susu) |
| Metabolisme | Langsung masuk ke jalur glikolisis | Dikonversi menjadi fruktosa-6-fosfat di hati | Dikonversi menjadi glukosa-1-fosfat |
| Rasa | Manis sedang | Sangat manis | Manis ringan |
| Fungsi Biologis | Sumber energi utama | Energi cadangan (di hati) | Digunakan dalam sintesis glikoprotein |
6. Anotasi Tambahan:
-
D-glukosa adalah isomer D dari glukosa yang aktif secara biologis.
-
Fruktosa dimetabolisme terutama di hati, dan konsumsi fruktosa berlebih dapat menyebabkan resistensi insulin dan obesitas.
-
Galaktosa berperan dalam biosintesis laktosa pada kelenjar susu dan berperan dalam pembentukan membran sel.
-
Konsumsi glukosa dan fruktosa berlebih dapat meningkatkan risiko sindrom metabolik dan diabetes tipe 2.
7. Kesimpulan
Slide ini menyoroti karakteristik utama monosakarida sebagai sumber energi utama dalam metabolisme sel:
-
Glukosa → Sumber energi utama.
-
Fruktosa → Dimetabolisme di hati, memberikan rasa manis lebih kuat.
-
Galaktosa → Digunakan dalam sintesis glikokonjugat dan laktosa.
20 Syarah (Penjelasan) Slide ke-10
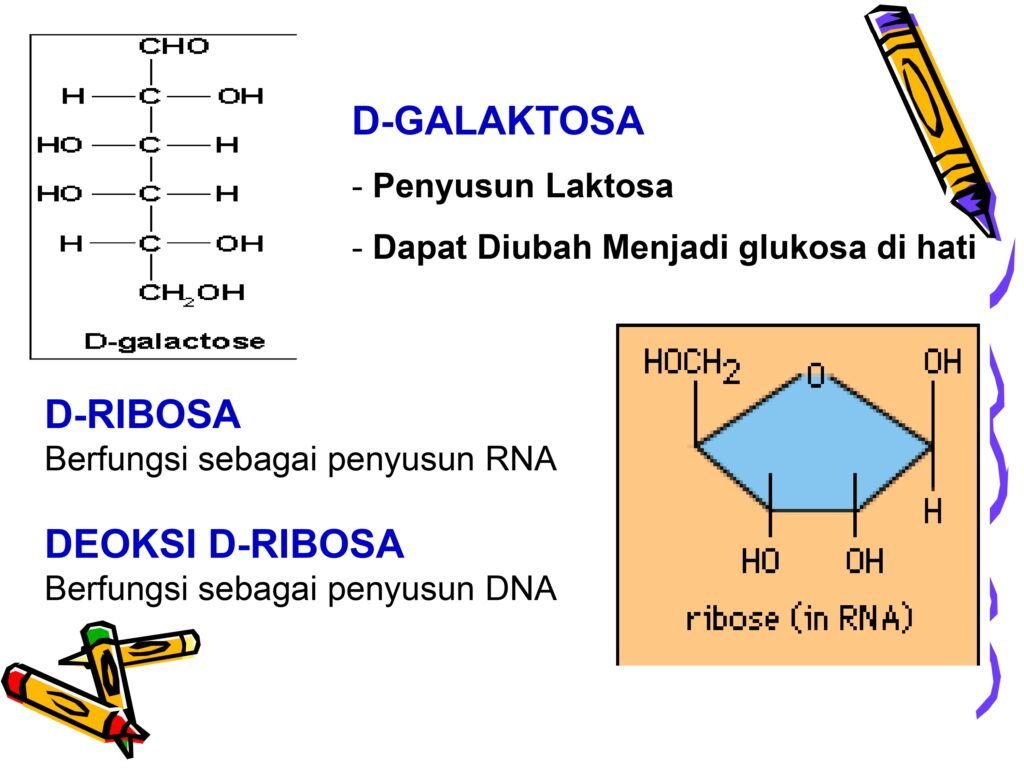
Slide ini membahas tentang tiga monosakarida penting dalam biologi, yaitu D-Galaktosa, D-Ribosa, dan Deoksi D-Ribosa. Ketiganya memiliki peran struktural dan metabolik yang signifikan dalam tubuh manusia dan sistem biologis lainnya. Pemahaman tentang struktur dan fungsi ketiga monosakarida ini sangat penting karena mereka berperan dalam sintesis makromolekul utama seperti nukleotida, DNA, RNA, dan glikoprotein.
1. D-Galaktosa
Struktur Kimia D-Galaktosa
-
D-Galaktosa adalah aldoheksosa (memiliki 6 atom karbon dan gugus aldehid pada posisi pertama).
-
Rumus kimia D-Galaktosa adalah C₆H₁₂O₆.
-
D-Galaktosa merupakan epimer dari D-Glukosa pada posisi karbon ke-4 (C4), yang berarti D-Galaktosa memiliki konfigurasi yang berbeda pada karbon ke-4 dibandingkan dengan D-Glukosa.
-
Struktur linear D-Galaktosa terdiri dari:
-
Gugus aldehid (-CHO) di posisi pertama.
-
Gugus hidroksil (-OH) pada karbon ke-2, ke-3, dan ke-4 memiliki orientasi stereoisomer yang spesifik.
-
👉 Perbedaan utama antara D-Galaktosa dan D-Glukosa terletak pada konfigurasi stereoisomer pada karbon ke-4:
-
Glukosa → Gugus -OH pada karbon ke-4 berada di bawah bidang cincin.
-
Galaktosa → Gugus -OH pada karbon ke-4 berada di atas bidang cincin.
Fungsi D-Galaktosa dalam Biologi
-
Penyusun Laktosa
-
D-Galaktosa berperan sebagai komponen utama dalam laktosa (gula susu).
-
Laktosa adalah disakarida yang terdiri dari satu unit glukosa dan satu unit galaktosa yang dihubungkan oleh ikatan β(1→4)-glikosidik.
-
Enzim laktase di usus halus bertanggung jawab untuk menghidrolisis laktosa menjadi glukosa dan galaktosa.
-
-
Dapat Diubah Menjadi Glukosa di Hati
-
D-Galaktosa dapat masuk ke jalur metabolisme energi melalui konversi menjadi glukosa dalam hati oleh jalur Leloir.
-
Proses ini melibatkan tiga enzim utama:
-
Galaktokinase → Mengubah galaktosa menjadi galaktosa-1-fosfat.
-
Galaktosa-1-fosfat uridiltransferase → Mengonversi galaktosa-1-fosfat menjadi glukosa-1-fosfat.
-
Fosfoglukomutase → Mengubah glukosa-1-fosfat menjadi glukosa-6-fosfat, yang masuk ke jalur glikolisis.
-
-
👉 Implikasi Biologis:
-
Pada individu dengan galaktosemia (kekurangan galaktosa-1-fosfat uridiltransferase), D-Galaktosa tidak dapat dimetabolisme dengan baik, menyebabkan penumpukan galaktosa di darah yang bersifat toksik bagi tubuh.
-
Laktosa dalam susu memberikan sumber energi dan nutrisi penting pada bayi selama tahap awal kehidupan.
2. D-Ribosa
Struktur Kimia D-Ribosa
-
D-Ribosa adalah aldopentosa (memiliki 5 atom karbon dan gugus aldehid pada posisi pertama).
-
Rumus kimia D-Ribosa adalah C₅H₁₀O₅.
-
Struktur D-Ribosa terdiri dari:
-
Gugus aldehid (-CHO) di posisi pertama.
-
Lima atom karbon yang membentuk cincin furanosa.
-
Gugus hidroksil (-OH) yang bersifat polar, memungkinkan pembentukan ikatan hidrogen dengan molekul air dan makromolekul lainnya.
-
Fungsi D-Ribosa dalam Biologi
-
Penyusun RNA (Ribonukleotida)
-
Ribosa adalah komponen utama dari nukleotida yang menyusun RNA (asam ribonukleat).
-
Dalam RNA, ribosa terikat dengan basa nitrogen (adenin, guanin, sitosin, atau urasil) melalui ikatan glikosidik di karbon ke-1 (C1').
-
Gugus fosfat terikat pada karbon ke-5 (C5') dalam sintesis nukleotida.
-
-
Penyusun ATP, NADH, dan FADH₂
-
Ribosa adalah bagian dari molekul ATP (adenosin trifosfat), yang berfungsi sebagai sumber energi utama dalam sel.
-
Ribosa juga merupakan bagian dari NADH dan FADH₂ yang berperan dalam transfer elektron selama respirasi seluler.
-
👉 Implikasi Biologis:
-
Tanpa D-Ribosa, sel tidak dapat mensintesis RNA atau ATP, yang berarti sel tidak bisa melakukan sintesis protein atau menghasilkan energi.
-
Jalur pentosa fosfat adalah jalur utama untuk sintesis ribosa dalam tubuh.
3. Deoksi D-Ribosa
Struktur Kimia Deoksi D-Ribosa
-
Deoksi D-Ribosa adalah turunan dari D-Ribosa di mana gugus hidroksil (-OH) pada karbon ke-2 (C2') digantikan oleh atom hidrogen (-H).
-
Rumus kimia Deoksi D-Ribosa adalah C₅H₁₀O₄.
-
Deoksi D-Ribosa membentuk cincin furanosa yang mirip dengan ribosa, tetapi kehilangan satu gugus hidroksil, yang menyebabkan perbedaan stabilitas dan struktur dengan ribosa.
Fungsi Deoksi D-Ribosa dalam Biologi
-
Penyusun DNA (Deoksiribonukleotida)
-
Deoksi D-Ribosa adalah komponen utama dari nukleotida yang membentuk DNA (asam deoksiribonukleat).
-
Deoksi D-Ribosa berikatan dengan basa nitrogen (adenin, guanin, sitosin, dan timin) melalui ikatan glikosidik di karbon ke-1 (C1').
-
Gugus fosfat terikat pada karbon ke-5 (C5') untuk membentuk rangkaian polinukleotida dalam DNA.
-
👉 Implikasi Biologis:
-
Kehilangan gugus hidroksil (-OH) pada karbon ke-2 menyebabkan DNA menjadi lebih stabil dibandingkan RNA, karena hilangnya gugus hidroksil mengurangi kemungkinan terjadinya hidrolisis spontan pada DNA.
-
DNA adalah materi genetik utama dalam sel, dan replikasi DNA memungkinkan pewarisan informasi genetik.
4. Perbedaan Antara Ribosa dan Deoksi Ribosa
| Karakteristik | D-Ribosa | Deoksi D-Ribosa |
|---|---|---|
| Gugus pada C2' | -OH (hidroksil) | -H (hidrogen) |
| Fungsi | Penyusun RNA, ATP, NADH | Penyusun DNA |
| Stabilitas | Kurang stabil (karena gugus -OH) | Lebih stabil |
| Peran Metabolisme | Sintesis protein, transfer energi | Replikasi dan penyimpanan informasi genetik |
5. Kesimpulan
Slide ini menjelaskan tiga monosakarida yang berperan penting dalam biologi:
-
D-Galaktosa → Komponen laktosa dan prekursor glukosa di hati.
-
D-Ribosa → Komponen RNA, ATP, NADH, dan FADH₂.
-
Deoksi D-Ribosa → Komponen utama DNA, memberikan stabilitas pada materi genetik.
22 Syarah (Penjelasan) Slide ke-11
Slide ini berjudul "Sifat Monosakarida", yang mengindikasikan bahwa pembahasan selanjutnya akan berfokus pada karakteristik fisik, kimia, dan biologis dari monosakarida. Monosakarida adalah unit dasar penyusun karbohidrat dan memainkan peran penting dalam metabolisme, struktur seluler, dan sinyal sel. Pemahaman tentang sifat monosakarida sangat penting untuk memahami bagaimana senyawa ini berperan dalam metabolisme dan fungsi biologis.
Berikut adalah penjelasan komprehensif mengenai sifat utama monosakarida:
1. Sifat Fisik Monosakarida
a) Wujud Fisik
Monosakarida umumnya berbentuk padat kristalin pada suhu kamar.
-
Monosakarida memiliki sifat kristalin karena molekulnya membentuk pola teratur dalam fase padat melalui ikatan hidrogen antar molekul.
-
Monosakarida yang bersifat polar menyebabkan molekulnya dapat membentuk struktur kisi kristal yang teratur.
b) Rasa Manis
Sebagian besar monosakarida memiliki rasa manis karena mampu berinteraksi dengan reseptor rasa manis pada lidah (T1R2/T1R3).
-
Fruktosa → Merupakan monosakarida dengan rasa paling manis, sekitar 1,7 kali lebih manis dibandingkan glukosa.
-
Glukosa → Memiliki rasa manis yang sedang dan merupakan gula utama yang diukur dalam indeks glikemik (IG).
-
Galaktosa → Memiliki rasa manis yang lebih rendah dibandingkan glukosa dan fruktosa.
👉 Implikasi Biologis:
-
Rasa manis dari monosakarida merupakan sinyal untuk meningkatkan asupan energi dalam tubuh.
-
Peningkatan kadar glukosa darah akan memicu pelepasan insulin untuk meningkatkan penyerapan glukosa oleh sel.
c) Kelarutan dalam Air
Monosakarida sangat larut dalam air karena memiliki banyak gugus hidroksil (-OH) yang bersifat polar.
-
Ikatan hidrogen antara gugus hidroksil dengan molekul air menyebabkan monosakarida mudah larut dalam air.
-
Monosakarida tidak larut dalam pelarut non-polar seperti benzena dan kloroform karena tidak adanya interaksi dipol yang memadai.
👉 Implikasi Biologis:
-
Sifat larut dalam air memungkinkan monosakarida untuk berdifusi dengan mudah melalui cairan tubuh dan masuk ke dalam sel.
-
Transportasi monosakarida ke dalam sel terjadi melalui transporter membran (GLUT) yang spesifik untuk jenis monosakarida tertentu.
2. Sifat Kimia Monosakarida
a) Aktivitas Optis
Monosakarida adalah senyawa yang bersifat optis aktif karena memiliki atom karbon kiral (asam karbon dengan empat substituen berbeda).
-
Monosakarida dapat memutar cahaya terpolarisasi ke arah:
-
Kanan (+) → Dextrorotatory (D) → Misalnya D-glukosa.
-
Kiri (-) → Levorotatory (L) → Misalnya L-fruktosa.
-
-
Dalam sistem biologis, sebagian besar monosakarida yang aktif secara biologis adalah dalam konfigurasi D.
👉 Implikasi Biologis:
-
Enzim dalam tubuh spesifik terhadap stereoisomer tertentu.
-
D-glukosa adalah bentuk biologis aktif, sedangkan L-glukosa tidak dapat dikenali oleh enzim metabolik dalam tubuh.
b) Pembentukan Struktur Siklik
Monosakarida dengan lima atau enam atom karbon (misalnya ribosa, glukosa, fruktosa) biasanya berikatan membentuk struktur siklik melalui reaksi antara gugus karbonil dan hidroksil:
-
Furanosa → Jika membentuk cincin lima anggota (contoh: ribosa).
-
Piranosa → Jika membentuk cincin enam anggota (contoh: glukosa).
👉 Implikasi Biologis:
-
Struktur siklik lebih stabil dalam lingkungan biologis.
-
Dalam bentuk siklik, monosakarida dapat berpartisipasi dalam pembentukan ikatan glikosidik untuk membentuk disakarida, oligosakarida, dan polisakarida.
c) Reaksi Reduksi dan Oksidasi
-
Monosakarida yang mengandung gugus aldehid (aldosa) dapat mengalami reaksi reduksi menjadi alkohol.
-
Monosakarida juga dapat mengalami reaksi oksidasi menghasilkan:
-
Asam aldronat → jika gugus aldehid teroksidasi.
-
Asam uronat → jika gugus terminal alkohol teroksidasi.
-
-
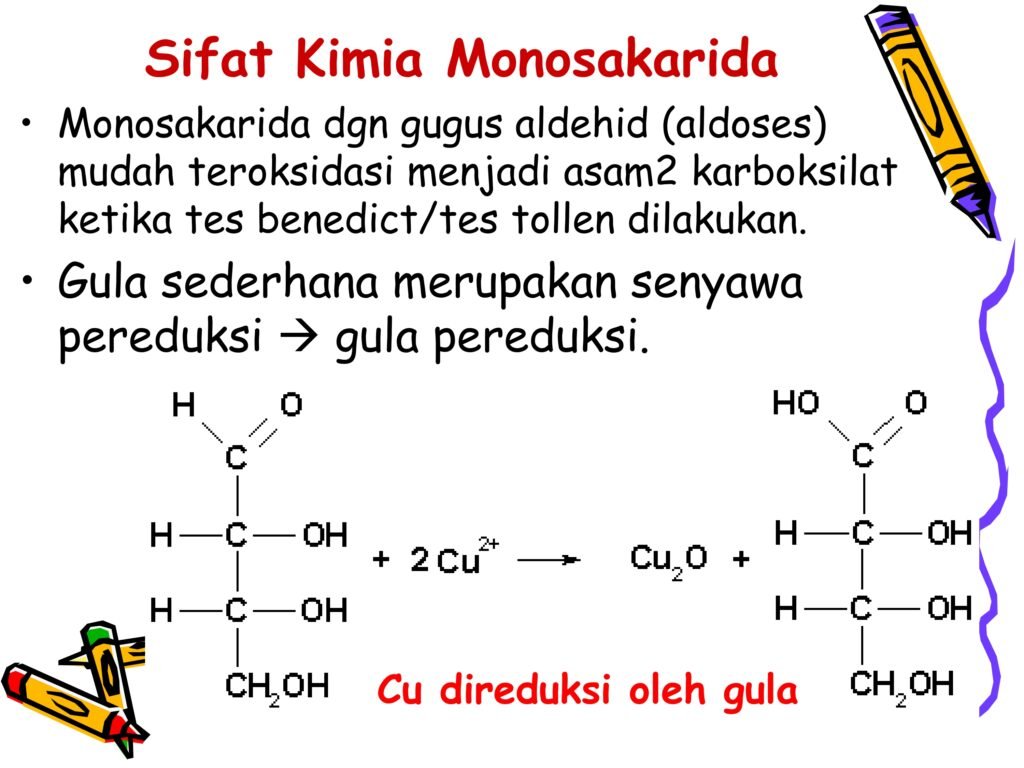
Monosakarida seperti glukosa dan galaktosa dikenal sebagai gula pereduksi karena dapat mereduksi senyawa seperti larutan Fehling dan Tollens.
👉 Implikasi Biologis:
-
Pengujian gula reduksi menggunakan larutan Fehling atau Benedict dapat digunakan untuk mendeteksi keberadaan glukosa dalam urin (diabetes).
-
Dalam metabolisme, oksidasi glukosa melalui glikolisis menghasilkan ATP dan intermediat metabolik lainnya.
d) Reaksi Kondensasi dan Hidrolisis
-
Monosakarida dapat saling berikatan melalui ikatan glikosidik untuk membentuk disakarida dan polisakarida dalam reaksi kondensasi (menghasilkan air).
-
Ikatan glikosidik dapat dipecah melalui hidrolisis menggunakan enzim spesifik.
-
Maltase → Menghidrolisis maltosa menjadi dua unit glukosa.
-
Laktase → Menghidrolisis laktosa menjadi glukosa dan galaktosa.
-
Sukrase → Menghidrolisis sukrosa menjadi glukosa dan fruktosa.
-
👉 Implikasi Biologis:
-
Proses hidrolisis merupakan bagian penting dari pencernaan karbohidrat di usus halus.
-
Gangguan dalam aktivitas enzim hidrolase dapat menyebabkan intoleransi makanan tertentu (misalnya intoleransi laktosa).
3. Sifat Biologis Monosakarida
-
Glukosa → Sumber energi utama dalam metabolisme melalui jalur glikolisis dan siklus Krebs.
-
Fruktosa → Dimetabolisme di hati melalui jalur fruktosa khusus.
-
Galaktosa → Dikonversi menjadi glukosa di hati melalui jalur Leloir.
-
Ribosa → Komponen utama dalam RNA, ATP, NADH, dan FADH₂.
-
Deoksi Ribosa → Komponen utama DNA, memberikan stabilitas pada materi genetik.
4. Anotasi Tambahan
-
Sifat stereoisomer pada monosakarida mempengaruhi pengenalan oleh enzim dan transporter membran.
-
Sifat pereduksi monosakarida digunakan dalam tes medis seperti uji Fehling dan uji Benedict untuk mendeteksi glukosa dalam darah atau urin.
-
Struktur siklik memungkinkan monosakarida untuk membentuk polimer seperti pati, glikogen, dan selulosa.
-
Rasa manis monosakarida berperan dalam regulasi nafsu makan dan sinyal metabolik di otak.
5. Kesimpulan
Slide ini merupakan pengantar untuk menjelaskan sifat utama monosakarida, yang meliputi:
-
Sifat fisik → kristalin, larut dalam air, rasa manis.
-
Sifat kimia → aktivitas optis, reduksi, oksidasi, reaksi siklisasi.
-
Sifat biologis → fungsi dalam metabolisme, penyusun RNA, DNA, dan sumber energi.
24 Syarah (Penjelasan) Slide ke-12
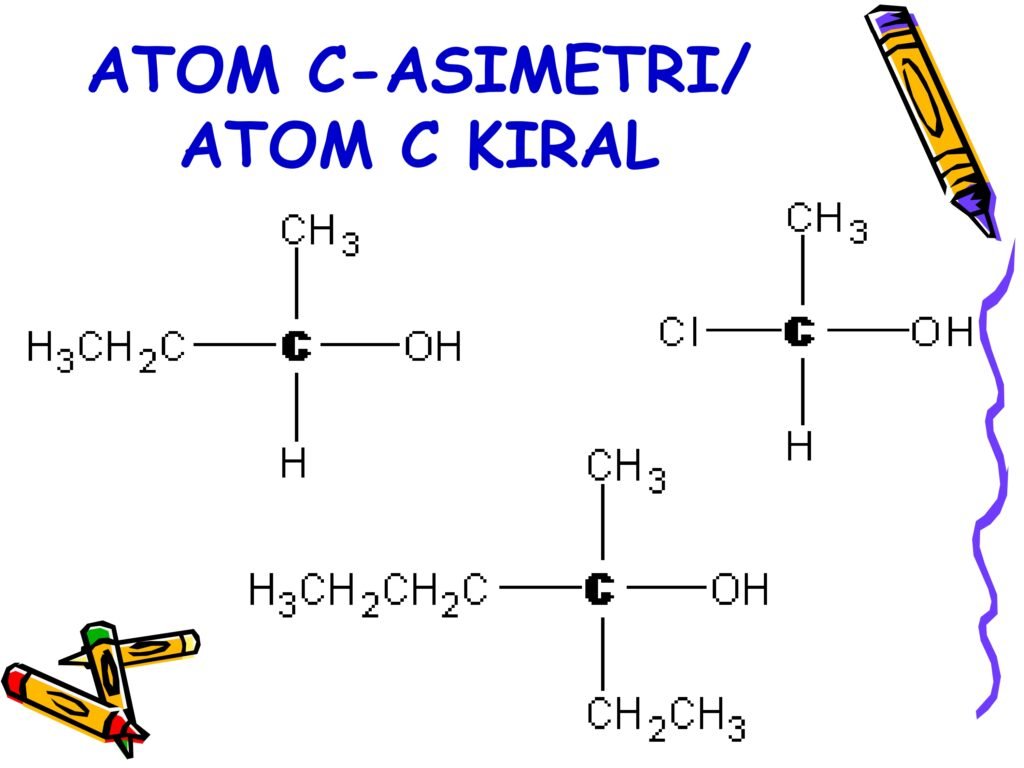
Slide ini membahas tentang Atom C-Asimetri atau Atom C Kiral yang merupakan konsep dasar dalam kimia stereoisomer dan biokimia. Keberadaan atom karbon kiral dalam struktur molekul menentukan sifat stereokimia senyawa tersebut, termasuk aktivitas optik dan interaksi biologisnya dengan enzim dan reseptor dalam tubuh. Pemahaman tentang atom C-asimetri sangat penting dalam mempelajari struktur dan fungsi karbohidrat, protein, dan lemak.
1. Definisi Atom C-Asimetri (Atom Kiral)
Atom karbon kiral adalah atom karbon yang terikat pada empat gugus atau atom yang berbeda.
-
Dalam kimia organik, atom karbon yang memiliki empat substituen berbeda akan membentuk pusat kiral karena tidak memiliki simetri cermin internal.
-
Akibatnya, senyawa dengan atom karbon kiral akan memiliki dua bentuk stereoisomer yang merupakan gambar cermin satu sama lain, tetapi tidak dapat tumpang tindih (bersifat enansiomer).
Syarat Atom C Kiral:
-
Harus memiliki empat ikatan kovalen.
-
Keempat substituen yang terikat harus berbeda satu sama lain.
-
Tidak memiliki sumbu atau bidang simetri dalam molekulnya.
👉 Implikasi Biologis:
-
Karbohidrat dan asam amino alami dalam tubuh sebagian besar berbentuk stereoisomer D atau L yang spesifik.
-
Enzim dalam tubuh mengenali stereoisomer tertentu karena spesifisitas struktur molekul yang diakibatkan oleh kiralitas.
2. Sifat Atom C Kiral
a) Aktivitas Optik
Karena memiliki pusat kiral, molekul akan bersifat optis aktif yang berarti mampu memutar cahaya terpolarisasi.
-
Jika memutar cahaya ke kanan → disebut (+)-dextrorotatory (D)
-
Jika memutar cahaya ke kiri → disebut (-)-levorotatory (L)
👉 Contoh:
-
D-glukosa → memutar cahaya ke kanan (D+)
-
L-glukosa → memutar cahaya ke kiri (L-)
b) Enansiomer dan Diastereomer
-
Enansiomer → Pasangan stereoisomer yang merupakan gambar cermin satu sama lain tetapi tidak dapat saling menutupi.
-
Contoh: D-glukosa dan L-glukosa adalah pasangan enansiomer.
-
-
Diastereomer → Stereoisomer yang tidak saling mencerminkan tetapi memiliki konfigurasi yang berbeda pada satu atau lebih pusat kiral.
-
Contoh: Glukosa dan galaktosa adalah diastereomer karena memiliki konfigurasi berbeda pada karbon ke-4.
-
👉 Implikasi Biologis:
-
Enzim bersifat stereospesifik → hanya mengenali satu enansiomer saja.
-
Dalam tubuh manusia, enzim metabolisme hanya mengenali bentuk D-glukosa, bukan L-glukosa.
c) R dan S Konfigurasi (Sistem Cahn-Ingold-Prelog)
Konfigurasi stereoisomer ditentukan berdasarkan aturan prioritas Cahn-Ingold-Prelog:
-
Atom dengan nomor atom yang lebih tinggi diberi prioritas lebih tinggi.
-
Jika dua atom pertama sama, maka prioritas ditentukan oleh atom berikutnya dalam rantai.
-
Jika substituen dengan prioritas terendah berada di belakang bidang, maka:
-
Jika urutan substituen (1 → 2 → 3) searah jarum jam → konfigurasi R (Rectus)
-
Jika urutan substituen (1 → 2 → 3) berlawanan jarum jam → konfigurasi S (Sinister)
-
👉 Contoh:
-
D-glukosa → konfigurasi R pada pusat kiral utama.
-
L-glukosa → konfigurasi S pada pusat kiral utama.
3. Penjelasan Contoh pada Slide
Pada slide ini, terdapat tiga contoh molekul dengan atom karbon kiral:
Contoh 1:
H3CH2C−C(H)(OH)−CH3H_3CH_2C - C(H)(OH) - CH_3H3CH2C−C(H)(OH)−CH3
-
Atom karbon tengah (hitam tebal) memiliki empat gugus berbeda:
-
Gugus etil (-CH₂CH₃)
-
Gugus metil (-CH₃)
-
Gugus hidroksil (-OH)
-
Atom hidrogen (H)
👉 Molekul ini memiliki pusat kiral karena tidak memiliki simetri dan empat substituen berbeda.
-
Contoh 2:
CH3−C(H)(OH)−ClCH_3 - C(H)(OH) - ClCH3−C(H)(OH)−Cl
-
Atom karbon tengah memiliki empat gugus berbeda:
-
Gugus metil (-CH₃)
-
Gugus hidroksil (-OH)
-
Gugus klor (-Cl)
-
Atom hidrogen (H)
👉 Molekul ini bersifat kiral dan memiliki enansiomer (+) dan (-).
-
Contoh 3:
H3CH2CH2CH2−C(H)(OH)−CH2CH3H_3CH_2CH_2CH_2 - C(H)(OH) - CH_2CH_3H3CH2CH2CH2−C(H)(OH)−CH2CH3
-
Atom karbon tengah memiliki empat substituen:
-
Gugus propil (-CH₂CH₂CH₃)
-
Gugus etil (-CH₂CH₃)
-
Gugus hidroksil (-OH)
-
Atom hidrogen (H)
👉 Molekul ini juga bersifat kiral dan memiliki stereoisomer (R) dan (S).
-
4. Pentingnya Kiralitas dalam Biologi
a) Metabolisme Karbohidrat dan Protein
-
Dalam metabolisme, enzim spesifik mengenali stereoisomer tertentu.
-
Enzim glukokinase → mengenali D-glukosa, tetapi tidak mengenali L-glukosa.
-
Enzim laktase → mengenali β-D-galaktosa tetapi tidak α-D-galaktosa.
-
b) Efek Farmakologis
-
Obat-obatan dengan atom kiral memiliki aktivitas biologis yang berbeda tergantung pada enansiomer yang digunakan.
-
Talidomid → Satu enansiomer memiliki efek terapeutik, sedangkan enansiomer lainnya bersifat teratogenik (penyebab cacat lahir).
-
Ibuprofen → Bentuk S adalah aktif secara farmakologis, sedangkan bentuk R tidak aktif.
-
5. Anotasi Tambahan
-
Atom karbon kiral adalah dasar untuk membedakan antara bentuk D dan L dalam monosakarida dan asam amino.
-
Sistem R/S dan D/L adalah dua sistem yang berbeda untuk menggambarkan stereoisomerisme.
-
R/S → Berdasarkan aturan prioritas Cahn-Ingold-Prelog.
-
D/L → Berdasarkan hubungan dengan gliseraldehida sebagai referensi.
-
-
Isomer optik mempengaruhi reaksi biologis karena enzim hanya dapat mengenali satu enansiomer tertentu.
6. Kesimpulan
Slide ini membahas konsep dasar tentang atom C kiral dan stereoisomerisme:
-
Atom C kiral adalah atom karbon yang memiliki empat substituen berbeda.
-
Sifat kiral menyebabkan munculnya enansiomer dan diastereomer.
-
Konfigurasi kiral memengaruhi aktivitas biologis karena enzim bersifat stereospesifik.
-
Pemahaman tentang stereoisomerisme penting dalam metabolisme, farmakologi, dan desain obat.
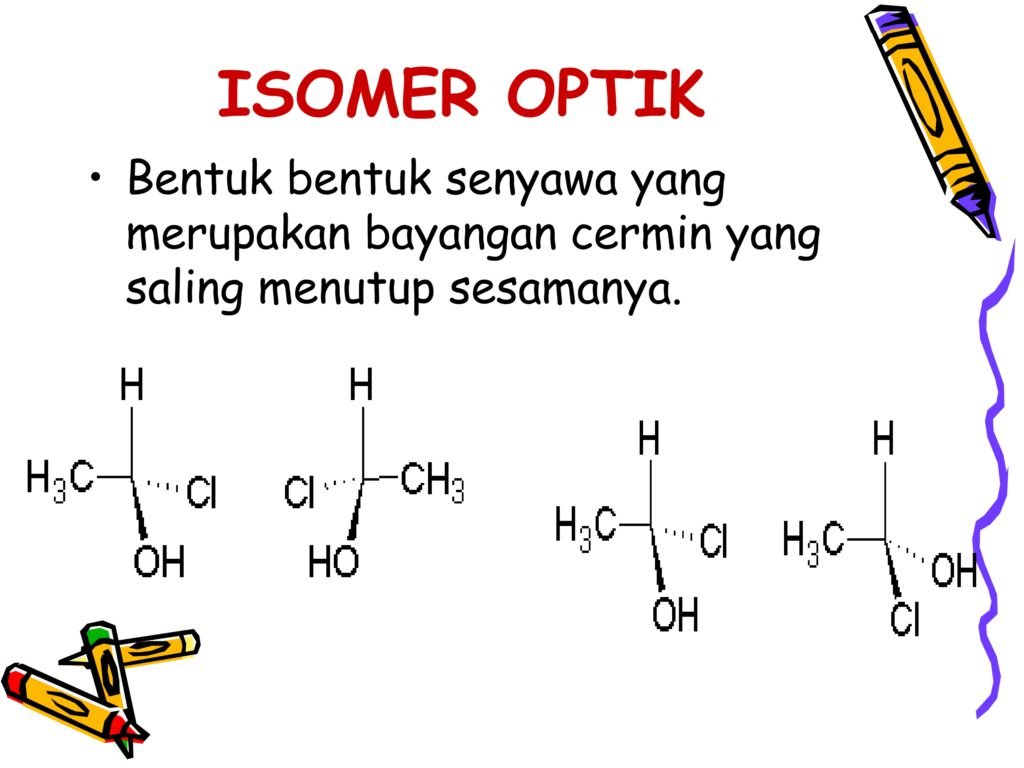
26 Syarah (Penjelasan) Slide ke-13
Slide ini membahas tentang Isomer Optik yang merupakan salah satu bentuk stereoisomer. Isomer optik adalah senyawa yang memiliki susunan atom yang sama tetapi berbeda dalam orientasi spasial sehingga menjadi gambar cermin satu sama lain. Fenomena ini disebabkan oleh keberadaan atom karbon kiral dalam struktur molekul, di mana empat gugus yang terikat pada karbon tersebut berbeda satu sama lain. Isomer optik memiliki peran penting dalam biologi, terutama karena enzim dan protein dalam tubuh bersifat stereospesifik, hanya mengenali satu jenis isomer optik.
1. Definisi Isomer Optik
Isomer optik adalah dua senyawa yang memiliki:
-
Rumus molekul dan struktur kovalen yang sama,
-
Tetapi memiliki orientasi spasial yang berbeda,
-
Dan merupakan gambar cermin yang tidak dapat saling menutupi satu sama lain (non-superimposable).
👉 Sifat utama isomer optik:
-
Karena orientasi spasialnya berbeda, pasangan isomer optik memiliki sifat fisik dan kimia yang sangat mirip tetapi memiliki perbedaan dalam aktivitas optik.
-
Isomer optik memutar cahaya terpolarisasi ke arah yang berbeda:
-
Jika memutar cahaya ke kanan → disebut dextrorotatory (+)
-
Jika memutar cahaya ke kiri → disebut levorotatory (-)
-
Contoh:
-
D-Glukosa → Memutar cahaya ke kanan (dextrorotatory)
-
L-Glukosa → Memutar cahaya ke kiri (levorotatory)
👉 Implikasi Biologis:
-
Dalam sistem biologis, sebagian besar karbohidrat yang aktif secara biologis adalah stereoisomer D (seperti D-glukosa).
-
Asam amino yang aktif secara biologis adalah bentuk L (seperti L-alanin).
2. Syarat Terbentuknya Isomer Optik
Isomer optik hanya dapat terbentuk jika suatu molekul memiliki pusat kiral (atom karbon asimetris), yang memiliki empat gugus yang berbeda.
-
Jika dalam molekul terdapat satu atom C kiral, maka akan ada dua bentuk stereoisomer (D dan L).
-
Jika terdapat dua atau lebih atom C kiral, jumlah stereoisomer akan mengikuti rumus:
2n2^n2n
di mana n adalah jumlah atom karbon kiral.
Contoh:
-
Gliseraldehida → memiliki satu pusat kiral, sehingga memiliki dua stereoisomer (D dan L).
-
Glukosa → memiliki empat pusat kiral, sehingga memiliki 24=162^4 = 1624=16 stereoisomer yang berbeda.
👉 Implikasi Biologis:
-
Dalam metabolisme, hanya stereoisomer D-glukosa yang dapat dikenali oleh enzim metabolik tubuh.
-
L-glukosa tidak dapat dimetabolisme karena bentuk enansiomer ini tidak cocok dengan situs aktif enzim.
3. Enansiomer dan Diastereomer
a) Enansiomer
-
Enansiomer adalah pasangan isomer optik yang merupakan gambar cermin satu sama lain tetapi tidak dapat tumpang tindih.
-
Kedua enansiomer memiliki:
-
Sifat fisik (titik didih, kelarutan) yang sama
-
Sifat biologis dan aktivitas optik yang berlawanan
-
Contoh:
-
D-glukosa dan L-glukosa adalah enansiomer.
-
D-amilosa dan L-amilosa adalah enansiomer.
👉 Implikasi Biologis:
-
Enzim bersifat spesifik → hanya mengenali satu bentuk enansiomer tertentu.
-
Enansiomer yang berlawanan arah bisa memiliki efek biologis yang berbeda.
-
D-glukosa → sumber energi utama dalam metabolisme.
-
L-glukosa → tidak dapat dimetabolisme oleh tubuh.
-
b) Diastereomer
-
Diastereomer adalah stereoisomer yang tidak saling mencerminkan tetapi memiliki konfigurasi yang berbeda pada satu atau lebih pusat kiral.
-
Diastereomer memiliki:
-
Sifat fisik (titik didih, titik leleh) yang berbeda
-
Aktivitas optik yang tidak berlawanan
-
Contoh:
-
D-glukosa dan D-galaktosa adalah diastereomer karena berbeda dalam konfigurasi pada karbon ke-4.
-
D-glukosa dan D-mannosa adalah diastereomer karena berbeda dalam konfigurasi pada karbon ke-2.
👉 Implikasi Biologis:
-
Diastereomer dapat memiliki aktivitas biologis yang berbeda.
-
D-glukosa adalah substrat utama untuk metabolisme, tetapi D-mannosa memiliki peran yang lebih spesifik dalam proses glikosilasi protein.
4. Penjelasan Contoh pada Slide
Contoh 1:
H3C−C(Cl)(OH)−CH3H_3C - C(Cl)(OH) - CH_3H3C−C(Cl)(OH)−CH3
-
Pada gambar pertama, terdapat atom karbon pusat yang terikat pada:
-
Gugus metil (-CH₃)
-
Gugus hidroksil (-OH)
-
Gugus klor (-Cl)
-
Atom hidrogen (H)
-
-
Karena keempat gugus berbeda, molekul ini bersifat kiral dan membentuk pasangan enansiomer yang merupakan bayangan cermin satu sama lain.
Contoh 2:
CH3−C(Cl)(OH)−HCH_3 - C(Cl)(OH) - HCH3−C(Cl)(OH)−H
-
Gugus-gugus yang terikat pada karbon pusat adalah:
-
Gugus metil (-CH₃)
-
Gugus klor (-Cl)
-
Gugus hidroksil (-OH)
-
Atom hidrogen (H)
-
-
Molekul ini memiliki pusat kiral dan dapat membentuk dua stereoisomer yang berbeda dalam sifat optik.
👉 Implikasi Biologis:
-
Molekul ini memiliki aktivitas optik yang berbeda karena perbedaan orientasi spasial gugus fungsional.
5. Perbedaan Sifat Enansiomer dan Diastereomer
| Karakteristik | Enansiomer | Diastereomer |
|---|---|---|
| Hubungan | Gambar cermin | Bukan gambar cermin |
| Konfigurasi | Berlawanan pada semua pusat kiral | Berbeda pada satu atau lebih pusat kiral |
| Sifat Fisik | Sama (titik didih, kelarutan) | Berbeda |
| Aktivitas Optik | Berlawanan (+) dan (-) | Tidak selalu berlawanan |
| Aktivitas Biologis | Hanya satu bentuk aktif biologis | Bisa memiliki aktivitas biologis berbeda |
6. Anotasi Tambahan
-
Dalam tubuh manusia, enzim metabolik biasanya mengenali stereoisomer D pada karbohidrat dan stereoisomer L pada asam amino.
-
Perbedaan konfigurasi stereoisomer memengaruhi interaksi dengan reseptor, enzim, dan protein dalam tubuh.
-
Dalam pengembangan obat, pemisahan enansiomer penting karena enansiomer yang tidak aktif atau berlawanan arah bisa memiliki efek samping.
7. Kesimpulan
Slide ini menjelaskan konsep dasar tentang isomer optik:
-
Isomer optik adalah senyawa dengan struktur identik tetapi memiliki orientasi spasial berbeda.
-
Enansiomer adalah gambar cermin satu sama lain, sedangkan diastereomer bukan gambar cermin.
-
Enzim dan reseptor dalam tubuh bersifat stereospesifik → hanya mengenali satu bentuk enansiomer tertentu.
-
Konfigurasi stereoisomer sangat mempengaruhi metabolisme, interaksi enzim, dan efek farmakologis.
28 Syarah (Penjelasan) Slide ke-14
Slide ini menjelaskan tentang jumlah isomer optik yang dapat terbentuk dari suatu molekul dengan pusat kiral (atom karbon kiral). Keberadaan atom karbon kiral menyebabkan munculnya kemungkinan konfigurasi spasial yang berbeda, sehingga membentuk berbagai stereoisomer (termasuk enansiomer dan diastereomer).
Dalam biokimia, keberadaan stereoisomer sangat penting karena aktivitas biologis molekul sering kali bergantung pada konfigurasi spesifiknya. Sebagai contoh, hanya D-glukosa yang dapat dikenali oleh enzim metabolisme dalam tubuh, sedangkan L-glukosa tidak dapat digunakan dalam jalur metabolisme normal.
1. Rumus Umum untuk Menghitung Jumlah Isomer Optik
Jumlah total stereoisomer (termasuk enansiomer dan diastereomer) yang dapat terbentuk dari molekul dengan n pusat kiral dihitung menggunakan rumus:
2n2^n2n
di mana:
-
n = jumlah pusat kiral (jumlah atom karbon kiral)
-
Hasil dari rumus ini memberikan jumlah total stereoisomer yang mungkin.
👉 Makna Rumus:
-
Setiap pusat kiral dapat memiliki dua konfigurasi: (R) atau (S).
-
Kombinasi semua kemungkinan konfigurasi pada setiap pusat kiral menghasilkan jumlah stereoisomer sebanyak 2ⁿ.
2. Penjelasan Konsep
a) Enansiomer dan Diastereomer
-
Jika molekul hanya memiliki satu pusat kiral (n = 1), maka hanya terdapat dua kemungkinan stereoisomer → sepasang enansiomer.
-
Jika molekul memiliki dua pusat kiral (n = 2), maka terdapat empat stereoisomer → dua pasang enansiomer yang berbeda.
-
Jika molekul memiliki tiga pusat kiral (n = 3), maka terdapat delapan stereoisomer → empat pasang enansiomer dan beberapa diastereomer.
👉 Implikasi Biologis:
-
Jika terdapat dua atau lebih pusat kiral, tidak semua stereoisomer akan membentuk pasangan enansiomer → beberapa mungkin menjadi diastereomer.
-
Enansiomer memiliki sifat fisik dan kimia yang identik (kecuali aktivitas optik), sedangkan diastereomer memiliki sifat fisik dan kimia yang berbeda.
b) Contoh Perhitungan Jumlah Stereoisomer
-
Gliseraldehida → memiliki satu pusat kiral →
21=2 stereoisomer2^1 = 2 \text{ stereoisomer}21=2 stereoisomer
(D-gliseraldehida dan L-gliseraldehida adalah pasangan enansiomer.)
-
Glukosa → memiliki empat pusat kiral →
24=16 stereoisomer2^4 = 16 \text{ stereoisomer}24=16 stereoisomer
-
Dari 16 stereoisomer ini, 8 stereoisomer termasuk dalam kategori D-glukosa dan L-glukosa.
-
8 stereoisomer lainnya adalah diastereomer dari glukosa.
-
Fruktosa → memiliki tiga pusat kiral →
23=8 stereoisomer2^3 = 8 \text{ stereoisomer}23=8 stereoisomer
-
Fruktosa memiliki 4 pasangan enansiomer dan 4 diastereomer.
3. Isomer Optik dalam Biologi
a) Karbohidrat
-
Semua monosakarida dengan lebih dari satu pusat kiral memiliki diastereomer.
-
Enzim metabolik dalam tubuh hanya mengenali D-monosakarida dan tidak mengenali L-monosakarida.
-
Glukosa memiliki empat pusat kiral → memiliki 16 stereoisomer, tetapi hanya D-glukosa yang dikenali dalam metabolisme tubuh.
b) Asam Amino
-
Asam amino (kecuali glisin) memiliki satu pusat kiral pada atom karbon alfa → memiliki dua kemungkinan stereoisomer: L dan D.
-
Hanya L-asam amino yang digunakan dalam sintesis protein dalam tubuh manusia.
👉 Implikasi Biologis:
-
Perbedaan konfigurasi stereoisomer menyebabkan perbedaan dalam pengenalan oleh enzim dan reseptor biologis.
-
Dalam tubuh manusia, enzim sangat selektif terhadap stereoisomer tertentu.
4. Perbedaan Enansiomer dan Diastereomer dalam Konteks Isomer Optik
| Karakteristik | Enansiomer | Diastereomer |
|---|---|---|
| Hubungan | Gambar cermin satu sama lain | Bukan gambar cermin |
| Konfigurasi | Berlawanan di semua pusat kiral | Berbeda di satu atau lebih pusat kiral |
| Sifat Fisik | Sama (titik leleh, titik didih) | Berbeda (titik leleh, titik didih) |
| Aktivitas Optik | Berlawanan arah (+) dan (-) | Tidak berlawanan |
| Jumlah yang mungkin | Selalu berpasangan | Bisa lebih dari dua pasangan |
5. Contoh Jumlah Isomer Optik pada Monosakarida
| Monosakarida | Rumus Molekul | Pusat Kiral | Jumlah Isomer Optik |
|---|---|---|---|
| Gliseraldehida | C₃H₆O₃ | 1 | 2 |
| Eritrosa | C₄H₈O₄ | 2 | 4 |
| Ribosa | C₅H₁₀O₅ | 3 | 8 |
| Glukosa | C₆H₁₂O₆ | 4 | 16 |
| Fruktosa | C₆H₁₂O₆ | 3 | 8 |
👉 Catatan:
-
Dalam monosakarida, hanya stereoisomer D yang dikenali oleh enzim metabolisme tubuh.
-
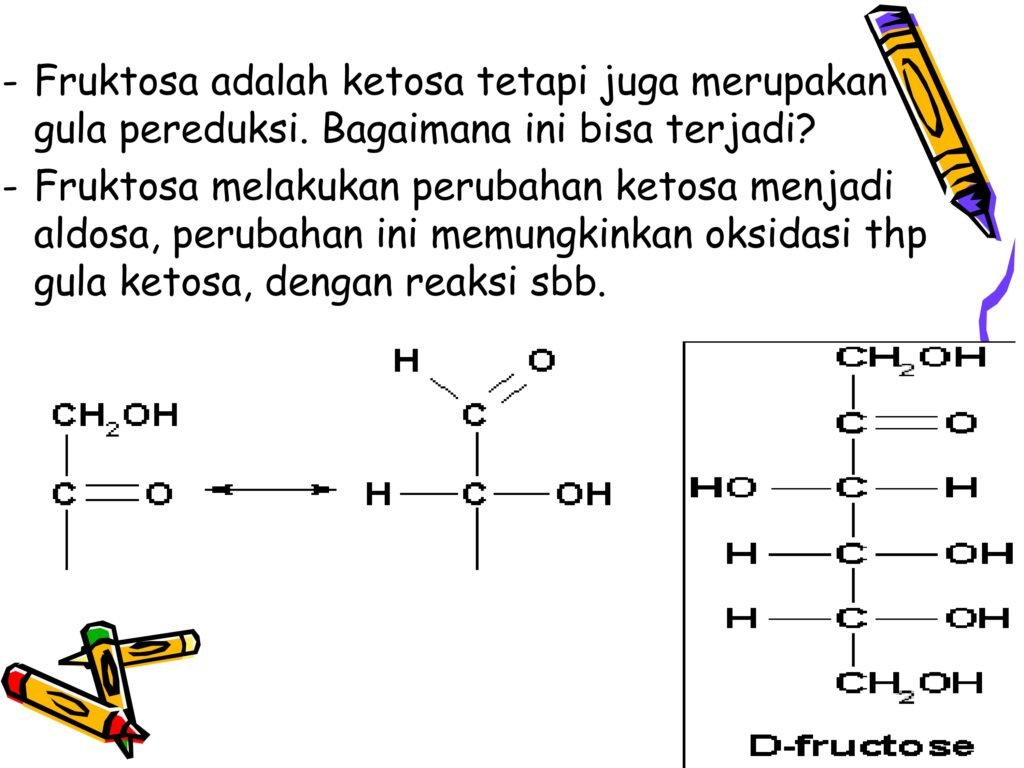
L-monosakarida tidak diakui oleh enzim tubuh, kecuali dalam kasus langka seperti metabolisme L-fruktosa.
6. Implikasi dalam Farmasi dan Bioteknologi
-
Dalam farmasi, pemisahan enansiomer sangat penting karena hanya satu bentuk stereoisomer yang memiliki aktivitas biologis yang diinginkan.
-
Obat dengan atom kiral sering kali memiliki efek farmakologi yang berbeda antara isomer R dan S.
👉 Contoh:
-
Ibuprofen → Bentuk (S)-ibuprofen aktif secara farmakologi, tetapi bentuk (R)-ibuprofen tidak aktif.
-
Talidomid → Salah satu enansiomer memiliki efek terapi, tetapi enansiomer lainnya bersifat teratogenik (menyebabkan cacat lahir).
7. Anotasi Tambahan
-
Jumlah stereoisomer akan meningkat secara eksponensial dengan bertambahnya jumlah pusat kiral karena setiap pusat kiral menciptakan dua kemungkinan konfigurasi (R atau S).
-
Dalam tubuh, stereoisomer spesifik sering kali menunjukkan aktivitas biologis yang sangat berbeda meskipun memiliki rumus kimia yang sama.
-
Dalam desain obat, pemisahan stereoisomer sering kali dilakukan untuk meningkatkan efektivitas dan mengurangi efek samping.
8. Kesimpulan
Slide ini menjelaskan konsep dasar tentang jumlah isomer optik:
-
Jumlah stereoisomer yang mungkin dihitung dengan rumus 2ⁿ, di mana n adalah jumlah pusat kiral.
-
Setiap pusat kiral menciptakan kemungkinan konfigurasi (R) atau (S).
-
Isomer optik terdiri dari enansiomer (gambar cermin) dan diastereomer (bukan gambar cermin).
-
Enzim dan reseptor biologis sangat selektif terhadap konfigurasi stereoisomer tertentu.
30 Syarah (Penjelasan) Slide ke-15
Slide ini membahas tentang Optik Aktif, yaitu kemampuan senyawa untuk memutar bidang cahaya terpolarisasi akibat adanya atom karbon kiral di dalam struktur molekul. Aktivitas optik adalah salah satu sifat utama dari senyawa organik kiral, terutama pada monosakarida dan asam amino.
Dalam biokimia, aktivitas optik memainkan peran penting karena sistem biologis bersifat stereospesifik — enzim, protein, dan reseptor hanya mengenali stereoisomer tertentu. Oleh karena itu, kemampuan untuk memutar cahaya terpolarisasi ke kanan atau ke kiri mempengaruhi pengakuan molekul oleh enzim dan proses metabolisme.
1. Pengertian Optik Aktif
Senyawa dikatakan bersifat optik aktif jika mampu memutar bidang cahaya terpolarisasi ke arah kanan atau kiri.
-
Pemutaran cahaya terjadi karena adanya pusat kiral (atom karbon asimetris) dalam struktur molekul.
-
Cahaya terpolarisasi adalah cahaya yang berosilasi hanya dalam satu bidang.
-
Ketika cahaya terpolarisasi melewati larutan senyawa optik aktif, cahaya tersebut akan diputar dengan sudut tertentu ke kanan atau ke kiri.
👉 Syarat Optik Aktif:
-
Senyawa memiliki atom karbon kiral (atom karbon yang terikat pada empat gugus berbeda).
-
Tidak memiliki bidang simetri internal karena simetri akan menyebabkan pemutaran cahaya terpolarisasi saling meniadakan.
-
Senyawa memiliki konfigurasi spesifik yang menentukan arah pemutaran cahaya.
2. Aktivitas Optik dan Stereoisomerisme
Monosakarida adalah contoh klasik senyawa yang bersifat optik aktif karena memiliki satu atau lebih pusat kiral.
-
Jika senyawa memutar cahaya ke kanan → disebut dextrorotatory (+)
-
Jika senyawa memutar cahaya ke kiri → disebut levorotatory (-)
👉 Contoh:
-
D-Glukosa → memutar cahaya ke kanan → bersifat dextrorotatory
-
L-Glukosa → memutar cahaya ke kiri → bersifat levorotatory
👉 Implikasi Biologis:
-
Dalam sistem biologis, hanya D-monosakarida dan L-asam amino yang aktif secara biologis.
-
Bentuk L-glukosa tidak dapat digunakan dalam metabolisme karena enzim hanya mengenali konfigurasi D-glukosa.
3. Fischer Projection dan Notasi D/L
Emil Fischer memperkenalkan sistem notasi D/L untuk menentukan konfigurasi molekul kiral berdasarkan hubungannya dengan D-gliseraldehida.
-
Jika gugus hidroksil (-OH) pada karbon kiral terakhir berada di kanan → termasuk golongan D
-
Jika gugus hidroksil (-OH) pada karbon kiral terakhir berada di kiri → termasuk golongan L
Perbedaan D/L dan (+)/(-)
-
Notasi D/L → Berdasarkan hubungan dengan gliseraldehida sebagai molekul referensi.
-
Notasi (+)/(-) → Berdasarkan arah pemutaran cahaya terpolarisasi.
-
D-glukosa bersifat (+) → memutar cahaya ke kanan.
-
L-glukosa bersifat (-) → memutar cahaya ke kiri.
-
👉 Catatan:
-
Sebagian besar karbohidrat yang digunakan dalam sistem biologis adalah dalam bentuk D.
-
Sebagian besar asam amino yang aktif secara biologis adalah dalam bentuk L.
4. Peran Optik Aktif dalam Biologi
a) Karbohidrat
-
Glukosa adalah monosakarida utama dalam metabolisme energi.
-
Enzim glukokinase hanya mengenali D-glukosa dan tidak mengenali L-glukosa.
-
Dalam tumbuhan dan hewan, D-monosakarida adalah bentuk yang digunakan dalam metabolisme.
b) Asam Amino
-
Sebagian besar asam amino dalam protein adalah L-asam amino.
-
Ribosom hanya mengenali L-asam amino selama sintesis protein.
-
D-asam amino biasanya ditemukan di dinding sel bakteri dan tidak digunakan dalam metabolisme manusia.
c) Nukleotida dan DNA/RNA
-
Ribosa dan deoksiribosa dalam DNA dan RNA adalah D-ribosa.
-
D-ribosa dalam RNA membentuk ikatan fosfodiester untuk menyusun rantai nukleotida.
👉 Implikasi Biologis:
-
Jika terjadi kesalahan konfigurasi stereoisomer dalam asam amino atau nukleotida, maka struktur dan fungsi biologis akan terganggu.
-
Misalnya, perubahan konfigurasi dari D-ribosa menjadi L-ribosa akan menyebabkan kegagalan dalam sintesis RNA dan DNA.
5. Penjelasan Istilah dalam Slide
-
Dapat memutar bidang terpotong
-
Senyawa yang bersifat optik aktif memiliki kemampuan memutar cahaya terpolarisasi ke arah kanan atau kiri karena adanya atom karbon kiral.
-
-
Monosakarida berisi sedikitnya satu atom kiral
-
Atom karbon kiral adalah prasyarat utama bagi aktivitas optik.
-
Contoh:
-
Gliseraldehida memiliki satu atom karbon kiral → memiliki dua stereoisomer (+) dan (-).
-
Glukosa memiliki empat atom karbon kiral → memiliki 16 stereoisomer.
-
-
-
Setiap monosakarida berada pada bentuk molekul yang merupakan cermin satu sama lain
-
Stereoisomer monosakarida dapat membentuk pasangan enansiomer (gambar cermin).
-
-
Fischer merumuskan tanda D dan L
-
Notasi D dan L berdasarkan orientasi gugus hidroksil (-OH) pada karbon kiral terakhir.
-
-
Glukosa umum memutar ke kanan (D-glukosa), sebagian kecil memutar ke kiri (L-glukosa)
-
D-glukosa adalah bentuk biologis aktif dan digunakan dalam metabolisme.
-
L-glukosa tidak diakui oleh enzim metabolisme karena orientasi spasialnya berbeda.
-
6. Contoh Perbedaan D dan L dalam Biologi
| Molekul | Bentuk Aktif | Arah Pemutaran | Aktivitas Biologis |
|---|---|---|---|
| Glukosa | D-Glukosa | (+) ke kanan | Aktif (sumber energi utama) |
| Fruktosa | D-Fruktosa | (-) ke kiri | Aktif (dimetabolisme di hati) |
| Alanin | L-Alanin | (-) ke kiri | Digunakan dalam sintesis protein |
| Ribosa | D-Ribosa | (+) ke kanan | Komponen RNA dan ATP |
👉 Implikasi Biologis:
-
Bentuk D-glukosa adalah substrat utama untuk jalur glikolisis dalam metabolisme energi.
-
Enzim dalam tubuh manusia sangat selektif → hanya mengenali stereoisomer spesifik (D atau L).
7. Anotasi Tambahan
-
Konfigurasi D/L hanya menunjukkan hubungan stereoisomer terhadap gliseraldehida dan tidak selalu terkait dengan arah pemutaran cahaya.
-
Jika suatu molekul memiliki lebih dari satu atom karbon kiral, maka molekul tersebut dapat memiliki beberapa pasangan diastereomer.
-
Dalam proses metabolisme, enzim hanya mampu mengenali konfigurasi stereoisomer tertentu karena adanya komplemen struktural pada situs aktif enzim.
8. Kesimpulan
Slide ini menjelaskan konsep dasar tentang optik aktif dalam stereoisomerisme:
-
Senyawa optik aktif mampu memutar cahaya terpolarisasi karena memiliki atom karbon kiral.
-
Fischer memperkenalkan notasi D/L untuk konfigurasi stereoisomer.
-
Bentuk D-glukosa adalah konfigurasi yang dikenali dalam metabolisme tubuh.
-
Perbedaan stereoisomer menyebabkan perbedaan dalam pengenalan oleh enzim dan reseptor biologis.
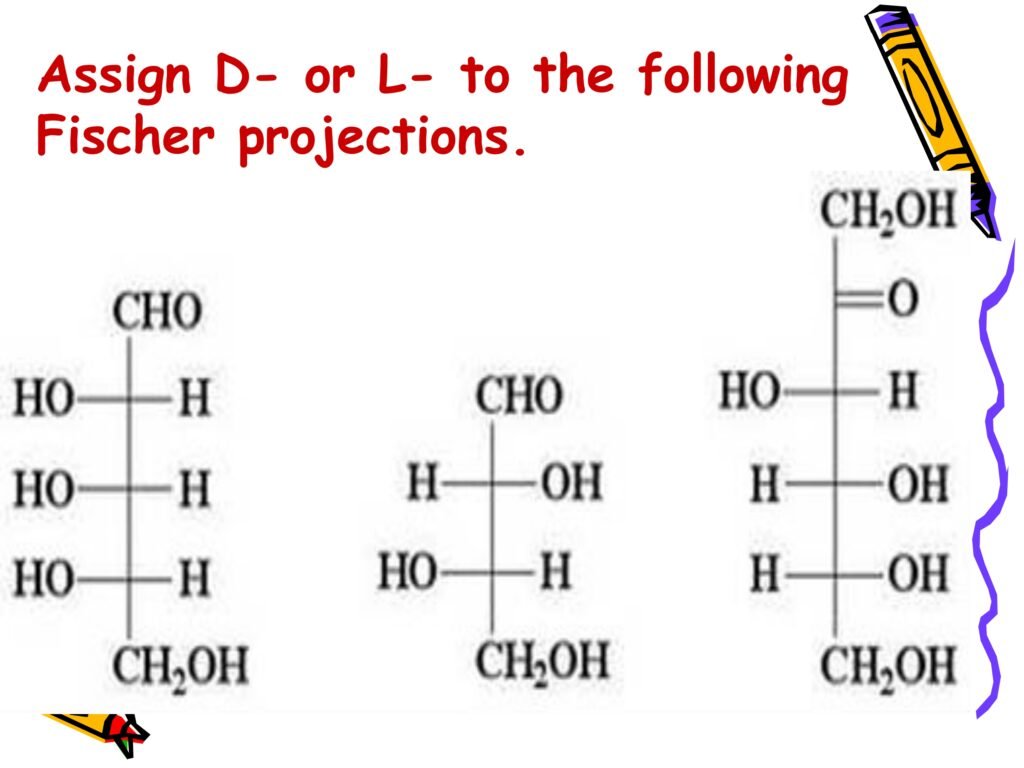
32 Syarah (Penjelasan) Slide ke-16
Slide ini membahas tentang konfigurasi D dan L pada monosakarida, khususnya pada ribosa dan glukosa. Konsep D dan L dalam stereoisomerisme monosakarida diperkenalkan oleh Emil Fischer berdasarkan hubungan dengan stereoisomer gliseraldehida. Konfigurasi ini sangat penting dalam biokimia karena menentukan apakah senyawa tersebut dapat dikenali dan digunakan dalam jalur metabolisme oleh enzim dalam tubuh.
Monosakarida yang memiliki konfigurasi D adalah yang digunakan secara alami dalam proses metabolisme tubuh, sedangkan bentuk L biasanya tidak dikenali oleh enzim metabolisme. Dalam konteks biologi, konfigurasi ini mempengaruhi kelarutan, interaksi dengan enzim, dan aktivitas biologis dari senyawa tersebut.
1. Penentuan Konfigurasi D dan L pada Monosakarida
Penentuan konfigurasi D atau L pada monosakarida didasarkan pada posisi gugus hidroksil (-OH) pada atom karbon kiral terakhir (karbon asimetris yang terjauh dari gugus aldehid atau keton) dalam proyeksi Fischer:
-
Jika gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kanan → konfigurasi D
-
Jika gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kiri → konfigurasi L
👉 Penentuan konfigurasi ini berlaku untuk semua monosakarida, termasuk aldosa (seperti glukosa, galaktosa, ribosa) dan ketosa (seperti fruktosa).
2. Struktur yang Ditunjukkan dalam Slide
Pada slide terdapat empat struktur monosakarida:
a) L-Ribosa
-
Gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kiri → konfigurasi L
-
L-ribosa adalah stereoisomer dari D-ribosa
-
L-ribosa jarang ditemukan di alam dan tidak dikenali oleh enzim dalam metabolisme.
b) L-Glukosa
-
Gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kiri → konfigurasi L
-
L-glukosa jarang ditemukan di alam dan tidak dimetabolisme oleh enzim tubuh karena tubuh hanya mengenali D-glukosa.
-
L-glukosa memiliki sifat fisik dan kimia yang mirip dengan D-glukosa tetapi tidak aktif secara biologis.
c) D-Ribosa
-
Gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kanan → konfigurasi D
-
D-ribosa adalah komponen utama dalam RNA dan nukleotida seperti ATP dan NADH.
-
Ribosa dalam bentuk D dikenali oleh enzim polimerase dalam sintesis RNA dan DNA.
d) D-Glukosa
-
Gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kanan → konfigurasi D
-
D-glukosa adalah sumber energi utama dalam metabolisme melalui jalur glikolisis dan siklus Krebs.
-
Bentuk D-glukosa adalah substrat utama dalam jalur metabolisme karbohidrat di dalam tubuh.
3. Implikasi Biologis Konfigurasi D dan L
a) Karbohidrat
-
Sebagian besar karbohidrat yang ditemukan dalam sistem biologis adalah dalam bentuk D.
-
D-glukosa → Dikenali dan digunakan dalam metabolisme energi.
-
L-glukosa → Tidak dikenali oleh enzim glukokinase dan tidak dimetabolisme oleh tubuh.
-
D-fruktosa → Digunakan dalam metabolisme fruktosa di hati melalui jalur khusus.
b) Asam Amino
-
Sebagian besar asam amino dalam protein memiliki konfigurasi L.
-
Ribosom hanya mengenali L-asam amino untuk sintesis protein.
-
D-asam amino → Jarang ditemukan dalam protein, tetapi dapat ditemukan dalam dinding sel bakteri.
c) Nukleotida dan DNA/RNA
-
Ribosa dalam RNA dan deoksiribosa dalam DNA selalu dalam bentuk D.
-
Nukleotida seperti ATP, GTP, dan NADH mengandung D-ribosa sebagai komponen utama.
4. Perbedaan L dan D pada Monosakarida
| Karakteristik | D-Glukosa | L-Glukosa |
|---|---|---|
| Posisi -OH pada karbon kiral terakhir | Kanan | Kiri |
| Metabolisme | Diakui oleh enzim tubuh → aktif | Tidak diakui oleh enzim tubuh → tidak aktif |
| Sifat biologis | Sumber energi utama | Tidak digunakan dalam metabolisme |
| Peran biologis | Jalur glikolisis dan siklus Krebs | Tidak memiliki peran biologis signifikan |
| Ketersediaan alami | Ditemukan di alam dan pada organisme hidup | Jarang ditemukan di alam |
👉 Catatan:
-
Bentuk D-glukosa adalah bentuk aktif yang digunakan dalam metabolisme tubuh manusia.
-
Bentuk L-glukosa dapat disintesis secara artifisial tetapi tidak dimetabolisme secara alami oleh tubuh.
5. Fischer Projection dan Notasi D/L
-
Dalam proyeksi Fischer, molekul disusun dengan rantai karbon utama vertikal, dan gugus fungsional ditempatkan secara horizontal.
-
Gugus hidroksil (-OH) pada karbon kiral terakhir menentukan apakah senyawa termasuk konfigurasi D atau L.
-
Jika (-OH) ke kanan → D
-
Jika (-OH) ke kiri → L
-
Contoh Fischer Projection pada D-Glukosa:
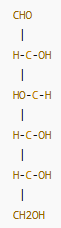
👉 Konfigurasi D → Gugus hidroksil (-OH) pada karbon kiral terakhir berada di kanan.
6. Peran Konfigurasi dalam Aktivitas Biologis
-
Enzim dalam metabolisme karbohidrat → hanya mengenali D-glukosa dan bukan L-glukosa.
-
Ribosom → hanya mengenali L-asam amino dalam sintesis protein.
-
Polimerase → hanya mengenali D-ribosa dalam sintesis DNA dan RNA.
-
Reaksi enzimatik sering kali bergantung pada stereoisomerisme substrat karena spesifisitas situs aktif enzim.
7. Anotasi Tambahan
-
Dalam tubuh manusia, hanya stereoisomer D yang dikenali oleh enzim metabolisme untuk monosakarida dan L untuk asam amino.
-
Diastereomer (bukan enansiomer) memiliki konfigurasi berbeda pada satu atau lebih pusat kiral tetapi tidak merupakan gambar cermin.
-
Konfigurasi stereoisomer menentukan aktivitas biologis karena spesifisitas enzim terhadap substrat.
8. Kesimpulan
Slide ini menjelaskan perbedaan antara konfigurasi D dan L pada monosakarida:
-
Penentuan konfigurasi D/L didasarkan pada posisi gugus hidroksil pada karbon kiral terakhir dalam proyeksi Fischer.
-
Sebagian besar karbohidrat dalam sistem biologis adalah dalam bentuk D.
-
Sebagian besar asam amino dalam sistem biologis adalah dalam bentuk L.
-
Perbedaan konfigurasi D dan L menyebabkan perbedaan dalam aktivitas biologis, interaksi dengan enzim, dan metabolisme.
34 Syarah (Penjelasan) Slide ke-17
Slide ini membahas tentang penentuan konfigurasi D atau L pada proyeksi Fischer untuk monosakarida. Penentuan konfigurasi D atau L dalam proyeksi Fischer adalah prinsip dasar dalam stereokimia karbohidrat. Emil Fischer mengembangkan metode ini untuk menggambarkan konfigurasi tiga dimensi molekul dalam bentuk dua dimensi, yang sangat berguna dalam memahami stereoisomerisme pada karbohidrat dan asam amino.
1. Prinsip Penentuan Konfigurasi D dan L pada Fischer Projection
Penentuan konfigurasi D atau L pada monosakarida dilakukan berdasarkan posisi gugus hidroksil (-OH) pada karbon kiral terakhir dalam proyeksi Fischer.
👉 Aturan dasar:
-
Jika gugus hidroksil (-OH) pada karbon kiral terakhir (karbon yang paling jauh dari gugus aldehid atau keton) terletak di kanan → konfigurasi D
-
Jika gugus hidroksil (-OH) pada karbon kiral terakhir terletak di kiri → konfigurasi L
👉 Penting:
-
Konfigurasi D atau L tidak selalu berhubungan dengan arah pemutaran cahaya terpolarisasi.
-
Sebagian besar karbohidrat alami adalah dalam konfigurasi D.
-
Sebagian besar asam amino alami adalah dalam konfigurasi L.
2. Analisis Proyeksi Fischer dalam Slide
Terdapat tiga proyeksi Fischer pada slide yang menunjukkan struktur monosakarida. Berikut ini adalah analisis dari masing-masing proyeksi berdasarkan posisi gugus hidroksil (-OH) pada karbon kiral terakhir:
a) Struktur 1 (kiri)
-
Rumus struktur menunjukkan bahwa gugus hidroksil pada karbon kiral terakhir (karbon ke-4) terletak di kiri.
-
Berdasarkan aturan Fischer → konfigurasi L
-
Jadi, struktur ini adalah L-glukosa atau L-monosakarida.
b) Struktur 2 (tengah)
-
Rumus struktur menunjukkan bahwa gugus hidroksil pada karbon kiral terakhir terletak di kanan.
-
Berdasarkan aturan Fischer → konfigurasi D
-
Jadi, struktur ini adalah D-glukosa atau D-monosakarida.
c) Struktur 3 (kanan)
-
Struktur ini adalah proyeksi Fischer dari ketosa (karena terdapat gugus keton).
-
Gugus hidroksil pada karbon kiral terakhir terletak di kanan.
-
Berdasarkan aturan Fischer → konfigurasi D
-
Jadi, struktur ini adalah D-fruktosa.
👉 Ringkasan Identifikasi Struktur:
| No. | Struktur | Konfigurasi |
|---|---|---|
| 1 | L-glukosa | L |
| 2 | D-glukosa | D |
| 3 | D-fruktosa | D |
3. Penjelasan Detail Proyeksi Fischer
a) Posisi Gugus Hidroksil
Dalam proyeksi Fischer, karbon utama (karbon aldehid atau karbon keton) selalu diletakkan di bagian atas:
-
Gugus karbonil (CHO atau CO) → diletakkan di bagian atas.
-
Rantai karbon utama → dituliskan secara vertikal.
-
Gugus samping → ditempatkan secara horizontal.
👉 Jika -OH pada karbon kiral terakhir di kanan → D
👉 Jika -OH pada karbon kiral terakhir di kiri → L
b) Konfigurasi D dan L pada Monosakarida Umum
-
D-Glukosa
-
Gugus hidroksil pada karbon ke-4 berada di kanan.
-
Merupakan stereoisomer yang paling umum di alam dan digunakan dalam metabolisme.
-
L-Glukosa
-
Gugus hidroksil pada karbon ke-4 berada di kiri.
-
Tidak ditemukan secara alami dalam metabolisme tubuh karena enzim metabolisme hanya mengenali D-glukosa.
-
D-Fruktosa
-
Ketosa yang paling umum di alam.
-
Memiliki konfigurasi D karena -OH pada karbon kiral terakhir berada di kanan.
-
Dikenali dan digunakan dalam jalur metabolisme seperti jalur fruktosa di hati.
4. Perbedaan Konfigurasi D dan L dalam Aktivitas Biologis
a) D-Glukosa vs L-Glukosa
-
D-glukosa → Substrat utama dalam jalur glikolisis → diakui oleh enzim seperti glukokinase dan heksokinase.
-
L-glukosa → Tidak digunakan dalam metabolisme karena enzim metabolisme hanya mengenali stereoisomer D.
b) D-Ribosa vs L-Ribosa
-
D-ribosa → Komponen utama dalam RNA, ATP, dan NADH.
-
L-ribosa → Jarang ditemukan dalam sistem biologis.
c) D-Fruktosa
-
D-fruktosa → Dimetabolisme di hati melalui jalur fruktosa-1-fosfat.
-
L-fruktosa → Tidak diakui oleh enzim fruktokinase → tidak aktif secara metabolik.
5. Tabel Perbandingan D dan L pada Karbohidrat
| Karakteristik | D-Glukosa | L-Glukosa | D-Fruktosa |
|---|---|---|---|
| Posisi -OH pada karbon kiral terakhir | Kanan | Kiri | Kanan |
| Metabolisme | Aktif dalam metabolisme | Tidak aktif dalam metabolisme | Aktif dalam jalur fruktosa |
| Pengakuan oleh enzim | Diakui oleh glukokinase | Tidak diakui oleh glukokinase | Diakui oleh fruktokinase |
| Peran biologis | Sumber energi utama | Tidak memiliki peran | Sumber energi sekunder |
| Kelimpahan di alam | Umum di alam | Jarang ditemukan | Umum di buah-buahan |
6. Fischer Projection vs Aktivitas Optik
-
Konfigurasi D/L menunjukkan orientasi spasial, tetapi tidak selalu berhubungan dengan aktivitas optik (+) atau (-).
-
Sebagai contoh:
-
D-glukosa → memutar cahaya ke kanan → (+)
-
D-fruktosa → memutar cahaya ke kiri → (-)
-
👉 Penjelasan:
-
Konfigurasi D atau L hanya menggambarkan hubungan stereoisomerik terhadap gliseraldehida.
-
Aktivitas optik (+) atau (-) ditentukan melalui eksperimen dengan polarimeter.
7. Anotasi Tambahan
-
Karbohidrat dalam metabolisme → hanya bentuk D yang dikenali oleh enzim tubuh.
-
Asam amino dalam protein → hanya bentuk L yang dikenali oleh ribosom untuk sintesis protein.
-
Diastereomer → jika dua stereoisomer memiliki lebih dari satu pusat kiral tetapi bukan merupakan gambar cermin satu sama lain.
8. Kesimpulan
Slide ini menjelaskan konsep dasar penentuan konfigurasi D dan L pada monosakarida dalam proyeksi Fischer:
-
Konfigurasi D atau L ditentukan oleh posisi gugus hidroksil pada karbon kiral terakhir.
-
D-glukosa adalah bentuk utama dalam metabolisme, sedangkan L-glukosa tidak aktif secara biologis.
-
Aktivitas biologis sangat bergantung pada stereoisomerisme karena enzim dalam tubuh hanya mengenali stereoisomer tertentu.
-
Perbedaan konfigurasi D dan L mempengaruhi pengenalan enzim dan efektivitas dalam metabolisme.
👉 Pemahaman tentang konfigurasi D dan L penting dalam metabolisme, nutrisi, dan desain obat.
36 Syarah (Penjelasan) Slide ke-18
Slide ini membahas tentang struktur siklis monosakarida, khususnya mengenai pembentukan hemi-asetal sebagai hasil reaksi intramolekuler antara gugus aldehid atau keton dengan gugus hidroksil (alkohol) dalam molekul yang sama. Dalam konteks monosakarida, reaksi ini menghasilkan struktur cincin yang dikenal sebagai piranosa (jika terdiri dari enam anggota cincin) atau furanosa (jika terdiri dari lima anggota cincin).
1. Pengertian Hemi-Asetal
Hemi-asetal adalah senyawa organik yang terbentuk melalui reaksi antara:
-
Gugus aldehid (–CHO) → kelompok karbonil pada posisi ujung rantai karbon monosakarida.
-
Gugus hidroksil (–OH) → gugus alkohol yang terdapat pada rantai karbon yang sama dalam molekul monosakarida.
👉 Reaksi yang terjadi:
-
Gugus karbonil (aldehid atau keton) berperan sebagai elektrofil.
-
Gugus hidroksil (–OH) berperan sebagai nukleofil.
-
Serangan nukleofilik menghasilkan ikatan antara atom karbon karbonil dan atom oksigen dari gugus hidroksil → membentuk hemi-asetal.
Reaksi Umum:
Aldehid+Alkohol⇌Hemi-asetal\text{Aldehid} + \text{Alkohol} \rightleftharpoons \text{Hemi-asetal}Aldehid+Alkohol⇌Hemi-asetal
Reaksi ini reversibel, sehingga dalam larutan, monosakarida selalu berada dalam keseimbangan antara bentuk rantai lurus (linear) dan bentuk siklis (hemi-asetal).
Struktur Reaksi pada Slide:
-
R1–C=O = Gugus aldehid
-
HO–R2 = Gugus hidroksil
-
Hasil reaksi membentuk hemi-asetal dengan struktur:
R1−C(H)(OH)−O−R2R1 - C(H)(OH) - O - R2R1−C(H)(OH)−O−R2
-
Gugus hidroksil (-OH) pada karbon hemi-asetal ini bersifat reaktif dan dapat terlibat dalam pembentukan struktur glikosida.
2. Mekanisme Pembentukan Hemi-Asetal pada Monosakarida
Monosakarida seperti glukosa, fruktosa, dan galaktosa umumnya berada dalam bentuk siklis dalam larutan karena kestabilan konformasi cincin. Proses pembentukan hemi-asetal pada monosakarida adalah sebagai berikut:
-
Serangan Nukleofilik
Gugus hidroksil (-OH) pada karbon ke-5 dalam glukosa menyerang gugus karbonil (aldehid) pada karbon ke-1. -
Pembentukan Ikatan Kovalen
Ikatan kovalen terbentuk antara atom karbon karbonil dan atom oksigen dari gugus hidroksil. -
Proton Transfer
Proton (H⁺) berpindah, menghasilkan gugus hidroksil (-OH) pada karbon anomerik. -
Hasil Akhir
Terbentuk struktur cincin siklik → hemi-asetal (disebut glukopiranosa jika berbentuk cincin beranggota enam).
👉 Struktur Hemi-Asetal:
-
Hemi-asetal terdiri dari satu gugus hidroksil (-OH) dan satu gugus eter (-O-) yang terikat pada karbon anomerik.
3. Tipe Hemi-Asetal dalam Monosakarida
Monosakarida dapat membentuk dua tipe struktur cincin berdasarkan ukuran cincin yang dihasilkan:
a) Piranosa
-
Terbentuk dari reaksi antara gugus aldehid dan gugus hidroksil → menghasilkan cincin beranggota enam.
-
Contoh:
-
Glukosa → membentuk glukopiranosa
-
Galaktosa → membentuk galaktopiranosa
-
b) Furanosa
-
Terbentuk dari reaksi antara gugus keton dan gugus hidroksil → menghasilkan cincin beranggota lima.
-
Contoh:
-
Fruktosa → membentuk fruktofuranosa
-
4. Anomer α dan β pada Hemi-Asetal
Karena pembentukan cincin menciptakan pusat kiral baru (karbon anomerik), monosakarida dalam bentuk siklik dapat menghasilkan dua stereoisomer yang disebut anomer:
-
α-anomer → Gugus hidroksil (-OH) pada karbon anomerik berada di bawah bidang cincin (dalam proyeksi Haworth).
-
β-anomer → Gugus hidroksil (-OH) pada karbon anomerik berada di atas bidang cincin (dalam proyeksi Haworth).
👉 Contoh:
-
α-D-Glukosa → Gugus -OH pada karbon anomerik di bawah bidang cincin.
-
β-D-Glukosa → Gugus -OH pada karbon anomerik di atas bidang cincin.
5. Peran Biologis Hemi-Asetal dalam Metabolisme
Pembentukan struktur hemi-asetal sangat penting dalam biologi karena:
✅ Struktur cincin (piranosa/furanosa) adalah bentuk aktif yang dikenali oleh enzim.
✅ Glukosa dalam metabolisme glikolisis dan siklus Krebs selalu dalam bentuk siklik.
✅ Pembentukan glikosida (ikatan antara dua monosakarida) melibatkan gugus hemi-asetal pada monosakarida.
✅ Dalam sel, glukosa diubah menjadi glukosa-6-fosfat (dalam bentuk siklis) sebelum masuk jalur metabolisme.
6. Perbedaan Hemi-Asetal dan Asetal
| Karakteristik | Hemi-Asetal | Asetal |
|---|---|---|
| Komponen Penyusun | Aldehid + Alkohol | Hemi-Asetal + Alkohol |
| Struktur | Gugus hidroksil (-OH) dan gugus eter (-O-) pada karbon anomerik | Dua gugus eter (-O-) pada karbon anomerik |
| Stabilitas | Tidak stabil → reversibel | Stabil → tidak reversibel |
| Contoh | Glukosa (α-D-glukopiranosa) | Maltosa, sukrosa, laktosa |
| Reaktivitas | Reaktif terhadap oksidasi | Tidak reaktif terhadap oksidasi |
👉 Hemi-asetal → Bersifat reversibel dalam larutan.
👉 Asetal → Bersifat stabil karena melibatkan ikatan kovalen ganda.
7. Reaksi Lanjutan dari Hemi-Asetal
Jika molekul hemi-asetal bereaksi dengan alkohol lain, maka akan terbentuk asetal.
Hemi-asetal+Alkohol→Asetal\text{Hemi-asetal} + \text{Alkohol} \rightarrow \text{Asetal}Hemi-asetal+Alkohol→Asetal
Contoh:
-
Glukosa (hemi-asetal) + metanol → metil glukosida (asetal)
-
Glukosa + fruktosa → sukrosa (disakarida berbasis asetal)
8. Anotasi Tambahan
-
Dalam larutan, monosakarida selalu berada dalam keseimbangan dinamis antara bentuk rantai lurus dan bentuk siklik.
-
Dalam metabolisme, bentuk siklik lebih stabil dan lebih mudah dikenali oleh enzim.
-
Struktur cincin yang lebih stabil adalah bentuk piranosa karena regangan sudutnya lebih kecil dibandingkan furanosa.
9. Kesimpulan
Slide ini menjelaskan konsep dasar tentang struktur siklis monosakarida:
-
Monosakarida membentuk cincin melalui reaksi antara gugus aldehid atau keton dengan gugus hidroksil.
-
Produk yang terbentuk adalah hemi-asetal (piranosa atau furanosa).
-
Hemi-asetal bersifat reaktif dan dapat mengalami reaksi lanjutan untuk membentuk asetal.
-
Dalam metabolisme, bentuk siklis lebih stabil dan lebih mudah dikenali oleh enzim metabolik.
👉 Pemahaman tentang struktur hemi-asetal penting dalam metabolisme dan biosintesis karbohidrat.
38 Syarah (Penjelasan) Slide ke-19
Slide ini menjelaskan contoh pembentukan hemi-asetal dalam konteks struktur monosakarida, khususnya dalam pembentukan struktur siklis (piranosa atau furanosa) dari bentuk rantai terbuka (linear). Proses ini adalah salah satu reaksi kimia dasar yang memungkinkan monosakarida untuk membentuk struktur cincin yang stabil dalam larutan.
1. Konsep Dasar Pembentukan Hemi-Asetal
Hemi-asetal adalah senyawa yang terbentuk melalui reaksi antara:
-
Gugus aldehid atau keton pada monosakarida.
-
Gugus hidroksil (–OH) pada karbon lain dalam molekul yang sama.
👉 Karakteristik reaksi:
-
Reaksi ini adalah intra-molekuler (terjadi di dalam molekul yang sama).
-
Membentuk struktur siklik yang lebih stabil dibandingkan bentuk rantai terbuka.
-
Struktur hasil berupa cincin lima (furanosa) atau enam anggota (piranosa).
-
Produk reaksi berupa hemi-asetal → memiliki gugus hidroksil (–OH) dan gugus eter (–O–) pada karbon anomerik.
2. Reaksi Hemi-Asetal dalam Monosakarida
Dalam contoh pada slide, pembentukan hemi-asetal melibatkan reaksi antara gugus aldehid pada ujung rantai karbon dengan gugus hidroksil pada karbon lain dalam molekul yang sama.
👉 Reaksi yang terjadi:
-
Gugus aldehid (–CHO) bersifat elektrofilik → mudah diserang oleh nukleofil.
-
Gugus hidroksil (–OH) pada karbon dalam rantai bertindak sebagai nukleofil.
-
Reaksi membentuk ikatan kovalen antara atom karbon aldehid dan atom oksigen dari gugus hidroksil.
-
Hasilnya adalah struktur cincin yang disebut hemi-asetal.
👉 Reaksi yang diperlihatkan pada slide:
-
Struktur di sebelah kanan adalah hasil reaksi → membentuk cincin stabil (piranosa atau furanosa).
-
Gugus hidroksil (-OH) pada karbon anomerik adalah ciri khas hemi-asetal.
Reaksi Umum:
Aldehid+Alkohol⇌Hemi-asetal\text{Aldehid} + \text{Alkohol} \rightleftharpoons \text{Hemi-asetal}Aldehid+Alkohol⇌Hemi-asetal
3. Penjelasan Struktur pada Slide
Pada slide ditunjukkan dua struktur:
-
Struktur Rantai Terbuka (Linear):
-
Gugus karbonil (–CHO) pada ujung molekul.
-
Gugus hidroksil (-OH) di beberapa karbon sepanjang rantai.
-
Struktur ini adalah bentuk glukosa dalam keadaan larutan sebelum terjadi reaksi siklisasi.
-
-
Struktur Siklis (Hemi-Asetal):
-
Gugus karbonil (–CHO) telah bereaksi dengan gugus hidroksil → membentuk ikatan hemi-asetal.
-
Terbentuk struktur cincin lima (furanosa) atau enam (piranosa).
-
Gugus hidroksil baru pada karbon anomerik dapat berada dalam konfigurasi α atau β.
-
👉 Hasil Reaksi:
-
Jika cincin beranggota enam → disebut piranosa (contoh: glukosa).
-
Jika cincin beranggota lima → disebut furanosa (contoh: fruktosa).
-
Produk reaksi tetap dalam keseimbangan dengan bentuk rantai terbuka di dalam larutan.
4. Tipe Struktur Siklis Berdasarkan Jumlah Anggota Cincin
a) Piranosa
-
Terbentuk jika reaksi antara gugus aldehid dan hidroksil menghasilkan cincin beranggota enam.
-
Contoh:
-
α-D-glukopiranosa dan β-D-glukopiranosa
-
Struktur lebih stabil karena sudut antar ikatan mendekati sudut ikatan tetrahedral (109,5°).
-
b) Furanosa
-
Terbentuk jika reaksi antara gugus keton dan hidroksil menghasilkan cincin beranggota lima.
-
Contoh:
-
D-fruktofuranosa
-
Struktur kurang stabil dibandingkan piranosa karena sudut antar ikatan lebih kecil → regangan cincin lebih tinggi.
-
5. Perbedaan α dan β pada Hemi-Asetal
Karena terbentuknya pusat kiral baru (karbon anomerik) saat reaksi hemi-asetal terjadi, monosakarida dalam bentuk cincin dapat membentuk dua stereoisomer (anomer):
-
α-anomer → Gugus hidroksil pada karbon anomerik berada di bawah bidang cincin (dalam proyeksi Haworth).
-
β-anomer → Gugus hidroksil pada karbon anomerik berada di atas bidang cincin (dalam proyeksi Haworth).
👉 Contoh pada glukosa:
-
α-D-glukosa → Gugus hidroksil pada karbon anomerik di bawah cincin.
-
β-D-glukosa → Gugus hidroksil pada karbon anomerik di atas cincin.
Konversi α ↔ β (Mutarotasi):
-
Anomer α dan β dapat saling berubah bentuk dalam larutan → dikenal sebagai mutarotasi.
-
Keseimbangan dipengaruhi oleh pH dan suhu.
-
Pada glukosa, bentuk β lebih stabil (66%) dibandingkan α (34%) karena interaksi sterik yang lebih kecil.
6. Peran Hemi-Asetal dalam Proses Biologis
Hemi-asetal memainkan peran penting dalam berbagai proses biologis:
✅ Bentuk siklik monosakarida (piranosa dan furanosa) adalah bentuk yang diakui oleh enzim dalam metabolisme.
✅ Oligosakarida dan polisakarida (seperti selulosa dan pati) tersusun dari monosakarida dalam bentuk hemi-asetal.
✅ Pembentukan hemi-asetal adalah langkah awal dalam pembentukan ikatan glikosidik → dasar dalam sintesis disakarida dan polisakarida.
7. Anotasi Tambahan
-
Struktur cincin enam (piranosa) lebih stabil daripada cincin lima (furanosa) karena minimnya regangan sudut.
-
Pembentukan hemi-asetal bersifat reversibel → dalam larutan, monosakarida terus berada dalam keseimbangan antara bentuk siklik dan rantai terbuka.
-
Bentuk hemi-asetal sangat penting dalam pengenalan substrat oleh enzim dalam jalur metabolisme karbohidrat.
8. Perbedaan Hemi-Asetal dan Asetal
| Karakteristik | Hemi-Asetal | Asetal |
|---|---|---|
| Komponen Penyusun | Aldehid + Alkohol | Hemi-asetal + Alkohol |
| Struktur | Gugus hidroksil (-OH) dan gugus eter (-O-) pada karbon anomerik | Dua gugus eter (-O-) pada karbon anomerik |
| Stabilitas | Tidak stabil → reversibel | Stabil → tidak reversibel |
| Reaktivitas | Dapat berinteraksi lebih lanjut | Lebih sulit bereaksi |
9. Kesimpulan
Slide ini menjelaskan mekanisme pembentukan hemi-asetal melalui reaksi intramolekuler antara gugus aldehid dan hidroksil pada monosakarida:
-
Proses ini menghasilkan struktur cincin yang disebut piranosa atau furanosa.
-
Struktur cincin dalam monosakarida lebih stabil dibandingkan bentuk rantai terbuka.
-
Terbentuknya karbon anomerik menciptakan dua stereoisomer (α dan β) → menyebabkan mutarotasi dalam larutan.
-
Hemi-asetal adalah bentuk aktif yang dikenali oleh enzim dalam metabolisme karbohidrat.
👉 Pemahaman tentang struktur hemi-asetal sangat penting dalam metabolisme dan biosintesis karbohidrat.
40 Syarah (Penjelasan) Slide ke-20
Slide ini membahas tentang pembentukan hemiketal yang merupakan reaksi antara gugus keton dan gugus hidroksil (alkohol) dalam molekul yang sama atau berbeda. Pembentukan hemiketal ini merupakan dasar untuk siklisasi monosakarida ketosa seperti fruktosa, yang menghasilkan struktur cincin yang disebut furanosa.
1. Pengertian Hemiketal
Hemiketal adalah senyawa turunan yang terbentuk karena adanya reaksi antara gugus keton (C=O) dengan gugus hidroksil (–OH) dalam satu molekul atau antar molekul berbeda.
👉 Karakteristik reaksi:
-
Reaksi terjadi antara gugus karbonil pada keton dan gugus hidroksil pada alkohol.
-
Reaksi bersifat reversibel dan membentuk cincin stabil dalam larutan.
-
Produk yang dihasilkan adalah struktur dengan gugus hidroksil (–OH) dan gugus eter (–O–) pada karbon pusat (karbon anomerik).
-
Jika terjadi secara intramolekuler (dalam satu molekul), akan menghasilkan cincin lima anggota (furanosa).
Reaksi Umum Hemiketal:
Keton+Alkohol⇌Hemiketal\text{Keton} + \text{Alkohol} \rightleftharpoons \text{Hemiketal}Keton+Alkohol⇌Hemiketal
Reaksi pada Slide:
-
R1–C=O–R2 = Gugus keton
-
HO–R3 = Gugus alkohol
-
Hasil → Struktur hemiketal dengan adanya gugus hidroksil (-OH) dan gugus eter (-O-) pada karbon pusat.
👉 Karakteristik Hemiketal:
-
Gugus –OH dan –O– terikat pada karbon yang sama → disebut karbon anomerik.
-
Terjadi pada monosakarida ketosa seperti fruktosa dalam bentuk furanosa.
2. Proses Pembentukan Hemiketal dalam Monosakarida
Pembentukan hemiketal terjadi pada monosakarida dengan gugus keton (ketosa), seperti fruktosa. Proses ini mirip dengan pembentukan hemi-asetal pada aldosa, tetapi gugus karbonil yang terlibat adalah gugus keton (C=O), bukan gugus aldehid.
Mekanisme Pembentukan Hemiketal:
-
Serangan Nukleofilik:
Gugus hidroksil (-OH) dari alkohol menyerang gugus karbonil dari keton → membentuk ikatan kovalen antara atom karbon karbonil dan oksigen dari gugus hidroksil. -
Pembentukan Ikatan Kovalen:
Ikatan kovalen baru terbentuk antara karbon karbonil dan gugus oksigen. -
Proton Transfer:
Proton berpindah → menghasilkan gugus hidroksil (-OH) pada karbon anomerik. -
Produk:
Terbentuk cincin lima anggota (furanosa) yang disebut hemiketal.
👉 Contoh:
-
Fruktosa → membentuk hemiketal dalam bentuk D-fruktofuranosa.
-
Struktur ini bersifat dinamis → terjadi keseimbangan antara bentuk siklik dan linear dalam larutan.
3. Perbedaan Hemi-Asetal dan Hemiketal
| Karakteristik | Hemi-Asetal | Hemiketal |
|---|---|---|
| Kelompok Fungsional | Aldehid + Alkohol | Keton + Alkohol |
| Jumlah Gugus Alkoksil | Satu | Satu |
| Posisi Pembentukan | Karbon terminal | Karbon tengah |
| Hasil Cincin | Piranosa (cincin enam) | Furanosa (cincin lima) |
| Contoh | Glukosa → Glukopiranosa | Fruktosa → Fruktofuranosa |
👉 Hemiketal membentuk struktur furanosa (cincin lima anggota) karena gugus keton biasanya berada pada posisi karbon tengah dalam rantai monosakarida.
4. Peran Hemiketal dalam Struktur Monosakarida
a) Fruktosa
-
Fruktosa adalah monosakarida ketosa yang membentuk hemiketal dalam bentuk siklis.
-
Dalam larutan, fruktosa ada dalam keseimbangan antara bentuk rantai terbuka dan cincin lima anggota (fruktofuranosa).
-
Fruktosa lebih stabil dalam bentuk siklik karena struktur furanosa memiliki regangan cincin yang rendah.
b) Anomer pada Fruktosa
-
Seperti glukosa, fruktosa juga memiliki karbon anomerik setelah siklisasi.
-
Gugus hidroksil (-OH) pada karbon anomerik bisa berada dalam posisi:
-
α-fruktosa → Gugus -OH pada karbon anomerik di bawah cincin.
-
β-fruktosa → Gugus -OH pada karbon anomerik di atas cincin.
-
5. Proyeksi Haworth pada Fruktosa
Proyeksi Haworth menunjukkan konfigurasi struktur cincin furanosa dari fruktosa:
-
Gugus karbonil (C=O) membentuk ikatan dengan gugus hidroksil pada karbon ke-5.
-
Hasil → struktur cincin lima anggota (fruktofuranosa).
Contoh:
-
α-D-Fruktosa → Gugus -OH di bawah cincin.
-
β-D-Fruktosa → Gugus -OH di atas cincin.
👉 Keseimbangan antara α dan β terjadi melalui proses mutarotasi dalam larutan.
6. Stabilitas Struktur Hemiketal
a) Furanosa vs Piranosa
-
Struktur furanosa (hemiketal) memiliki regangan cincin yang lebih tinggi dibandingkan piranosa (hemi-asetal).
-
Oleh karena itu, furanosa kurang stabil dibandingkan piranosa dalam kondisi fisiologis.
b) Faktor yang Mempengaruhi Stabilitas Hemiketal:
✅ pH → pH yang ekstrem dapat memecah struktur hemiketal.
✅ Suhu → Pemanasan tinggi dapat menyebabkan dekomposisi.
✅ Konsentrasi → Konsentrasi tinggi mempercepat pembentukan hemiketal.
7. Peran Hemiketal dalam Metabolisme Karbohidrat
-
Fruktosa → Produk metabolisme utama dalam hati melalui jalur fruktosa-1-fosfat.
-
Fruktosa dalam glikolisis → Diubah menjadi fruktosa-6-fosfat dalam bentuk hemiketal sebelum masuk jalur metabolisme.
-
Fruktosa dalam sintesis sukrosa → Fruktosa dalam bentuk hemiketal bereaksi dengan glukosa → membentuk sukrosa (disakarida).
8. Anotasi Tambahan
-
Fruktosa di alam biasanya ditemukan dalam bentuk hemiketal (fruktofuranosa).
-
Dalam larutan, keseimbangan antara bentuk cincin dan linear dipengaruhi oleh pH dan suhu.
-
Stabilitas struktur hemiketal berhubungan langsung dengan ikatan intramolekuler dan regangan sudut cincin.
9. Perbedaan Hemi-Asetal dan Hemiketal dalam Monosakarida
| Karakteristik | Hemi-Asetal (Glukosa) | Hemiketal (Fruktosa) |
|---|---|---|
| Gugus Reaktif | Aldehid | Keton |
| Ukuran Cincin | 6 (Piranosa) | 5 (Furanosa) |
| Posisi Gugus Hidroksil | Karbon terminal | Karbon tengah |
| Stabilitas | Lebih stabil | Kurang stabil |
10. Kesimpulan
Slide ini menjelaskan konsep dasar tentang hemiketal:
-
Hemiketal terbentuk dari reaksi antara keton dan alkohol.
-
Hasil reaksi membentuk cincin lima anggota (furanosa).
-
Dalam konteks monosakarida, fruktosa membentuk hemiketal dalam bentuk D-fruktofuranosa.
-
Hemiketal adalah bentuk aktif yang dikenali oleh enzim dalam metabolisme fruktosa.
-
Perbedaan struktur hemiketal dan hemi-asetal memengaruhi kestabilan dan reaktivitas biologis.
👉 Pemahaman tentang hemiketal penting dalam metabolisme fruktosa dan biosintesis karbohidrat.
42 Syarah (Penjelasan) Slide ke-21
Slide ini adalah judul pengantar untuk materi tentang struktur Haworth yang digunakan untuk merepresentasikan bentuk siklik dari monosakarida (karbohidrat). Struktur Haworth merupakan proyeksi dua dimensi yang menggambarkan bagaimana cincin monosakarida terbentuk setelah mengalami reaksi hemi-asetal atau hemiketal. Pemahaman struktur ini sangat penting dalam biokimia karena struktur cincin adalah bentuk yang paling stabil dan paling banyak ditemukan dalam proses biologis.
1. Pengertian Struktur Haworth
Struktur Haworth adalah representasi struktur siklik dari monosakarida yang disajikan dalam bentuk cincin. Struktur ini menggambarkan cincin monosakarida dalam bentuk perspektif planar untuk memudahkan visualisasi posisi atom-atom dan gugus fungsional dalam molekul.
👉 Struktur Haworth dikembangkan oleh Norman Haworth (1937) untuk menjelaskan konformasi monosakarida dalam bentuk siklik (piranosa atau furanosa).
2. Proses Pembentukan Struktur Haworth
Struktur Haworth adalah hasil dari reaksi siklisasi monosakarida yang terjadi karena reaksi intramolekuler antara:
✅ Gugus aldehid (pada aldosa) atau gugus keton (pada ketosa) dengan
✅ Gugus hidroksil (–OH) yang berada dalam rantai yang sama.
👉 Reaksi ini menghasilkan struktur cincin:
-
Piranosa → Jika membentuk cincin beranggota enam (contoh: glukosa, galaktosa).
-
Furanosa → Jika membentuk cincin beranggota lima (contoh: fruktosa).
3. Proyeksi Struktur Haworth
Dalam proyeksi Haworth, posisi atom dan gugus dalam cincin digambarkan sebagai berikut:
-
Atom karbon dalam cincin → digambarkan pada bidang planar.
-
Gugus hidroksil (–OH) → digambarkan di atas atau di bawah bidang cincin.
-
Karbon anomerik → merupakan pusat stereogenik baru yang muncul akibat pembentukan cincin.
Aturan Penulisan Struktur Haworth:
-
Gugus hidroksil (–OH) pada karbon anomerik → menentukan apakah struktur adalah α atau β:
-
α-anomer → Gugus –OH di bawah bidang cincin.
-
β-anomer → Gugus –OH di atas bidang cincin.
-
-
Gugus pada karbon kiral → diatur sesuai dengan proyeksi Fischer:
-
Gugus yang di kanan dalam proyeksi Fischer → diarahkan ke bawah dalam struktur Haworth.
-
Gugus yang di kiri dalam proyeksi Fischer → diarahkan ke atas dalam struktur Haworth.
-
-
Gugus CH₂OH pada karbon terakhir → menunjukkan orientasi konfigurasi D atau L:
-
D-monosakarida → Gugus CH₂OH di atas cincin.
-
L-monosakarida → Gugus CH₂OH di bawah cincin.
-
4. Contoh Struktur Haworth pada Monosakarida
a) Glukosa
-
Glukosa membentuk cincin piranosa (enam anggota).
-
Gugus hidroksil pada karbon anomerik bisa membentuk dua anomer:
-
α-D-glukosa → Gugus –OH di bawah cincin.
-
β-D-glukosa → Gugus –OH di atas cincin.
-
b) Fruktosa
-
Fruktosa membentuk cincin furanosa (lima anggota).
-
Gugus hidroksil pada karbon anomerik juga bisa dalam posisi α atau β.
5. Konformasi Kursi (Chair) dan Perahu (Boat)
Pada struktur cincin piranosa, terdapat dua konformasi yang umum:
✅ Konformasi kursi (chair) → Lebih stabil karena regangan sudutnya kecil dan posisi ekuatorial lebih diutamakan.
✅ Konformasi perahu (boat) → Kurang stabil karena terjadi tolakan sterik antargugus yang berdekatan.
👉 Glukosa dalam bentuk β-D-glukopiranosa lebih stabil dalam konformasi kursi karena semua gugus hidroksil dalam posisi ekuatorial → minim tolakan sterik.
6. Peran Biologis Struktur Haworth
-
Pengangkutan Glukosa → Bentuk β-D-glukosa lebih mudah dikenali oleh reseptor glukosa di sel.
-
Sintesis Glikogen dan Selulosa → Terjadi melalui ikatan glikosidik dalam bentuk struktur Haworth.
-
Metabolisme Fruktosa → Dalam jalur metabolisme, fruktosa aktif dalam bentuk β-D-fruktofuranosa.
-
Reaksi Enzimatis → Banyak enzim hanya mengenali monosakarida dalam bentuk siklik Haworth.
7. Anotasi Tambahan
-
β-D-glukosa lebih stabil dibandingkan α-D-glukosa karena posisi gugus –OH di karbon anomerik dalam posisi ekuatorial → minim tolakan sterik.
-
Dalam larutan, monosakarida berfluktuasi antara bentuk α dan β melalui proses mutarotasi hingga mencapai keseimbangan.
-
Glukosa cenderung berada dalam bentuk piranosa, sedangkan fruktosa lebih sering dalam bentuk furanosa karena perbedaan stabilitas cincin.
8. Perbedaan Proyeksi Fischer dan Haworth
| Karakteristik | Proyeksi Fischer | Proyeksi Haworth |
|---|---|---|
| Dimensi | Rantai lurus (linear) | Cincin (siklik) |
| Orientasi Gugus | Gugus di kanan/kiri rantai | Gugus di atas/bawah cincin |
| Anomer α dan β | Tidak terdefinisi | Terdefinisi jelas |
| Digunakan untuk | Menentukan konfigurasi stereoisomer | Menentukan bentuk siklik |
9. Kesimpulan
Slide ini adalah pengantar tentang struktur Haworth yang digunakan untuk merepresentasikan bentuk siklik dari monosakarida dalam bentuk piranosa atau furanosa.
-
Struktur Haworth adalah representasi dua dimensi dari struktur siklik monosakarida.
-
Proyeksi Haworth memungkinkan visualisasi stereokimia anomer α dan β.
-
Struktur Haworth memberikan informasi tentang posisi gugus fungsional dalam cincin dan menentukan stabilitas konformasi monosakarida.
-
Struktur siklik memungkinkan monosakarida untuk berpartisipasi dalam pembentukan ikatan glikosidik dan metabolisme karbohidrat.
👉 Pemahaman struktur Haworth penting dalam biokimia karena struktur ini adalah bentuk aktif monosakarida dalam metabolisme sel.
44 Syarah (Penjelasan) Slide ke-22
Slide ini menjelaskan tentang pembentukan hemi-asetal siklik pada monosakarida, khususnya pada aldoheksosa seperti D-glukosa, dan bagaimana struktur hasil dari pembentukan cincin tersebut direpresentasikan menggunakan struktur Haworth. Struktur Haworth adalah cara standar dalam menggambarkan konformasi siklik dari monosakarida dalam bentuk cincin planar.
1. Hemi-Asetal Siklik pada Monosakarida
Hemi-asetal adalah senyawa yang terbentuk dari reaksi antara:
✅ Gugus aldehid (–CHO) pada karbon pertama (C1) dengan
✅ Gugus hidroksil (–OH) pada karbon kelima (C5) dalam satu molekul yang sama.
👉 Reaksi ini menghasilkan cincin stabil yang disebut sebagai hemi-asetal siklik.
👉 Untuk aldoheksosa seperti glukosa, hasil pembentukan cincin adalah struktur piranosa (cincin enam anggota) karena struktur ini paling stabil secara sterik dan elektronik.
2. Proses Pembentukan Hemi-Asetal Siklik pada D-Glukosa
Pada slide, proses pembentukan hemi-asetal siklik pada D-glukosa diperlihatkan melalui tiga tahapan utama:
a) Tahap 1 → Struktur Linear (Proyeksi Fischer)
-
Glukosa dalam bentuk rantai terbuka memiliki gugus karbonil aldehid (–CHO) pada karbon pertama.
-
Gugus hidroksil (–OH) berada di sepanjang rantai karbon.
-
Proyeksi Fischer digunakan untuk menggambarkan konfigurasi stereokimia pada setiap karbon kiral.
b) Tahap 2 → Reaksi Intra-Molekuler (Serangan Nukleofilik)
-
Gugus hidroksil pada karbon ke-5 menyerang gugus karbonil pada karbon pertama (karbon anomerik).
-
Terjadi pembentukan ikatan kovalen antara atom karbon karbonil dan atom oksigen dari gugus hidroksil.
-
Proton berpindah, menghasilkan struktur cincin enam anggota.
-
Karbon anomerik yang baru terbentuk menjadi pusat stereogenik (posisi α atau β).
Reaksi:
Glukosa (Linear)+H2O⇌Hemi-asetal Siklik (Piranosa)\text{Glukosa (Linear)} + \text{H}_2\text{O} \rightleftharpoons \text{Hemi-asetal Siklik (Piranosa)}Glukosa (Linear)+H2O⇌Hemi-asetal Siklik (Piranosa)
c) Tahap 3 → Terbentuk Struktur Siklik
-
Struktur cincin enam anggota yang terbentuk disebut glukopiranosa.
-
Gugus hidroksil pada karbon anomerik dapat berada di bawah atau di atas bidang cincin:
-
α-D-glukopiranosa → Gugus –OH di bawah cincin.
-
β-D-glukopiranosa → Gugus –OH di atas cincin.
-
-
Dalam larutan, glukosa akan berada dalam keseimbangan antara bentuk α dan β melalui proses mutarotasi.
👉 Mutarotasi:
Mutarotasi adalah proses perubahan spontan antara α-D-glukosa dan β-D-glukosa dalam larutan. Keseimbangan ini dipengaruhi oleh:
✅ pH larutan
✅ Suhu
✅ Katalis enzimatik
3. Konfigurasi Anomerik
Karbon anomerik adalah karbon baru yang terbentuk akibat reaksi hemi-asetal. Pada struktur Haworth, konfigurasi karbon anomerik ditentukan berdasarkan posisi gugus –OH:
-
α-anomer → Gugus –OH pada karbon anomerik di bawah cincin.
-
β-anomer → Gugus –OH pada karbon anomerik di atas cincin.
👉 Pada glukosa, bentuk β-D-glukopiranosa lebih stabil karena posisi gugus –OH di ekuatorial → minim tolakan sterik.
4. Perbedaan Proyeksi Fischer dan Haworth
Struktur yang ditampilkan di slide menggambarkan peralihan dari proyeksi Fischer (linear) ke proyeksi Haworth (siklik):
| Proyeksi Fischer | Proyeksi Haworth |
|---|---|
| Rantai lurus | Struktur cincin |
| Gugus di kanan → Bawah | Gugus di kiri → Atas |
| Gugus hidroksil dan karbonil terlihat sejajar | Gugus hidroksil pada karbon anomerik menentukan α atau β |
| Tidak menggambarkan stabilitas cincin | Menunjukkan kestabilan cincin |
👉 Proyeksi Fischer → Menunjukkan konfigurasi stereoisomer.
👉 Proyeksi Haworth → Menunjukkan kestabilan dan orientasi cincin.
5. Struktur Haworth pada D-Glukosa
Pada slide, struktur Haworth diperlihatkan dalam bentuk cincin enam anggota (piranosa):
✅ Gugus hidroksil (–OH) pada karbon anomerik di bawah → α-D-glukopiranosa.
✅ Gugus hidroksil (–OH) pada karbon anomerik di atas → β-D-glukopiranosa.
👉 Mengapa bentuk piranosa lebih stabil?
-
Cincin beranggota enam memiliki sudut ikatan ≈ 109,5° → Sudut ideal untuk ikatan sp³.
-
Mengurangi ketegangan cincin dan tolakan sterik.
-
Oleh karena itu, glukosa lebih banyak ditemukan dalam bentuk β-D-glukopiranosa dalam larutan (≈ 66%).
6. Mutarotasi dalam Larutan
Mutarotasi adalah fenomena di mana glukosa dalam larutan mengalami perubahan spontan antara bentuk α dan β hingga mencapai keseimbangan:
✅ α-D-glukosa → ≈ 34%
✅ β-D-glukosa → ≈ 66%
✅ Bentuk rantai terbuka → <1%
👉 β-D-glukosa lebih stabil karena semua gugus hidroksil berada dalam posisi ekuatorial → minim tolakan sterik.
7. Kaitan dengan Struktur Biologis
-
α-D-glukosa → Penyusun pati dan glikogen (ikatan α-1,4-glikosidik).
-
β-D-glukosa → Penyusun selulosa (ikatan β-1,4-glikosidik).
-
Enzim glikosidase → Mengenali bentuk spesifik (α atau β).
👉 Struktur Haworth membantu menjelaskan bagaimana enzim membedakan antara pati dan selulosa meskipun keduanya tersusun dari glukosa.
8. Stabilitas Struktur Piranosa
Struktur piranosa lebih stabil dibandingkan furanosa karena:
✅ Sudut ikatan mendekati sudut ideal sp³ (109,5°).
✅ Posisi gugus hidroksil dalam konfigurasi ekuatorial mengurangi tolakan sterik.
✅ Terbentuk konformasi kursi yang lebih stabil daripada perahu.
9. Peran Penting Struktur Haworth dalam Biologi
✅ Struktur Haworth menjelaskan aktivitas enzimatis spesifik.
✅ Glukosa dalam metabolisme berada dalam bentuk piranosa.
✅ Ikatan glikosidik dalam polisakarida bergantung pada konfigurasi α atau β.
✅ Glukosa → Energi utama dalam glikolisis → bentuk siklik yang aktif secara biologis adalah bentuk Haworth.
10. Perbedaan α dan β dalam Struktur Piranosa
| Karakteristik | α-D-glukosa | β-D-glukosa |
|---|---|---|
| Posisi –OH pada karbon anomerik | Di bawah cincin | Di atas cincin |
| Stabilitas | Kurang stabil | Lebih stabil |
| Polimer | Pati dan glikogen | Selulosa |
| Pengenalan enzim | Amilase | Selulase |
11. Kesimpulan
-
Pembentukan hemi-asetal siklik pada glukosa menghasilkan cincin enam anggota (piranosa).
-
Struktur Haworth merepresentasikan bentuk cincin yang stabil.
-
Keseimbangan antara α dan β dalam larutan terjadi melalui mutarotasi.
-
β-D-glukopiranosa lebih stabil karena posisi ekuatorial gugus hidroksil.
-
Struktur Haworth menjelaskan bagaimana enzim mengenali monosakarida dalam jalur metabolisme.
👉 Struktur Haworth adalah bentuk biologis aktif dari monosakarida dalam metabolisme dan biosintesis.
46 Syarah (Penjelasan) Slide ke-23
Slide ini membahas tentang anomeri, yaitu jenis stereoisomer yang muncul karena posisi gugus hidroksil (–OH) pada karbon anomerik dalam struktur cincin monosakarida. Perbedaan konfigurasi pada karbon anomerik ini menghasilkan dua bentuk isomer yang dikenal sebagai α-anomer dan β-anomer.
1. Anomer pada Monosakarida
Anomer adalah stereoisomer yang muncul akibat perbedaan posisi gugus hidroksil (–OH) pada karbon anomerik dalam struktur cincin monosakarida. Karbon anomerik adalah karbon yang berasal dari gugus karbonil (C=O) dalam bentuk rantai terbuka dan menjadi pusat kiral baru setelah pembentukan cincin.
👉 Perbedaan antara α dan β terletak pada posisi gugus hidroksil (–OH) pada karbon anomerik:
✅ α-anomer → Gugus –OH di bawah cincin (trans dengan gugus CH₂OH).
✅ β-anomer → Gugus –OH di atas cincin (cis dengan gugus CH₂OH).
2. Proses Pembentukan Anomer
-
Pada monosakarida seperti D-glukosa, pembentukan cincin terjadi karena reaksi antara:
-
Gugus aldehid (C1) → Karbon anomerik
-
Gugus hidroksil (C5)
-
-
Reaksi ini menghasilkan struktur cincin enam anggota (piranosa).
-
Setelah cincin terbentuk, posisi gugus –OH pada karbon anomerik bisa dalam dua kemungkinan:
-
Jika gugus –OH di bawah → α-anomer
-
Jika gugus –OH di atas → β-anomer
-
3. Reaksi dan Keseimbangan Anomer
Dalam larutan, anomer α dan β tidak bersifat statis tetapi mengalami perubahan konformasi melalui proses mutarotasi.
Mutarotasi:
-
Proses perubahan spontan antara α dan β dalam larutan.
-
Terjadi karena cincin monosakarida dapat terbuka sementara, memungkinkan rotasi di sekitar karbon anomerik sebelum membentuk kembali cincin.
-
Dalam larutan, keseimbangan anomerik pada glukosa adalah:
✅ α-D-glukosa → ≈ 34%
✅ β-D-glukosa → ≈ 66%
✅ Bentuk rantai terbuka → <1%
👉 β-D-glukosa lebih stabil karena gugus –OH pada karbon anomerik berada di posisi ekuatorial → mengurangi tolakan sterik.
4. Konfigurasi Anomer pada Glukosa
a) α-D-Glukosa
-
Gugus hidroksil (–OH) pada karbon anomerik berada di bawah cincin.
-
Kurang stabil karena gugus –OH dalam posisi aksial → terjadi tolakan sterik.
b) β-D-Glukosa
-
Gugus hidroksil (–OH) pada karbon anomerik berada di atas cincin.
-
Lebih stabil karena gugus –OH dalam posisi ekuatorial → tolakan sterik berkurang.
👉 Oleh karena itu, dalam larutan, β-D-glukosa adalah bentuk yang dominan karena konformasi ekuatorial lebih stabil.
5. Perbedaan Konfigurasi Anomer
| Karakteristik | α-Anomer | β-Anomer |
|---|---|---|
| Posisi Gugus –OH pada Karbon Anomerik | Di bawah cincin (trans) | Di atas cincin (cis) |
| Stabilitas | Kurang stabil | Lebih stabil |
| Keseimbangan dalam Larutan | ≈ 34% | ≈ 66% |
| Polimerisasi | Amilosa dan Glikogen → Ikatan α-1,4-glikosidik | Selulosa → Ikatan β-1,4-glikosidik |
6. Pengaruh Anomer pada Polimerisasi
-
α-D-glukosa → Ikatan α-1,4-glikosidik → membentuk pati dan glikogen.
-
Amilosa → rantai lurus
-
Amilopektin → rantai bercabang
-
Glikogen → rantai bercabang dan lebih mudah dipecah oleh enzim amilase
-
-
β-D-glukosa → Ikatan β-1,4-glikosidik → membentuk selulosa.
-
Ikatan β-1,4-glikosidik menyebabkan struktur rantai kaku dan tidak mudah dicerna oleh enzim amilase.
-
Hanya enzim selulase yang dapat memecah ikatan β-glikosidik.
-
👉 Pati dan selulosa memiliki monomer yang sama (glukosa) tetapi memiliki perbedaan dalam konfigurasi anomer!
7. Pengaruh Keseimbangan Anomer dalam Metabolisme
-
Enzim amilase hanya mengenali bentuk α-D-glukosa → sehingga hanya pati dan glikogen yang bisa dihidrolisis.
-
Selulase hanya mengenali ikatan β-1,4-glikosidik pada selulosa → sebagian besar hewan tidak memiliki selulase sehingga tidak bisa mencerna selulosa.
-
Glukosa yang berperan dalam metabolisme energi (glikolisis) adalah dalam bentuk α-D-glukosa.
👉 Anomerisme mempengaruhi struktur dan fungsi biologis karbohidrat!
8. Perbedaan Struktur antara α dan β-D-Glukosa
| Karakteristik | α-D-Glukosa | β-D-Glukosa |
|---|---|---|
| Posisi Gugus Hidroksil (-OH) | Di bawah cincin | Di atas cincin |
| Ikatan Glikosidik | α-1,4-glikosidik | β-1,4-glikosidik |
| Polimer | Amilosa, Glikogen | Selulosa |
| Keseimbangan | ≈ 34% | ≈ 66% |
| Stabilitas | Kurang stabil (tolakan sterik) | Lebih stabil (konfigurasi ekuatorial) |
9. Mengapa β-D-Glukosa Lebih Stabil?
-
Dalam proyeksi Haworth, cincin piranosa memiliki bentuk konformasi kursi (chair).
-
Dalam bentuk kursi:
✅ Gugus –OH pada posisi ekuatorial → mengurangi tolakan sterik.
✅ Pada β-D-glukosa, gugus –OH pada karbon anomerik berada dalam posisi ekuatorial → lebih stabil.
✅ Pada α-D-glukosa, gugus –OH berada dalam posisi aksial → terjadi tolakan sterik → kurang stabil.
👉 Oleh karena itu, dalam larutan, β-D-glukosa menjadi bentuk dominan.
10. Peran Anomerisme dalam Fisiologi
-
Transportasi Glukosa → GLUT (glucose transporter) mengenali bentuk spesifik anomer.
-
Polimerisasi Karbohidrat →
✅ Pati dan glikogen → α-1,4-glikosidik
✅ Selulosa → β-1,4-glikosidik -
Metabolisme Glukosa → Enzim fosforilase dan glukokinase mengenali bentuk anomer spesifik.
11. Anotasi Tambahan
✅ α-D-Glukosa lebih mudah dimetabolisme dalam glikolisis karena enzim lebih selektif pada bentuk α.
✅ β-D-Glukosa berperan penting dalam pembentukan struktur selulosa dan dinding sel tumbuhan.
✅ Mutarotasi adalah fenomena penting dalam keseimbangan anomerik dan kestabilan struktur cincin.
12. Kesimpulan
-
Anomer adalah stereoisomer yang muncul karena perbedaan posisi gugus –OH pada karbon anomerik.
-
α-anomer → gugus –OH di bawah cincin → kurang stabil.
-
β-anomer → gugus –OH di atas cincin → lebih stabil → mendominasi dalam larutan.
-
Perbedaan konfigurasi anomer menentukan perbedaan fungsi biologis dan struktur karbohidrat.
-
Enzim spesifik mengenali konfigurasi anomerik → mempengaruhi jalur metabolisme dan penyimpanan energi.
👉 Anomerisme adalah dasar pengenalan struktural dalam metabolisme dan biosintesis karbohidrat.
48 Syarah (Penjelasan) Slide ke-24
Slide ini menjelaskan tentang mutarotasi, yaitu proses perubahan spontan antara bentuk α dan β dari monosakarida (khususnya glukosa) dalam larutan melalui pembentukan bentuk rantai terbuka sementara. Fenomena ini memiliki pengaruh penting pada kestabilan dan aktivitas biologis dari karbohidrat, terutama pada proses metabolisme dan sintesis polimer karbohidrat.
1. Pengertian Mutarotasi
Mutarotasi adalah proses di mana cincin monosakarida dalam bentuk siklik (hemi-asetal) terbuka sementara dan memungkinkan perubahan konfigurasi pada karbon anomerik dari posisi α ke β (atau sebaliknya).
👉 Proses ini terjadi karena dalam larutan, monosakarida tidak hanya berada dalam bentuk cincin (siklik), tetapi juga dalam bentuk rantai terbuka (linear) yang memungkinkan perubahan konfigurasi anomerik.
Reaksi Dasar:
α-D-glukosa↔D-glukosa (rantai terbuka)↔β-D-glukosa\alpha \text{-D-glukosa} \leftrightarrow \text{D-glukosa (rantai terbuka)} \leftrightarrow \beta \text{-D-glukosa}α-D-glukosa↔D-glukosa (rantai terbuka)↔β-D-glukosa
2. Mekanisme Mutarotasi
a) Proses Pembukaan Cincin
-
Dalam larutan, glukosa sebagian besar berada dalam bentuk cincin (piranosa).
-
Oksigen dari gugus hidroksil pada karbon anomerik dapat menyerang gugus karbonil, menyebabkan pembentukan cincin.
-
Cincin piranosa dapat membuka menjadi bentuk rantai terbuka (linear) → membentuk gugus karbonil aldehid.
b) Perubahan Konfigurasi pada Karbon Anomerik
-
Setelah terbentuk rantai terbuka, gugus karbonil bebas untuk mengalami serangan nukleofilik dari gugus hidroksil pada posisi C5.
-
Posisi serangan ini bisa menghasilkan dua kemungkinan:
-
Jika gugus –OH berada di bawah cincin → membentuk α-anomer
-
Jika gugus –OH berada di atas cincin → membentuk β-anomer
-
c) Penutupan Cincin
-
Setelah perubahan konfigurasi pada karbon anomerik, cincin kembali menutup.
-
Keseimbangan antara α dan β tercapai melalui proses dinamis → Mutarotasi terjadi terus-menerus hingga mencapai titik keseimbangan.
3. Keseimbangan Mutarotasi
Pada glukosa, keseimbangan mutarotasi biasanya menghasilkan komposisi sebagai berikut:
✅ α-D-glukosa → ≈ 34%
✅ β-D-glukosa → ≈ 66%
✅ Bentuk rantai terbuka → <1%
👉 β-D-glukosa lebih stabil karena gugus –OH pada karbon anomerik berada dalam posisi ekuatorial → mengurangi tolakan sterik.
👉 Dalam larutan, bentuk β mendominasi karena lebih stabil dalam bentuk kursi (chair conformation).
4. Perbedaan Antara α dan β dalam Mutarotasi
| Karakteristik | α-D-Glukosa | β-D-Glukosa |
|---|---|---|
| Posisi Gugus –OH pada Karbon Anomerik | Di bawah cincin | Di atas cincin |
| Stabilitas | Kurang stabil → posisi aksial → tolakan sterik lebih tinggi | Lebih stabil → posisi ekuatorial → tolakan sterik berkurang |
| Keseimbangan dalam Larutan | ≈ 34% | ≈ 66% |
| Pengaruh terhadap Ikatan Glikosidik | Membentuk pati dan glikogen (ikatan α-1,4) | Membentuk selulosa (ikatan β-1,4) |
5. Faktor yang Mempengaruhi Laju Mutarotasi
Laju mutarotasi dipengaruhi oleh:
✅ pH Larutan → Kondisi asam atau basa mempercepat pembukaan dan penutupan cincin.
✅ Suhu → Suhu tinggi mempercepat proses mutarotasi.
✅ Katalis Enzimatik → Enzim mutarotase mempercepat perubahan anomer dalam sel biologis.
✅ Struktur Molekul → Struktur dengan tekanan cincin lebih tinggi cenderung mengalami mutarotasi lebih cepat.
6. Signifikansi Biologis Mutarotasi
-
Metabolisme Glukosa
-
Pada glikolisis, enzim heksokinase hanya mengenali bentuk α-D-glukosa.
-
Namun, keseimbangan mutarotasi memastikan bahwa β-D-glukosa juga dapat dimanfaatkan setelah mengalami konversi menjadi α-D-glukosa.
-
-
Pembentukan Polisakarida
-
Pati dan glikogen → Terdiri dari α-D-glukosa (ikatan α-1,4).
-
Selulosa → Terdiri dari β-D-glukosa (ikatan β-1,4).
-
-
Pengendalian Osmotik
-
Konsentrasi glukosa bebas dalam darah dikendalikan oleh mutarotasi dan enzim glukokinase.
-
-
Pengaturan Keseimbangan Energi
-
Bentuk anomer menentukan jalur metabolisme yang akan diaktifkan.
-
α-D-glukosa → Sumber energi melalui glikolisis.
-
β-D-glukosa → Stabil → cenderung diubah menjadi glikogen atau selulosa.
-
7. Perbedaan Mutarotasi dan Anomerisasi
| Aspek | Mutarotasi | Anomerisasi |
|---|---|---|
| Mekanisme | Perubahan spontan antara α dan β dalam larutan | Terjadi pada enzim spesifik |
| Kondisi | Terjadi dalam larutan (tidak memerlukan enzim) | Terjadi dalam enzim |
| Hasil | Keseimbangan antara α dan β | Anomer spesifik terbentuk |
| Contoh | Mutarotasi glukosa dalam larutan | Anomerisasi oleh enzim mutarotase |
8. Mutarotasi dalam Konteks Biologi
-
Enzim mutarotase → Mengatur laju mutarotasi dalam sel.
-
Mutarotasi penting untuk penyesuaian metabolisme karbohidrat karena enzim spesifik hanya mengenali bentuk tertentu (α atau β).
-
Mutarotasi memastikan ketersediaan bentuk α dan β untuk jalur metabolisme dan biosintesis yang berbeda.
9. Mutarotasi pada Monosakarida Lainnya
Mutarotasi tidak hanya terjadi pada glukosa tetapi juga pada monosakarida lainnya:
✅ Fruktosa → Mutarotasi antara α-D-frukosa dan β-D-frukosa.
✅ Galaktosa → Mutarotasi antara α-D-galaktosa dan β-D-galaktosa.
✅ Mannosa → Mutarotasi antara α-D-mannosa dan β-D-mannosa.
👉 Mutarotasi memberikan fleksibilitas bagi sel dalam menggunakan monosakarida untuk sintesis dan metabolisme.
10. Implikasi Mutarotasi pada Struktur dan Fungsi Karbohidrat
-
Keseimbangan antara α dan β memengaruhi struktur polisakarida yang terbentuk:
✅ α-glukosa → pati dan glikogen → mudah dipecah oleh enzim amilase.
✅ β-glukosa → selulosa → tidak dapat dipecah oleh enzim amilase biasa (butuh selulase). -
Mutarotasi memengaruhi stabilitas fisik dan aktivitas biologis karbohidrat dalam larutan.
-
Keseimbangan anomerik mempengaruhi kelarutan dan osmotik dalam larutan biologis.
11. Kesimpulan
-
Mutarotasi adalah proses interkonversi antara bentuk α dan β monosakarida melalui bentuk rantai terbuka.
-
Mutarotasi menghasilkan keseimbangan yang bergantung pada stabilitas dan posisi gugus hidroksil pada karbon anomerik.
-
β-D-glukosa lebih stabil karena posisi ekuatorial dari gugus –OH pada karbon anomerik.
-
Mutarotasi mempengaruhi struktur dan fungsi biologis → metabolisme, sintesis polisakarida, dan pengaturan keseimbangan osmotik.
👉 Mutarotasi adalah proses kunci yang menjamin fleksibilitas dalam metabolisme dan biosintesis karbohidrat.
50 Syarah (Penjelasan) Slide ke-25
Slide ini menjelaskan sifat kimia monosakarida, khususnya kemampuan monosakarida untuk mengalami reaksi oksidasi dan bertindak sebagai senyawa pereduksi. Sifat ini berperan penting dalam pengenalan karbohidrat dan pengujian kimia untuk mendeteksi adanya monosakarida dalam larutan.
1. Sifat Kimia Monosakarida
Monosakarida memiliki gugus fungsi utama yang menentukan reaktivitasnya:
✅ Gugus aldehid (pada aldosa)
✅ Gugus keton (pada ketosa)
✅ Gugus hidroksil (–OH)
Monosakarida dengan gugus aldehid atau keton bebas berpotensi mengalami reaksi oksidasi, sehingga dapat bertindak sebagai agen pereduksi dalam reaksi kimia tertentu.
👉 Monosakarida dalam larutan dapat mengalami tautomerisasi → Ketosa dapat berubah menjadi aldosa melalui reaksi enolasi → Ketosa juga dapat bertindak sebagai agen pereduksi setelah dikonversi menjadi bentuk aldosa.
2. Reaksi Oksidasi Monosakarida
Reaksi utama yang terjadi pada monosakarida adalah oksidasi.
a) Oksidasi Aldosa → Asam Karboksilat
-
Monosakarida dengan gugus aldehid (aldosa) dapat mengalami oksidasi menjadi asam karboksilat.
-
Oksidasi ini terjadi karena gugus aldehid (–CHO) adalah senyawa yang cukup reaktif terhadap oksidator lemah seperti ion tembaga (Cu²⁺) atau ion perak (Ag⁺).
Reaksi Oksidasi:
R−CHO+[O]→R−COOHR-CHO + [O] \rightarrow R-COOHR−CHO+[O]→R−COOH
b) Reaksi dengan Reagen Benedict dan Tollens
-
Reaksi Benedict
-
Dalam reaksi Benedict, ion tembaga (Cu²⁺) dalam larutan natrium sitrat akan direduksi oleh monosakarida.
-
Produk yang dihasilkan adalah endapan merah bata berupa Cu₂O (tembaga(I) oksida).
-
R−CHO+2Cu2++2OH−→R−COOH+Cu2O(endapanmerahbata)+H2OR-CHO + 2Cu^{2+} + 2OH^{-} \rightarrow R-COOH + Cu_2O (endapan merah bata) + H_2OR−CHO+2Cu2++2OH−→R−COOH+Cu2O(endapanmerahbata)+H2O
-
Reaksi Tollens
-
Dalam reaksi Tollens, ion perak (Ag⁺) dalam larutan amonia akan direduksi oleh monosakarida menjadi logam perak (Ag).
-
Produk yang dihasilkan berupa cermin perak pada dinding tabung reaksi.
-
R−CHO+2[Ag(NH3)2]++H2O→R−COOH+2Ag(cerminperak)+2NH3+H2OR-CHO + 2[Ag(NH_3)_2]^+ + H_2O \rightarrow R-COOH + 2Ag (cermin perak) + 2NH_3 + H_2OR−CHO+2[Ag(NH3)2]++H2O→R−COOH+2Ag(cerminperak)+2NH3+H2O
👉 Glukosa dan aldosa lainnya memberikan hasil positif pada kedua reaksi ini.
👉 Fruktosa sebagai ketosa tidak langsung bereaksi → tetapi dapat mengalami tautomerisasi menjadi glukosa dalam larutan basa → memberikan hasil positif setelah konversi menjadi aldosa.
3. Monosakarida sebagai Senyawa Pereduksi
Karena mampu mendonorkan elektron ke agen pengoksidasi seperti Cu²⁺ atau Ag⁺, monosakarida disebut sebagai gula pereduksi.
✅ Aldosa → Gula pereduksi langsung karena memiliki gugus aldehid bebas.
✅ Ketosa → Tidak langsung bertindak sebagai pereduksi, tetapi bisa mengalami tautomerisasi menjadi aldosa dalam larutan basa → bertindak sebagai gula pereduksi setelah konversi.
👉 Glukosa, galaktosa, dan fruktosa adalah contoh gula pereduksi yang paling umum.
4. Mekanisme Reaksi Benedict
-
Dalam larutan, glukosa berada dalam keseimbangan antara bentuk α, β, dan bentuk rantai terbuka.
-
Bentuk rantai terbuka dengan gugus aldehid bebas bereaksi dengan ion Cu²⁺ dari larutan Benedict.
-
Gugus aldehid mengalami oksidasi → membentuk asam glukonat.
-
Cu²⁺ mengalami reduksi → membentuk Cu₂O (endapan merah bata).
👉 Glukosa sebagai gula pereduksi:
C6H12O6+2Cu2++2OH−→C6H12O7+Cu2O+H2OC_6H_{12}O_6 + 2Cu^{2+} + 2OH^{-} \rightarrow C_6H_{12}O_7 + Cu_2O + H_2OC6H12O6+2Cu2++2OH−→C6H12O7+Cu2O+H2O
5. Perbedaan Reaksi pada Aldosa dan Ketosa
| Karakteristik | Aldosa | Ketosa |
|---|---|---|
| Gugus Fungsional | Aldehid (–CHO) | Keton (–CO) |
| Hasil Reaksi Benedict/Tollens | Memberikan hasil positif langsung | Tidak langsung, tetapi hasil positif setelah tautomerisasi |
| Produk Oksidasi | Asam alduronat atau asam glukonat | Asam karboksilat setelah tautomerisasi |
| Contoh | Glukosa, galaktosa, manosa | Fruktosa, sorbosa, tagatosa |
6. Gula Pereduksi vs Non-Pereduksi
✅ Gula pereduksi → memiliki gugus aldehid bebas atau keton bebas → mampu mereduksi ion Cu²⁺ atau Ag⁺.
✅ Gula non-pereduksi → tidak memiliki gugus aldehid bebas → tidak mampu mengalami oksidasi atau mereduksi ion Cu²⁺ atau Ag⁺ secara langsung.
Contoh:
-
Gula pereduksi → glukosa, fruktosa, galaktosa, maltosa, laktosa.
-
Gula non-pereduksi → sukrosa (karena tidak memiliki gugus aldehid atau keton bebas).
👉 Sukrosa adalah non-pereduksi karena ikatan glikosidik α(1→2) antara glukosa dan fruktosa melibatkan gugus anomerik → tidak tersedia untuk reaksi oksidasi.
7. Implikasi Biologis Oksidasi dan Pereduksi Monosakarida
-
Metabolisme Energi
-
Glukosa dioksidasi dalam jalur glikolisis → menghasilkan ATP.
-
Glukosa mengalami oksidasi sempurna dalam siklus Krebs → menghasilkan CO₂ dan H₂O.
-
-
Tes Klinis
-
Tes Benedict digunakan dalam uji glukosa urin (indikasi diabetes).
-
Tes Tollens digunakan dalam pengujian laboratorium untuk membedakan antara aldosa dan ketosa.
-
-
Glikosilasi Protein
-
Glukosa sebagai agen pereduksi → berperan dalam reaksi Maillard (reaksi antara gula pereduksi dan protein) → membentuk senyawa yang menyebabkan perubahan warna dan rasa pada makanan saat dipanaskan.
-
8. Perbedaan Antara Tes Benedict dan Tes Tollens
| Reaksi | Reaksi Benedict | Reaksi Tollens |
|---|---|---|
| Ion Pengoksidasi | Cu²⁺ (tembaga) | Ag⁺ (perak) |
| Produk | Cu₂O (endapan merah bata) | Cermin perak (Ag) |
| Sensitivitas | Kurang sensitif | Lebih sensitif |
| Warna | Warna merah bata | Endapan perak |
| Fungsi | Menguji keberadaan aldosa dan ketosa setelah tautomerisasi | Menguji keberadaan aldosa saja |
9. Kesimpulan
-
Monosakarida dengan gugus aldehid atau keton mampu mengalami reaksi oksidasi.
-
Aldosa adalah gula pereduksi → langsung bereaksi dengan Benedict dan Tollens.
-
Ketosa dapat bertindak sebagai gula pereduksi setelah tautomerisasi menjadi aldosa.
-
Oksidasi monosakarida menghasilkan asam karboksilat dan mengubah ion tembaga/perak menjadi bentuk tereduksi.
-
Reaksi Benedict dan Tollens adalah metode utama untuk mengidentifikasi monosakarida sebagai gula pereduksi.
👉 Glukosa dan fruktosa → contoh utama gula pereduksi yang digunakan dalam metabolisme dan reaksi biologis.
52 Syarah (Penjelasan) Slide ke-26
Slide ini menjelaskan sifat reduksi dari karbohidrat, terutama monosakarida dan disakarida. Sifat reduksi ini ditentukan oleh keberadaan gugus karbonil bebas (baik aldehid maupun keton) dan peran gugus hidroksil dalam reaksi reduksi-oksidasi.
1. Atom C Reduktif pada Aldosa dan Ketosa
Karbohidrat yang memiliki kemampuan mereduksi senyawa pengoksidasi disebut sebagai gula pereduksi. Sifat reduksi ini ditentukan oleh keberadaan atom karbon reduktif pada struktur molekul.
✅ Pada aldosa → Atom C reduktif adalah atom karbon nomor 1 (C1) karena terikat dengan gugus aldehid (–CHO).
✅ Pada ketosa → Atom C reduktif adalah atom karbon nomor 2 (C2) karena terikat dengan gugus keton (–CO).
👉 Glukosa, galaktosa, dan fruktosa adalah contoh utama monosakarida yang memiliki atom C reduktif.
2. Mekanisme Reduksi
Karbohidrat mampu mereduksi senyawa pengoksidasi seperti:
✅ Ferisanida → Kalium ferisianida (K₃[Fe(CN)₆])
✅ H₂O₂ → Hidrogen peroksida
✅ Cu²⁺ → Ion tembaga dalam larutan Benedict
Reaksi Reduksi:
-
Aldosa → Teroksidasi menjadi asam alduronat atau asam glukonat
-
Ketosa → Berubah menjadi aldosa melalui tautomerisasi, lalu teroksidasi menjadi asam karboksilat
👉 Glukosa dan fruktosa adalah contoh gula pereduksi karena keduanya memiliki gugus karbonil bebas yang dapat bereaksi dengan oksidator.
3. Oksidasi pada Gugus Karbonil
Ketika karbohidrat mengalami reaksi oksidasi, gugus karbonil (baik aldehid atau keton) akan bereaksi dengan agen pengoksidasi.
-
Reaksi ini akan mengubah gugus karbonil menjadi asam karboksilat.
-
Dalam tes Benedict → Oksidasi glukosa menghasilkan endapan merah bata berupa tembaga(I) oksida (Cu₂O).
-
Dalam tes Tollens → Oksidasi glukosa menghasilkan cermin perak dari logam perak (Ag).
👉 Semakin besar jumlah zat pengoksidasi yang tereduksi → Semakin tinggi kadar gula pereduksi dalam larutan → Dasar untuk pengujian kadar glukosa dalam urin pada penderita diabetes.
4. Pemeriksaan Kadar Gula dalam Urin
✅ Pada penderita diabetes → Konsentrasi glukosa dalam urin tinggi karena ketidakmampuan tubuh untuk memetabolisme glukosa dengan efisien.
✅ Tes Benedict atau tes Fehling dapat digunakan untuk mendeteksi kadar glukosa dalam urin.
Mekanisme:
-
Glukosa dalam urin akan mereduksi ion tembaga (Cu²⁺) menjadi Cu₂O.
-
Terjadi perubahan warna → Indikasi kadar glukosa dalam urin.
-
Semakin banyak glukosa → Semakin banyak ion Cu²⁺ yang direduksi → Warna larutan semakin intensif.
5. Sifat Pereduksi Ditentukan oleh Gugus Hidroksil (OH) Bebas
Kemampuan monosakarida untuk bertindak sebagai pereduksi ditentukan oleh keberadaan gugus hidroksil (OH) bebas yang terikat pada atom karbon anomerik (C1 pada aldosa dan C2 pada ketosa).
👉 Monosakarida seperti glukosa dan fruktosa memiliki gugus OH bebas → Bersifat pereduksi.
👉 Jika gugus OH bebas terikat dalam ikatan glikosidik → Karbohidrat tidak bersifat pereduksi → Contohnya sukrosa.
6. Karbohidrat Pereduksi dan Non-Pereduksi
a) Glukosa
-
Gugus hidroksil (OH) bebas pada atom karbon C1.
-
Dapat mengalami oksidasi → Menjadi asam glukonat atau asam glukuronat.
b) Fruktosa
-
Gugus hidroksil (OH) bebas pada atom karbon C2.
-
Meskipun fruktosa adalah ketosa → Dapat bertindak sebagai pereduksi setelah tautomerisasi menjadi glukosa.
c) Sukrosa
-
Tidak memiliki gugus hidroksil bebas karena ikatan glikosidik antara glukosa dan fruktosa melibatkan atom karbon anomerik dari keduanya.
-
Tidak dapat mereduksi ion Cu²⁺ atau Ag⁺ → Non-pereduksi.
d) Laktosa
-
Gugus hidroksil bebas tersedia pada atom karbon C1 dari glukosa.
-
Dapat mereduksi ion Cu²⁺ atau Ag⁺ → Bersifat pereduksi.
| Karbohidrat | Jenis | Sifat Reduksi | Gugus Hidroksil Bebas |
|---|---|---|---|
| Glukosa | Aldosa | Pereduksi | Ada pada C1 |
| Fruktosa | Ketosa | Pereduksi | Ada pada C2 |
| Sukrosa | Disakarida | Non-pereduksi | Tidak ada |
| Laktosa | Disakarida | Pereduksi | Ada pada C1 glukosa |
7. Perbedaan Antara Glukosa, Fruktosa, dan Sukrosa
| Karbohidrat | Jenis Gugus Fungsional | Sifat Pereduksi | Mekanisme |
|---|---|---|---|
| Glukosa | Aldosa | Pereduksi | Mereduksi Cu²⁺ dan Ag⁺ → Cu₂O, Ag |
| Fruktosa | Ketosa | Pereduksi | Tautomerisasi → Berubah menjadi aldosa |
| Sukrosa | Disakarida | Non-pereduksi | Ikatan glikosidik antar monomer menutupi gugus karbonil |
| Laktosa | Disakarida | Pereduksi | Gugus hidroksil bebas pada glukosa memungkinkan reduksi |
8. Implikasi Biologis
✅ Glukosa adalah sumber energi utama bagi sel melalui jalur glikolisis dan siklus Krebs.
✅ Fruktosa → Dapat dimetabolisme melalui jalur glikolisis setelah diubah menjadi glukosa-6-fosfat.
✅ Sukrosa → Dipecah oleh enzim sukrase menjadi glukosa dan fruktosa dalam sistem pencernaan.
✅ Laktosa → Dipecah oleh enzim laktase menjadi glukosa dan galaktosa → Penting dalam metabolisme bayi dan anak-anak.
9. Perbedaan Antara Gula Pereduksi dan Non-Pereduksi
| Sifat | Gula Pereduksi | Gula Non-Pereduksi |
|---|---|---|
| Definisi | Mampu mereduksi ion Cu²⁺ atau Ag⁺ | Tidak mampu mereduksi ion Cu²⁺ atau Ag⁺ |
| Gugus Fungsional | Aldehid atau keton bebas | Ikatan glikosidik antar gugus anomerik |
| Contoh | Glukosa, fruktosa, laktosa | Sukrosa, trehalosa |
10. Kesimpulan
-
Glukosa dan fruktosa adalah monosakarida yang bersifat pereduksi karena memiliki gugus karbonil bebas.
-
Sukrosa tidak bersifat pereduksi karena gugus karbonilnya terikat dalam ikatan glikosidik.
-
Laktosa bersifat pereduksi karena memiliki gugus hidroksil bebas pada glukosa.
-
Tes Benedict dan Tollens dapat digunakan untuk menguji sifat reduksi dari karbohidrat → Penting dalam uji klinis untuk mendeteksi kadar glukosa dalam urin (indikator diabetes).
👉 Glukosa dan fruktosa adalah contoh gula pereduksi yang paling umum digunakan dalam metabolisme dan proses biologis.
54 Syarah (Penjelasan) Slide ke-27
Slide ini menjelaskan sifat pereduksi fruktosa meskipun fruktosa secara struktural adalah ketosa (bukan aldosa). Secara umum, ketosa tidak memiliki gugus aldehid bebas yang bisa mereduksi ion logam seperti Cu²⁺ dalam uji Benedict atau Ag⁺ dalam uji Tollens. Namun, fruktosa memiliki kemampuan untuk bertindak sebagai gula pereduksi melalui tautomerisasi menjadi bentuk aldosa.
1. Fruktosa Sebagai Ketosa dan Gula Pereduksi
Fruktosa adalah ketosa karena memiliki gugus fungsi keton pada posisi karbon nomor 2 (C2). Secara umum, ketosa tidak memiliki kemampuan untuk bertindak sebagai gula pereduksi karena gugus keton tidak semudah gugus aldehid dalam mengalami oksidasi.
👉 Namun, fruktosa dapat bertindak sebagai gula pereduksi karena mampu berubah bentuk menjadi aldosa melalui reaksi tautomerisasi (keto-enol tautomerisasi).
2. Reaksi Tautomerisasi (Keto-Enol Tautomerisasi)
Proses tautomerisasi melibatkan perubahan dari bentuk ketosa menjadi bentuk enol → lalu berubah menjadi aldosa.
Mekanisme Tautomerisasi:
-
Gugus keton pada fruktosa mengalami pemindahan atom hidrogen (proton) dan ikatan rangkap bergeser.
-
Struktur yang dihasilkan adalah bentuk enol yang tidak stabil.
-
Enol ini selanjutnya berisomerisasi menjadi bentuk aldehid → menghasilkan aldosa.
👉 Reaksi tautomerisasi:
Fruktosa (ketosa)↔Enol↔Glukosa (aldosa)\text{Fruktosa (ketosa)} \leftrightarrow \text{Enol} \leftrightarrow \text{Glukosa (aldosa)} Fruktosa (ketosa)↔Enol↔Glukosa (aldosa)
👉 Proses ini memungkinkan fruktosa bertindak sebagai gula pereduksi meskipun secara struktur awal adalah ketosa.
3. Peran Tautomerisasi dalam Oksidasi
Karena fruktosa dapat berubah menjadi aldosa, maka fruktosa dapat mengalami oksidasi dalam tes Benedict atau tes Tollens.
✅ Pada uji Benedict → Fruktosa mampu mereduksi ion Cu²⁺ menjadi Cu₂O (endapan merah bata) setelah berubah menjadi glukosa atau manosa.
✅ Pada uji Tollens → Fruktosa mampu mereduksi ion Ag⁺ menjadi logam perak (Ag).
Reaksi Oksidasi Fruktosa:
-
Fruktosa → Tautomerisasi → Aldosa → Oksidasi menjadi asam glukonat atau asam glukuronat.
-
Proses ini menghasilkan endapan merah bata dalam tes Benedict atau cermin perak dalam tes Tollens.
4. Mekanisme Oksidasi Fruktosa
Reaksi oksidasi fruktosa terjadi dalam tiga tahap:
-
Fruktosa berisomerisasi menjadi glukosa atau manosa melalui tautomerisasi.
-
Glukosa atau manosa mengalami oksidasi pada gugus aldehid bebas (C1).
-
Ion Cu²⁺ atau Ag⁺ direduksi menjadi Cu₂O atau Ag, sehingga menghasilkan perubahan warna (merah bata atau cermin perak).
Reaksi:
Fruktosa→keto-enol tautomerisasiGlukosa→oksidasiAsam glukonat + Cu2O\text{Fruktosa} \xrightarrow{\text{keto-enol tautomerisasi}} \text{Glukosa} \xrightarrow{\text{oksidasi}} \text{Asam glukonat + Cu}_2\text{O}Fruktosaketo-enol tautomerisasiGlukosaoksidasiAsam glukonat + Cu2O
5. Signifikansi Biologis
✅ Fruktosa adalah monosakarida utama yang ditemukan dalam madu dan buah-buahan.
✅ Dalam metabolisme, fruktosa diubah menjadi glukosa melalui jalur tautomerisasi sebelum digunakan dalam glikolisis.
✅ Dalam pengujian klinis, fruktosa dapat memberikan hasil positif pada tes Benedict dan Tollens karena proses tautomerisasi ini.
6. Perbedaan Fruktosa vs Glukosa dalam Sifat Pereduksi
| Karbohidrat | Gugus Fungsional | Sifat Pereduksi | Mekanisme |
|---|---|---|---|
| Glukosa | Aldosa | Pereduksi | Gugus aldehid bereaksi langsung |
| Fruktosa | Ketosa | Pereduksi (setelah tautomerisasi) | Gugus keton berisomerisasi menjadi aldehid |
7. Kesimpulan
-
Fruktosa adalah ketosa tetapi bersifat sebagai gula pereduksi karena mampu mengalami tautomerisasi menjadi aldosa.
-
Tautomerisasi memungkinkan fruktosa dioksidasi dalam uji Benedict dan uji Tollens.
-
Proses ini menjelaskan mengapa fruktosa, meskipun berstruktur ketosa, bisa bereaksi positif dalam tes untuk gula pereduksi yang biasanya hanya dideteksi oleh aldosa.
-
Sifat ini penting dalam metabolisme dan deteksi klinis gula dalam tubuh.
👉 Fruktosa = Ketosa + Tautomerisasi → Aldosa → Gula Pereduksi
56 Syarah (Penjelasan) Slide ke-28
Slide ini menjelaskan tentang disakarida, yaitu jenis karbohidrat yang terdiri atas dua molekul monosakarida yang dihubungkan oleh ikatan kimia spesifik yang dikenal sebagai ikatan glikosidik. Disakarida merupakan kelompok karbohidrat penting yang banyak ditemukan dalam makanan dan memiliki peran utama dalam metabolisme.
1. Definisi Disakarida
Disakarida adalah karbohidrat yang tersusun atas dua unit monosakarida yang terikat melalui ikatan kovalen yang dikenal sebagai ikatan glikosidik. Ikatan ini terbentuk dari reaksi antara gugus hidroksil (-OH) dari satu monosakarida dengan gugus hidroksil dari monosakarida lainnya, melalui proses kondensasi yang menghasilkan molekul air (H₂O).
👉 Reaksi Kondensasi:
Monosakarida1+Monosakarida2→EnzimDisakarida+H2O\text{Monosakarida}_1 + \text{Monosakarida}_2 \xrightarrow{\text{Enzim}} \text{Disakarida} + H_2OMonosakarida1+Monosakarida2EnzimDisakarida+H2O
2. Ikatan Glikosidik
Ikatan glikosidik adalah jenis ikatan kovalen yang terbentuk antara atom karbon anomerik (C1) dari satu monosakarida dengan gugus hidroksil pada monosakarida lainnya. Ikatan ini menentukan sifat dan stabilitas struktur disakarida.
➡️ Jika ikatan terbentuk melalui karbon anomerik dari glukosa, disakarida yang dihasilkan bisa memiliki konfigurasi α atau β tergantung pada posisi gugus hidroksil (-OH):
-
α (alfa) – Gugus -OH pada karbon anomerik berada di bawah bidang cincin.
-
β (beta) – Gugus -OH pada karbon anomerik berada di atas bidang cincin.
3. Proses Pembentukan Disakarida
Proses pembentukan disakarida melibatkan reaksi kondensasi yang melepaskan molekul air. Ikatan glikosidik yang terbentuk dapat terjadi dalam beberapa posisi, tetapi yang paling umum adalah ikatan antara C1 dari monosakarida pertama dan C4 dari monosakarida kedua (ikatan (1→4)).
💡 Contoh Reaksi:
Glukosa+Fruktosa→Sukrosa+H2O\text{Glukosa} + \text{Fruktosa} \rightarrow \text{Sukrosa} + H_2OGlukosa+Fruktosa→Sukrosa+H2O
4. Sifat Ikatan Glikosidik
-
Ikatan glikosidik dapat hidrolisis (dipecah) oleh enzim seperti maltase, laktase, atau sukrase dalam saluran pencernaan.
-
Tipe ikatan glikosidik (α atau β) mempengaruhi stabilitas dan kemampuan tubuh untuk mencerna disakarida tersebut.
-
Ikatan α (1→4) mudah dipecah oleh enzim pencernaan, sedangkan ikatan β (1→4) lebih sulit dipecah (seperti pada selulosa).
5. Contoh Disakarida
Terdapat tiga disakarida utama yang umum ditemukan dalam makanan:
✅ 1. Maltosa
-
Terbentuk dari dua molekul glukosa yang dihubungkan oleh ikatan α (1→4).
-
Dapat dihidrolisis oleh enzim maltase dalam saluran pencernaan menjadi dua molekul glukosa.
-
Sumber utama: hasil hidrolisis pati dalam saluran pencernaan.
Reaksi:
Maltosa+H2O→maltase2Glukosa\text{Maltosa} + \text{H}_2\text{O} \xrightarrow{\text{maltase}} 2\text{Glukosa}Maltosa+H2Omaltase2Glukosa
✅ 2. Laktosa
-
Terdiri dari glukosa dan galaktosa yang dihubungkan oleh ikatan β (1→4).
-
Dipecah oleh enzim laktase dalam saluran pencernaan.
-
Sumber utama: susu dan produk susu.
Reaksi:
Laktosa+H2O→laktaseGlukosa+Galaktosa\text{Laktosa} + \text{H}_2\text{O} \xrightarrow{\text{laktase}} \text{Glukosa} + \text{Galaktosa}Laktosa+H2OlaktaseGlukosa+Galaktosa
✅ 3. Sukrosa
-
Terdiri dari glukosa dan fruktosa yang dihubungkan oleh ikatan α (1→2).
-
Dipecah oleh enzim sukrase.
-
Sumber utama: gula tebu dan gula bit.
Reaksi:
Sukrosa+H2O→sukraseGlukosa+Fruktosa\text{Sukrosa} + \text{H}_2\text{O} \xrightarrow{\text{sukrase}} \text{Glukosa} + \text{Fruktosa}Sukrosa+H2OsukraseGlukosa+Fruktosa
6. Perbedaan Sifat Biologis dan Kimiawi Disakarida
| Disakarida | Monosakarida Penyusun | Ikatan Glikosidik | Enzim Pencerna | Sumber |
|---|---|---|---|---|
| Maltosa | Glukosa + Glukosa | α(1→4) | Maltase | Pati, sereal |
| Laktosa | Glukosa + Galaktosa | β(1→4) | Laktase | Susu dan produk susu |
| Sukrosa | Glukosa + Fruktosa | α(1→2) | Sukrase | Gula tebu, buah |
7. Sifat Pereduksi Disakarida
-
Maltosa dan Laktosa bersifat sebagai gula pereduksi karena memiliki gugus aldehid bebas yang dapat dioksidasi.
-
Sukrosa bukan gula pereduksi karena tidak memiliki gugus aldehid atau keton bebas akibat ikatan glikosidik yang melibatkan karbon anomerik kedua monosakarida.
8. Pentingnya Disakarida dalam Biologi
✅ Sumber energi utama – Disakarida dihidrolisis dalam sistem pencernaan untuk menyediakan monosakarida yang dapat digunakan dalam metabolisme seluler.
✅ Cadangan energi – Disakarida seperti maltosa adalah hasil antara dalam pemecahan pati dan glikogen.
✅ Pengangkutan nutrisi – Sukrosa adalah bentuk utama pengangkutan gula dalam tumbuhan melalui pembuluh floem.
9. Kesimpulan
-
Disakarida adalah karbohidrat yang terdiri dari dua monosakarida yang dihubungkan oleh ikatan glikosidik.
-
Pembentukan disakarida melibatkan reaksi kondensasi yang melepaskan molekul air.
-
Jenis ikatan glikosidik menentukan stabilitas dan kemampuan pencernaan disakarida dalam tubuh.
-
Maltosa dan laktosa adalah disakarida pereduksi, sementara sukrosa adalah disakarida non-pereduksi.
-
Perbedaan konfigurasi ikatan glikosidik (α atau β) mempengaruhi kelarutan dan metabolisme dalam tubuh.
👉 Maltosa = Gula hasil pemecahan pati
👉 Laktosa = Gula susu
👉 Sukrosa = Gula tebu
58 Syarah (Penjelasan) Slide ke-29
Slide ini menjelaskan tentang sukrosa (sucrose), salah satu jenis disakarida yang terdiri dari glukosa dan fruktosa. Sukrosa dikenal sebagai gula tebu atau gula pasir yang umum digunakan sebagai pemanis alami dalam makanan dan minuman. Sukrosa terbentuk melalui reaksi kondensasi yang menghubungkan glukosa dan fruktosa melalui ikatan glikosidik.
1. Struktur Kimia Sukrosa
Sukrosa adalah disakarida yang terbentuk dari:
-
Glukosa → Monosakarida dengan gugus aldehid (aldosa)
-
Fruktosa → Monosakarida dengan gugus keton (ketosa)
👉 Dalam struktur sukrosa:
-
Glukosa berada dalam bentuk cincin piranosa (beranggotakan enam atom).
-
Fruktosa berada dalam bentuk cincin furanosa (beranggotakan lima atom).
-
Ikatan antara glukosa dan fruktosa adalah ikatan α(1→2) glikosidik.
2. Reaksi Pembentukan Sukrosa
Sukrosa terbentuk melalui proses kondensasi (dehidrasi), yaitu pelepasan satu molekul air (H₂O) dari gugus hidroksil (-OH) pada atom C1 dari glukosa dan gugus hidroksil pada atom C2 dari fruktosa.
Reaksi:
Glukosa+Fruktosa→dehidrasiSukrosa+H2O\text{Glukosa} + \text{Fruktosa} \xrightarrow{\text{dehidrasi}} \text{Sukrosa} + H_2OGlukosa+FruktosadehidrasiSukrosa+H2O
➡️ Gugus -OH dari C1 glukosa bereaksi dengan gugus -OH dari C2 fruktosa, membentuk ikatan glikosidik α(1→2) dan menghasilkan satu molekul air sebagai produk sampingan.
3. Ciri Khas Sukrosa
✅ Ikatan glikosidik pada sukrosa melibatkan karbon anomerik dari kedua monosakarida (glukosa dan fruktosa), sehingga tidak ada gugus aldehid atau keton bebas.
✅ Sukrosa tidak bersifat sebagai gula pereduksi karena gugus karbonil (aldehid atau keton) telah berpartisipasi dalam pembentukan ikatan glikosidik, sehingga tidak bisa mengalami oksidasi.
✅ Sukrosa larut dalam air dan memberikan rasa manis karena memiliki kemampuan untuk berinteraksi dengan reseptor rasa manis di lidah.
4. Proses Hidrolisis Sukrosa
Dalam tubuh, sukrosa dihidrolisis oleh enzim sukrase di usus halus menjadi glukosa dan fruktosa, yang kemudian dapat digunakan dalam metabolisme energi melalui proses glikolisis.
Reaksi Hidrolisis:
Sukrosa+H2O→sukraseGlukosa+Fruktosa\text{Sukrosa} + H_2O \xrightarrow{\text{sukrase}} \text{Glukosa} + \text{Fruktosa}Sukrosa+H2OsukraseGlukosa+Fruktosa
👉 Glukosa akan memasuki jalur glikolisis untuk menghasilkan ATP (energi).
👉 Fruktosa akan diubah menjadi glukosa atau langsung digunakan dalam metabolisme hati.
5. Sifat Sukrosa
| Sifat | Penjelasan |
|---|---|
| Komponen | Glukosa + Fruktosa |
| Ikatan Glikosidik | α(1→2) |
| Sifat Pereduksi | Non-pereduksi (karena tidak ada gugus karbonil bebas) |
| Pencernaan | Dipecah oleh enzim sukrase |
| Kelimpahan | Banyak ditemukan dalam tebu, bit, dan madu |
6. Sifat Fisik Sukrosa
✅ Sukrosa berbentuk kristal padat berwarna putih.
✅ Larut dalam air karena memiliki banyak gugus hidroksil (OH) yang membentuk ikatan hidrogen dengan air.
✅ Rasa manisnya relatif kuat dibandingkan dengan glukosa dan fruktosa.
7. Sifat Biologis Sukrosa
-
Sukrosa adalah bentuk utama transportasi gula dalam tumbuhan melalui pembuluh floem.
-
Sukrosa merupakan cadangan energi di banyak tumbuhan.
-
Sukrosa tidak mengalami fermentasi langsung oleh sebagian besar mikroorganisme karena enzim sukrase tidak ada pada beberapa bakteri.
8. Peran Sukrosa dalam Metabolisme
-
Sumber energi utama – Glukosa dan fruktosa hasil hidrolisis sukrosa digunakan dalam jalur metabolisme energi seluler.
-
Penting dalam sintesis molekul kompleks – Glukosa dan fruktosa adalah prekursor untuk sintesis glikogen, asam lemak, dan asam nukleat.
-
Transportasi dalam tumbuhan – Sukrosa diangkut dari daun ke organ penyimpanan melalui pembuluh floem dalam proses translokasi.
9. Perbedaan Sukrosa dengan Disakarida Lainnya
| Disakarida | Monosakarida Penyusun | Ikatan Glikosidik | Sifat Pereduksi |
|---|---|---|---|
| Sukrosa | Glukosa + Fruktosa | α(1→2) | Non-pereduksi |
| Maltosa | Glukosa + Glukosa | α(1→4) | Pereduksi |
| Laktosa | Glukosa + Galaktosa | β(1→4) | Pereduksi |
10. Kesimpulan
-
Sukrosa adalah disakarida yang terdiri dari glukosa dan fruktosa.
-
Sukrosa terbentuk melalui reaksi kondensasi yang melibatkan ikatan α(1→2) glikosidik.
-
Sukrosa adalah gula non-pereduksi karena tidak memiliki gugus aldehid atau keton bebas.
-
Sukrosa adalah sumber energi utama yang dipecah oleh enzim sukrase menjadi glukosa dan fruktosa untuk digunakan dalam metabolisme seluler.
-
Sukrosa adalah bentuk utama transportasi gula dalam tumbuhan.
👉 Sukrosa = Glukosa + Fruktosa
👉 Ikatan α(1→2) = Non-pereduksi
👉 Dipecah oleh enzim sukrase
👉 Larut dalam air = Memberikan rasa manis
60 Syarah (Penjelasan) Slide ke-30
Slide ini menjelaskan reaksi pembentukan sukrosa dari dua monosakarida, yaitu glukosa dan fruktosa. Proses ini melibatkan reaksi kondensasi atau dehidrasi di mana satu molekul air (H₂O) dilepaskan dalam pembentukan ikatan glikosidik.
1. Monosakarida Penyusun Sukrosa
(a) Glukosa
-
Glukosa adalah aldoheksosa karena memiliki gugus aldehid (-CHO) pada karbon pertama.
-
Struktur glukosa dalam bentuk siklik membentuk cincin piranosa (beranggota enam).
👉 Struktur Haworth glukosa menunjukkan gugus hidroksil (-OH) pada posisi α atau β tergantung orientasi pada karbon anomerik.
-
Jika -OH pada karbon anomerik mengarah ke bawah → α-glukosa
-
Jika -OH pada karbon anomerik mengarah ke atas → β-glukosa
(b) Fruktosa
-
Fruktosa adalah ketoheksosa karena memiliki gugus keton (C=O) pada karbon kedua.
-
Struktur fruktosa dalam bentuk siklik membentuk cincin furanosa (beranggota lima).
👉 Dalam reaksi pembentukan sukrosa, fruktosa digunakan dalam bentuk β-D-fruktosa.
2. Reaksi Kondensasi Pembentukan Sukrosa
Reaksi pembentukan sukrosa terjadi melalui reaksi kondensasi antara:
-
Gugus hidroksil (-OH) pada C1 glukosa dalam bentuk α-glukosa
-
Gugus hidroksil (-OH) pada C2 fruktosa dalam bentuk β-fruktosa
➡️ Reaksi menghasilkan ikatan α(1→2) glikosidik dan melepaskan satu molekul air (H₂O).
Reaksi:
α-D-glukosa+β-D-fruktosa→kondensasisukrosa+H2O\text{α-D-glukosa} + \text{β-D-fruktosa} \xrightarrow{\text{kondensasi}} \text{sukrosa} + H_2Oα-D-glukosa+β-D-fruktosakondensasisukrosa+H2O
Ikatan α(1→2) berarti:
-
Gugus hidroksil dari glukosa pada C1 membentuk ikatan dengan gugus hidroksil pada C2 fruktosa.
3. Struktur Kimia Sukrosa
Dalam struktur Haworth, sukrosa terdiri dari:
-
Glukosa dalam bentuk cincin piranosa
-
Fruktosa dalam bentuk cincin furanosa
-
Ikatan antara keduanya adalah α(1→2) glikosidik
➡️ Ikatan ini mengunci posisi gugus karbonil (aldehid atau keton), sehingga sukrosa tidak memiliki gugus karbonil bebas dan tidak dapat bereaksi sebagai agen pereduksi.
4. Sifat Sukrosa
✅ Sukrosa adalah gula non-pereduksi karena gugus karbonil pada kedua monosakarida telah berpartisipasi dalam pembentukan ikatan glikosidik.
✅ Sukrosa larut dalam air karena banyaknya gugus hidroksil (-OH) yang mampu membentuk ikatan hidrogen dengan molekul air.
✅ Sukrosa tidak bisa mengalami mutarotasi karena posisi ikatan anomerik telah dikunci dalam ikatan glikosidik.
5. Proses Hidrolisis Sukrosa
Sukrosa dapat dihidrolisis kembali menjadi glukosa dan fruktosa oleh enzim sukrase atau dalam suasana asam.
-
Enzim sukrase memutus ikatan α(1→2) dan menghasilkan glukosa dan fruktosa sebagai produk akhir.
sukrosa+H2O→sukraseglukosa+fruktosa\text{sukrosa} + H_2O \xrightarrow{\text{sukrase}} \text{glukosa} + \text{fruktosa}sukrosa+H2Osukraseglukosa+fruktosa
➡️ Proses ini terjadi dalam usus halus sebagai bagian dari pencernaan karbohidrat.
6. Kesimpulan
-
Sukrosa adalah disakarida yang terdiri dari glukosa dan fruktosa.
-
Ikatan yang terbentuk adalah ikatan α(1→2) glikosidik.
-
Sukrosa adalah non-pereduksi karena tidak memiliki gugus karbonil bebas.
-
Sukrosa adalah sumber energi utama yang akan dipecah oleh enzim sukrase di usus halus menjadi glukosa dan fruktosa untuk metabolisme.
✅ Glukosa + Fruktosa → Sukrosa + H₂O
✅ Ikatan α(1→2) = Non-pereduksi
✅ Dipecah oleh sukrase
✅ Sumber energi utama
62 Syarah (Penjelasan) Slide ke-31
Slide ini menjelaskan tentang maltosa, yaitu disakarida yang terdiri dari dua unit glukosa yang dihubungkan melalui ikatan glikosidik. Maltosa merupakan produk hasil hidrolisis parsial pati atau amilosa oleh enzim amilase.
1. Struktur Kimia Maltosa
➡️ Glukosa + Glukosa → Maltosa + H₂O
-
Maltosa dibentuk dari dua molekul glukosa yang dihubungkan melalui ikatan glikosidik tipe α(1→4).
-
Pada reaksi ini, satu gugus hidroksil (-OH) dari karbon anomerik glukosa pertama akan bereaksi dengan gugus hidroksil (-OH) dari karbon C4 glukosa kedua.
-
Reaksi ini melepaskan satu molekul air (H₂O) → disebut reaksi kondensasi atau dehidrasi.
Reaksi:
α-D-glukosa+α-D-glukosa→kondensasimaltosa+H2O\alpha\text{-D-glukosa} + \alpha\text{-D-glukosa} \xrightarrow{\text{kondensasi}} \text{maltosa} + H_2Oα-D-glukosa+α-D-glukosakondensasimaltosa+H2O
2. Ikatan Glikosidik pada Maltosa
-
Maltosa terikat melalui ikatan α(1→4) glikosidik, yaitu ikatan antara:
-
C1 dari glukosa pertama (dalam bentuk α-glukosa)
-
C4 dari glukosa kedua (dalam bentuk α-glukosa)
-
👉 Posisi α menunjukkan bahwa gugus hidroksil pada karbon anomerik dari glukosa pertama mengarah ke bawah pada struktur cincin Haworth.
3. Sifat Kimia Maltosa
✅ Gula pereduksi – Maltosa adalah disakarida yang bersifat pereduksi karena gugus hidroksil (OH) pada karbon anomerik dari glukosa kedua masih bebas dan dapat mengalami mutarotasi menjadi bentuk α atau β.
✅ Larut dalam air – Maltosa bersifat larut dalam air karena banyaknya gugus hidroksil (-OH) yang bersifat polar dan mampu membentuk ikatan hidrogen dengan molekul air.
✅ Rasa manis ringan – Maltosa memiliki rasa manis, tetapi tidak semanis sukrosa.
4. Proses Hidrolisis Maltosa
-
Maltosa dapat dihidrolisis kembali menjadi dua molekul glukosa oleh enzim maltase.
-
Reaksi hidrolisis terjadi di usus halus sebagai bagian dari proses pencernaan karbohidrat:
maltosa+H2O→maltaseglukosa+glukosa\text{maltosa} + H_2O \xrightarrow{\text{maltase}} \text{glukosa} + \text{glukosa}maltosa+H2Omaltaseglukosa+glukosa
✅ Maltase adalah enzim spesifik yang memutus ikatan α(1→4) glikosidik.
✅ Hasil akhirnya adalah dua molekul glukosa yang siap diserap dan dimetabolisme untuk menghasilkan energi melalui jalur glikolisis.
5. Sumber Maltosa
Maltosa ditemukan pada:
-
Produk hasil hidrolisis amilum (pati) dalam proses pencernaan
-
Dalam makanan fermentasi seperti bir dan minuman malt
-
Produk hasil pemecahan pati dalam kecambah atau proses pembuatan tape dan tempe
6. Peran dalam Metabolisme
-
Setelah dipecah menjadi dua molekul glukosa, glukosa akan masuk ke jalur glikolisis.
-
Melalui jalur ini, glukosa akan dipecah menjadi piruvat dan menghasilkan ATP sebagai sumber energi seluler utama.
7. Perbedaan Maltosa dengan Sukrosa dan Laktosa
| Disakarida | Monomer Penyusun | Ikatan Glikosidik | Sifat Pereduksi | Sumber |
|---|---|---|---|---|
| Maltosa | Glukosa + Glukosa | α(1→4) | Ya | Produk hidrolisis pati |
| Sukrosa | Glukosa + Fruktosa | α(1→2) | Tidak | Tebu, buah-buahan |
| Laktosa | Glukosa + Galaktosa | β(1→4) | Ya | Susu mamalia |
8. Kesimpulan
✅ Maltosa adalah disakarida yang tersusun dari dua molekul glukosa.
✅ Terbentuk melalui ikatan α(1→4) glikosidik yang menghasilkan satu molekul air.
✅ Bersifat pereduksi karena gugus anomerik pada glukosa kedua masih bebas.
✅ Dihidrolisis oleh enzim maltase di usus halus menjadi dua molekul glukosa yang akan masuk ke jalur metabolisme glikolisis untuk menghasilkan energi.
✅ Glukosa + Glukosa → Maltosa + H₂O
✅ Ikatan α(1→4) = Gula pereduksi
✅ Dipecah oleh maltase
✅ Produk metabolisme pati
64 Syarah (Penjelasan) Slide ke-32
Slide ini menjelaskan tentang laktosa, yaitu disakarida yang tersusun dari glukosa dan galaktosa yang dihubungkan melalui ikatan glikosidik β(1→4). Laktosa adalah gula utama yang ditemukan dalam susu dan produk turunannya.
1. Struktur Kimia Laktosa
➡️ Glukosa + Galaktosa → Laktosa + H₂O
-
Laktosa dibentuk dari satu unit glukosa dan satu unit galaktosa yang dihubungkan melalui ikatan β(1→4) glikosidik.
-
Reaksi pembentukan laktosa merupakan reaksi kondensasi karena melibatkan pelepasan satu molekul air (H₂O).
Reaksi:
Galaktosa+Glukosa→kondensasiLaktosa+H2O\text{Galaktosa} + \text{Glukosa} \xrightarrow{\text{kondensasi}} \text{Laktosa} + H_2OGalaktosa+GlukosakondensasiLaktosa+H2O
2. Ikatan Glikosidik pada Laktosa
-
Ikatan yang menyusun laktosa adalah β(1→4) glikosidik:
-
Karbon anomerik C1 dari galaktosa terikat pada C4 dari glukosa dalam orientasi β (gugus OH pada karbon anomerik mengarah ke atas).
-
Perbedaan utama dengan maltosa adalah orientasi ikatan glikosidiknya (β vs α).
-
3. Sifat Kimia Laktosa
✅ Bersifat pereduksi – Karena gugus hidroksil bebas pada karbon anomerik glukosa masih tersedia untuk melakukan reaksi reduksi.
✅ Hidrolisis – Laktosa dapat dipecah kembali menjadi galaktosa dan glukosa oleh enzim laktase.
✅ Larut dalam air – Gugus hidroksil (-OH) yang bersifat polar membuat laktosa mudah larut dalam air.
✅ Rasa manis ringan – Laktosa memiliki rasa manis yang lebih rendah dibandingkan glukosa dan fruktosa.
4. Proses Hidrolisis Laktosa
Laktosa dihidrolisis menjadi glukosa dan galaktosa di dalam usus halus oleh enzim laktase:
Laktosa+H2O→laktaseGalaktosa+Glukosa\text{Laktosa} + H_2O \xrightarrow{\text{laktase}} \text{Galaktosa} + \text{Glukosa}Laktosa+H2OlaktaseGalaktosa+Glukosa
✅ Jika enzim laktase tidak mencukupi, laktosa tidak dapat dipecah dengan sempurna dan menyebabkan intoleransi laktosa.
✅ Intoleransi laktosa menyebabkan perut kembung, diare, dan gangguan pencernaan akibat fermentasi laktosa oleh bakteri usus.
5. Peran Biologis Laktosa
-
Laktosa adalah sumber energi utama untuk bayi yang menyusui.
-
Setelah dipecah menjadi glukosa dan galaktosa:
-
Glukosa → Dapat dimetabolisme langsung melalui glikolisis.
-
Galaktosa → Dikatalisis menjadi glukosa dalam jalur metabolisme galaktosa.
-
6. Sumber Laktosa
Laktosa ditemukan secara alami dalam:
-
Susu sapi
-
Susu kambing
-
ASI (Air Susu Ibu)
-
Produk olahan susu seperti keju, yogurt, dan mentega
7. Perbedaan Laktosa dengan Sukrosa dan Maltosa
| Disakarida | Monomer Penyusun | Ikatan Glikosidik | Sifat Pereduksi | Sumber |
|---|---|---|---|---|
| Maltosa | Glukosa + Glukosa | α(1→4) | Ya | Produk hidrolisis pati |
| Sukrosa | Glukosa + Fruktosa | α(1→2) | Tidak | Tebu, buah-buahan |
| Laktosa | Galaktosa + Glukosa | β(1→4) | Ya | Susu mamalia |
8. Intoleransi Laktosa
👉 Defisiensi enzim laktase menyebabkan ketidakmampuan tubuh mencerna laktosa dengan baik → menyebabkan fermentasi oleh bakteri usus.
👉 Hasil fermentasi menyebabkan produksi gas, asam lemak rantai pendek, dan asam laktat → menyebabkan perut kembung, diare, dan rasa tidak nyaman.
9. Kesimpulan
✅ Laktosa adalah disakarida yang terdiri dari glukosa dan galaktosa dengan ikatan β(1→4).
✅ Bersifat pereduksi karena karbon anomerik pada glukosa masih bebas.
✅ Dihidrolisis oleh enzim laktase menjadi glukosa dan galaktosa.
✅ Intoleransi laktosa terjadi karena defisiensi enzim laktase di usus halus.
✅ Galaktosa + Glukosa → Laktosa + H₂O
✅ Ikatan β(1→4)
✅ Bersifat pereduksi
✅ Dipecah oleh enzim laktase
✅ Penting untuk nutrisi bayi
66 Syarah (Penjelasan) Slide ke-33
Slide ini membahas tentang polisakarida atau glikan, yang merupakan polimer dari monosakarida yang dihubungkan dengan ikatan glikosidik. Polisakarida merupakan bentuk penyimpanan karbohidrat dalam makhluk hidup, dan juga berperan sebagai penyusun struktur biologis.
1. Definisi Polisakarida
Polisakarida adalah polimer yang tersusun dari banyak unit monosakarida (biasanya lebih dari 10) yang terikat melalui ikatan glikosidik.
-
Polisakarida termasuk dalam kelompok karbohidrat kompleks.
-
Monosakarida penyusun biasanya berupa glukosa atau monosakarida lainnya (misalnya fruktosa, galaktosa).
2. Ikatan Glikosidik dalam Polisakarida
-
Ikatan glikosidik adalah ikatan yang terbentuk antara gugus hidroksil (-OH) dari satu monosakarida dengan gugus hidroksil dari monosakarida lainnya melalui reaksi kondensasi (melepas H₂O).
-
Terdapat dua jenis ikatan glikosidik utama:
-
Ikatan α → mudah dicerna oleh enzim (contoh: pati dan glikogen).
-
Ikatan β → sulit dicerna oleh enzim manusia (contoh: selulosa).
-
3. Jenis Polisakarida dan Fungsinya
Polisakarida dapat dibagi menjadi polisakarida cadangan dan polisakarida struktural:
✅ A. Polisakarida Cadangan
Berfungsi sebagai penyimpan energi dalam sel makhluk hidup.
(1) Amilum (Pati)
-
Disusun dari dua polimer glukosa:
-
Amilosa → rantai lurus dengan ikatan α(1→4).
-
Amilopektin → rantai bercabang dengan ikatan α(1→4) dan α(1→6) pada titik cabang.
-
-
Terdapat dalam tumbuhan sebagai karbohidrat cadangan di akar, biji, dan umbi.
-
Dipecah menjadi glukosa melalui enzim amilase.
Reaksi:
Pati+H2O→amilaseMaltosa→maltaseGlukosa\text{Pati} + H_2O \xrightarrow{\text{amilase}} \text{Maltosa} \xrightarrow{\text{maltase}} \text{Glukosa}Pati+H2OamilaseMaltosamaltaseGlukosa
(2) Glikogen
-
Polisakarida penyimpanan utama pada hewan.
-
Mirip dengan amilopektin, tetapi memiliki cabang yang lebih banyak dan lebih pendek.
-
Disimpan dalam hati dan otot sebagai cadangan energi jangka pendek.
-
Dapat dengan cepat dipecah menjadi glukosa melalui proses glikogenolisis oleh enzim glikogen fosforilase.
Reaksi:
Glikogen+Pi→glikogen fosforilaseGlukosa-1-fosfat\text{Glikogen} + Pi \xrightarrow{\text{glikogen fosforilase}} \text{Glukosa-1-fosfat}Glikogen+Piglikogen fosforilaseGlukosa-1-fosfat
✅ B. Polisakarida Struktural
Berfungsi sebagai penyusun struktur dalam dinding sel tumbuhan dan eksoskeleton hewan.
(3) Selulosa
-
Merupakan polimer β-D-glukosa yang dihubungkan dengan ikatan β(1→4).
-
Tersusun dalam serat panjang dan kuat → membentuk struktur utama dinding sel tumbuhan.
-
Tidak dapat dicerna oleh enzim manusia karena ikatan β-glikosidiknya (tidak memiliki enzim selulase).
-
Dapat dicerna oleh hewan pemakan tumbuhan (misalnya sapi) dengan bantuan mikroorganisme di saluran pencernaannya.
Struktur:
Glukosa+Glukosa→β(1→4)Selulosa\text{Glukosa} + \text{Glukosa} \xrightarrow{\beta(1 \to 4)} \text{Selulosa}Glukosa+Glukosaβ(1→4)Selulosa
4. Perbedaan Amilum, Glikogen, dan Selulosa
| Parameter | Amilum | Glikogen | Selulosa |
|---|---|---|---|
| Monomer | Glukosa | Glukosa | Glukosa |
| Jenis Ikatan | α(1→4) dan α(1→6) | α(1→4) dan α(1→6) | β(1→4) |
| Cabang | Sedikit (amilopektin) | Banyak dan rapat | Tidak bercabang |
| Sifat | Larut sebagian | Larut sebagian | Tidak larut |
| Fungsi | Cadangan energi di tumbuhan | Cadangan energi di hewan | Struktur dinding sel |
| Dapat dicerna manusia? | Ya | Ya | Tidak |
5. Proses Metabolisme Polisakarida
✅ Pati → dipecah oleh amilase menjadi maltosa → dipecah oleh maltase menjadi glukosa → glukosa digunakan dalam glikolisis untuk menghasilkan energi.
✅ Glikogen → dipecah oleh glikogen fosforilase → menghasilkan glukosa-1-fosfat → dikonversi menjadi glukosa-6-fosfat → masuk ke jalur glikolisis.
✅ Selulosa → tidak dapat dipecah oleh enzim manusia → digunakan sebagai serat pangan → membantu memperlancar pencernaan.
6. Peranan Polisakarida dalam Kehidupan
| Polisakarida | Peran | Contoh |
|---|---|---|
| Pati | Cadangan energi tumbuhan | Kentang, jagung, beras |
| Glikogen | Cadangan energi hewan | Hati, otot |
| Selulosa | Struktur sel tumbuhan | Dinding sel tumbuhan |
| Kitin | Struktur eksoskeleton | Serangga, jamur |
| Pektin | Pembentuk gel dalam sel tumbuhan | Buah-buahan |
7. Proses Sintesis dan Penguraian Polisakarida
-
Sintesis → Terjadi melalui reaksi kondensasi (pelepasan H₂O)
-
Penguraian → Terjadi melalui reaksi hidrolisis (penambahan H₂O)
Reaksi Sintesis:
Glukosa+Glukosa→enzimPolisakarida+H2O\text{Glukosa} + \text{Glukosa} \xrightarrow{\text{enzim}} \text{Polisakarida} + H_2OGlukosa+GlukosaenzimPolisakarida+H2O
Reaksi Hidrolisis:
Polisakarida+H2O→enzimMonosakarida\text{Polisakarida} + H_2O \xrightarrow{\text{enzim}} \text{Monosakarida}Polisakarida+H2OenzimMonosakarida
8. Kesimpulan
✅ Polisakarida adalah polimer dari monosakarida yang dihubungkan dengan ikatan glikosidik.
✅ Polisakarida berperan sebagai cadangan energi dan struktur biologis.
✅ Pati dan glikogen memiliki ikatan α, mudah dicerna oleh tubuh manusia.
✅ Selulosa memiliki ikatan β, sulit dicerna oleh manusia tetapi penting sebagai serat pangan.
✅ Amilum → Cadangan energi tumbuhan
✅ Glikogen → Cadangan energi hewan
✅ Selulosa → Struktur utama dinding sel tumbuhan
✅ Kitin → Struktur eksoskeleton hewan
68 Syarah (Penjelasan) Slide ke-34
Slide ini membahas tentang amilum (pati), yang merupakan bentuk polisakarida utama yang berperan sebagai cadangan energi pada tumbuhan. Amilum terdiri dari dua komponen utama, yaitu amilosa dan amilopektin, yang memiliki struktur dan sifat kimia yang berbeda.
1. Amilum (Pati)
Amilum adalah polisakarida penyimpanan utama pada tumbuhan, yang berfungsi sebagai sumber energi cadangan.
-
Disimpan dalam plastida (seperti amiloplas) dalam bentuk granula pati.
-
Disusun dari unit-unit glukosa yang terhubung oleh ikatan glikosidik.
-
Terdiri dari dua jenis polimer glukosa:
-
Amilosa → rantai lurus.
-
Amilopektin → rantai bercabang.
-
2. Struktur Amilum
Pati tersusun atas dua jenis polimer glukosa dengan perbedaan struktur dan sifat:
✅ A. Amilosa
-
Terdiri dari rantai tidak bercabang yang hanya memiliki ikatan α(1→4) antara molekul glukosa.
-
Bentuknya linear atau heliks.
-
Biasanya membentuk 20-30% dari total struktur pati.
-
Bersifat kurang larut dalam air karena strukturnya yang rapat dan teratur.
-
Memberikan warna biru saat bereaksi dengan iodin.
Reaksi:
Glukosa+Glukosa→α(1→4)Amilosa\text{Glukosa} + Glukosa \xrightarrow{\alpha(1\to4)} \text{Amilosa}Glukosa+Glukosaα(1→4)Amilosa
✅ B. Amilopektin
-
Terdiri dari rantai bercabang dengan ikatan α(1→4) pada rantai utama dan ikatan α(1→6) pada titik cabang.
-
Membentuk 70-80% dari total struktur pati.
-
Lebih larut dalam air dibandingkan amilosa karena percabangan membuat struktur menjadi lebih terbuka dan mudah berinteraksi dengan molekul air.
-
Memberikan warna merah keunguan saat bereaksi dengan iodin.
Reaksi:
Glukosa+Glukosa→α(1→4)Amilopektin (rantai utama)\text{Glukosa} + Glukosa \xrightarrow{\alpha(1\to4)} \text{Amilopektin (rantai utama)}Glukosa+Glukosaα(1→4)Amilopektin (rantai utama) Ikatan cabang→α(1→6)\text{Ikatan cabang} \xrightarrow{\alpha(1\to6)} Ikatan cabangα(1→6)
3. Perbandingan Amilosa dan Amilopektin
| Parameter | Amilosa | Amilopektin |
|---|---|---|
| Ikatan Glikosidik | α(1→4) | α(1→4) dan α(1→6) |
| Struktur | Rantai lurus (heliks) | Rantai bercabang |
| Kandungan dalam pati | 20–30% | 70–80% |
| Larut dalam air | Kurang larut | Lebih larut |
| Reaksi dengan Iodium | Warna biru | Warna merah keunguan |
| Tingkat pencernaan | Lambat | Lebih cepat |
| Penyimpanan energi | Kurang efisien | Lebih efisien |
4. Sintesis dan Metabolisme Amilum
🔎 Sintesis amilum terjadi melalui proses glikogenesis di plastida tumbuhan:
-
Glukosa → Glukosa-1-fosfat
-
Glukosa-1-fosfat → ADP-glukosa (melalui enzim glukosa fosforilase)
-
ADP-glukosa → Pati (melalui enzim amilosa sintase dan amilopektin sintase)
🔎 Penguraian amilum terjadi melalui proses hidrolisis:
-
Amilum → Maltosa (oleh enzim amilase)
-
Maltosa → Glukosa (oleh enzim maltase)
Reaksi Hidrolisis:
Pati+H2O→amilaseMaltosa→maltaseGlukosa\text{Pati} + H_2O \xrightarrow{\text{amilase}} \text{Maltosa} \xrightarrow{\text{maltase}} \text{Glukosa}Pati+H2OamilaseMaltosamaltaseGlukosa
5. Peran Biologis Amilum
✅ Cadangan energi → Amilum adalah bentuk utama penyimpanan energi pada tumbuhan.
✅ Sumber glukosa → Amilum akan dihidrolisis menjadi glukosa saat energi dibutuhkan.
✅ Pati resisten → Beberapa bentuk pati tidak terhidrolisis dengan mudah oleh enzim pencernaan manusia dan berfungsi sebagai serat makanan (dietary fiber).
6. Aplikasi Amilum dalam Kehidupan Sehari-hari
-
Pangan → Sumber utama karbohidrat pada beras, jagung, kentang, dan umbi-umbian.
-
Farmasi → Bahan pengisi tablet dan kapsul.
-
Industri Tekstil → Digunakan sebagai zat pengikat dan pengental.
-
Industri Kertas → Digunakan sebagai bahan perekat.
-
Produk Biodegradable → Digunakan dalam produksi plastik ramah lingkungan.
7. Reaksi dengan Iodium
✅ Reaksi amilum dengan iodium digunakan sebagai uji kualitatif untuk mendeteksi pati:
-
Amilosa → Memberi warna biru karena membentuk kompleks heliks dengan molekul iodium.
-
Amilopektin → Memberi warna merah keunguan karena struktur bercabang tidak membentuk heliks stabil.
Reaksi:
Amilum+I2→Biru atau Merah Keunguan\text{Amilum} + I_2 \xrightarrow{} \text{Biru atau Merah Keunguan}Amilum+I2Biru atau Merah Keunguan
8. Kesimpulan
✅ Amilum merupakan polisakarida penyimpanan energi utama pada tumbuhan.
✅ Terdiri dari amilosa (rantai lurus) dan amilopektin (rantai bercabang).
✅ Amilosa memberikan warna biru dengan iodium, sedangkan amilopektin memberikan warna merah keunguan.
✅ Amilosa memiliki ikatan α(1→4), sementara amilopektin memiliki ikatan α(1→4) dan α(1→6) di titik cabang.
✅ Amilopektin lebih mudah larut dan lebih cepat terhidrolisis dibandingkan amilosa.
✅ Amilosa = Linear, ikatan α(1→4) → Lambat dicerna
✅ Amilopektin = Bercabang, ikatan α(1→4) dan α(1→6) → Lebih cepat dicerna
70 Syarah (Penjelasan) Slide ke-35
Slide ini membahas struktur kimia amilosa dan ikatan glikosidik yang menjadi dasar pembentukannya. Amilosa adalah salah satu komponen utama dalam amilum (pati), yang memiliki struktur linear dan terhubung oleh ikatan α(1→4) glikosida.
1. Struktur Amilosa
Amilosa adalah polisakarida linear yang tersusun dari unit-unit D-glukosa yang saling terhubung melalui ikatan glikosidik α(1→4).
-
Sifat linear dari amilosa memungkinkan pembentukan struktur heliks (spiral).
-
Ikatan α(1→4) menyebabkan struktur amilosa memiliki fleksibilitas dan dapat membentuk heliks stabil.
-
Panjang rantai amilosa bervariasi, dengan jumlah unit glukosa mulai dari 300 hingga lebih dari 3000.
2. Ikatan α(1→4) Glikosidik
🔎 Ikatan α(1→4) glikosidik adalah jenis ikatan yang menghubungkan atom karbon C1 dari satu molekul glukosa dengan atom karbon C4 dari molekul glukosa lainnya melalui reaksi kondensasi (pelepasan molekul air).
-
α → posisi gugus -OH pada atom karbon C1 berada di bawah bidang cincin glukosa.
-
(1→4) → menunjukkan posisi atom karbon yang terlibat dalam pembentukan ikatan.
Reaksi Pembentukan:
Glukosa+Glukosa→enzimAmilosa+H2O\text{Glukosa} + \text{Glukosa} \xrightarrow{enzim} \text{Amilosa} + H_2OGlukosa+GlukosaenzimAmilosa+H2O
3. Sifat Kimia Amilosa
✅ Larut dalam air panas karena struktur heliksnya memungkinkan molekul air masuk ke dalam struktur heliks.
✅ Memberikan warna biru saat direaksikan dengan iodin karena molekul iodin terperangkap di dalam heliks amilosa.
✅ Memiliki berat molekul tinggi → memberikan viskositas tinggi dalam larutan.
✅ Bersifat lebih tahan terhadap hidrolisis dibandingkan amilopektin karena tidak memiliki percabangan.
4. Peran Amilosa dalam Pati
🔎 Amilosa merupakan 20–30% dari total struktur pati.
🔎 Bersifat lebih lambat dicerna karena struktur linear sulit ditembus oleh enzim amilase.
🔎 Memberikan tekstur yang keras pada makanan karena membentuk struktur yang lebih kaku.
🔎 Lebih tahan terhadap retrogradasi dibandingkan amilopektin, sehingga amilosa berperan dalam pembentukan tekstur padat pada produk pangan seperti nasi dingin atau roti.
5. Hubungan Antara Struktur dan Fungsi Amilosa
| Struktur | Pengaruh pada Sifat |
|---|---|
| Ikatan α(1→4) glikosidik | Membentuk rantai linear |
| Struktur heliks | Memberikan kemampuan untuk membentuk kompleks dengan iodin → Warna biru |
| Tidak bercabang | Membuatnya lebih tahan terhadap hidrolisis |
| Rantai panjang | Memberikan viskositas tinggi pada larutan pati |
| Larut dalam air panas | Memungkinkan amilosa berperan dalam pembentukan gel dan tekstur makanan |
6. Perbedaan Amilosa vs Amilopektin
| Parameter | Amilosa | Amilopektin |
|---|---|---|
| Struktur | Linear (tidak bercabang) | Bercabang |
| Ikatan Glikosidik | α(1→4) | α(1→4) dan α(1→6) |
| Larut dalam air | Kurang larut | Lebih larut |
| Perbandingan dalam Pati | 20–30% | 70–80% |
| Warna dengan Iodin | Biru | Merah keunguan |
| Kecepatan Pencernaan | Lebih lambat | Lebih cepat |
7. Aplikasi Amilosa dalam Industri
✅ Industri pangan → Amilosa digunakan untuk meningkatkan kekentalan dan stabilitas pada produk makanan seperti puding, saus, dan minuman.
✅ Farmasi → Amilosa digunakan sebagai bahan perekat dalam pembuatan tablet.
✅ Industri tekstil → Digunakan sebagai zat pengental dan bahan pelapis kain.
✅ Plastik biodegradable → Amilosa digunakan untuk pembuatan plastik ramah lingkungan karena dapat terdegradasi oleh mikroorganisme.
8. Proses Hidrolisis Amilosa
Amilosa dapat dihidrolisis oleh enzim:
-
α-amilase → Memutus ikatan α(1→4) secara acak → membentuk maltosa dan oligosakarida.
-
β-amilase → Memutus ikatan α(1→4) dari ujung non-pereduksi → membentuk maltosa.
-
Glucoamilase → Memutus semua ikatan hingga menghasilkan glukosa bebas.
Reaksi Hidrolisis:
Amilosa+H2O→α−amilaseMaltosa+Oligosakarida\text{Amilosa} + H_2O \xrightarrow{\alpha-\text{amilase}} \text{Maltosa} + \text{Oligosakarida}Amilosa+H2Oα−amilaseMaltosa+Oligosakarida
9. Kesimpulan
✅ Amilosa adalah polisakarida linear yang disusun oleh unit glukosa melalui ikatan α(1→4).
✅ Struktur heliks memungkinkan amilosa bereaksi dengan iodin membentuk warna biru.
✅ Amilosa lebih tahan terhadap hidrolisis karena tidak memiliki percabangan.
✅ Peran biologis amilosa dalam penyimpanan energi bersifat lambat dilepaskan karena strukturnya yang linear dan rapat.
✅ Pati dengan kadar amilosa tinggi menghasilkan tekstur keras pada produk pangan setelah pendinginan (contoh: nasi dingin).
✅ Ikatan α(1→4) glikosidik → Membentuk struktur linear
✅ Struktur heliks → Membentuk kompleks dengan iodin
✅ Lebih tahan terhadap hidrolisis → Memberikan viskositas tinggi
✅ Cadangan energi jangka panjang → Dicerna lebih lambat dibandingkan amilopektin
72 Syarah (Penjelasan) Slide ke-36
Slide ini membahas struktur amilopektin, yang merupakan polisakarida bercabang dan komponen utama dari pati. Amilopektin adalah struktur polisakarida kompleks yang tersusun dari unit D-glukosa yang terhubung melalui ikatan glikosidik α(1→4) dan α(1→6), sehingga membentuk struktur bercabang.
1. Struktur Amilopektin
Amilopektin adalah polisakarida bercabang yang terdiri dari unit-unit D-glukosa yang terhubung oleh dua jenis ikatan glikosidik:
-
Ikatan α(1→4) glikosidik → membentuk rantai utama (linear).
-
Ikatan α(1→6) glikosidik → membentuk cabang pada struktur utama.
Struktur amilopektin mirip dengan glikogen, tetapi dengan tingkat percabangan yang lebih rendah dibandingkan glikogen.
2. Ikatan Glikosidik pada Amilopektin
🔎 Ikatan α(1→4) Glikosidik
-
Ikatan ini menghubungkan atom karbon C1 dari satu molekul glukosa dengan atom karbon C4 dari molekul glukosa lainnya.
-
Ikatan ini menyebabkan terbentuknya struktur linear pada rantai utama amilopektin.
🔎 Ikatan α(1→6) Glikosidik
-
Ikatan ini menghubungkan atom karbon C1 dari satu molekul glukosa dengan atom karbon C6 dari molekul glukosa lainnya.
-
Ikatan ini menyebabkan terbentuknya percabangan pada struktur amilopektin.
-
Percabangan ini terjadi setiap 24–30 unit glukosa dalam rantai utama.
Reaksi Pembentukan:
Glukosa+Glukosa→enzim branchingAmilopektin+H2O\text{Glukosa} + \text{Glukosa} \xrightarrow{\text{enzim branching}} \text{Amilopektin} + H_2OGlukosa+Glukosaenzim branchingAmilopektin+H2O
3. Sifat Kimia Amilopektin
✅ Bercabang → Lebih mudah terdegradasi oleh enzim karena percabangan mempermudah akses enzim ke ikatan glikosidik.
✅ Lebih mudah larut dalam air → Percabangan memperbesar luas permukaan sehingga lebih mudah berinteraksi dengan air.
✅ Memberikan warna merah keunguan dengan larutan iodin karena strukturnya yang bercabang dan tidak membentuk heliks sempurna seperti amilosa.
✅ Lebih cepat terhidrolisis dibandingkan amilosa karena percabangan mempercepat aksi enzim amilase.
4. Peran Amilopektin dalam Pati
Amilopektin merupakan 70–80% dari total kandungan pati dalam tumbuhan.
-
Memberikan tekstur lengket pada makanan karena sifat bercabang meningkatkan daya ikat molekul air.
-
Sifat mudah larut menyebabkan amilopektin lebih mudah dicerna dibandingkan amilosa.
-
Pati yang tinggi kandungan amilopektin → menghasilkan produk yang bersifat lembut dan kenyal (contoh: beras ketan).
Contoh Sumber Amilopektin Tinggi:
✅ Beras ketan
✅ Jagung lilin
✅ Kentang
✅ Ubi jalar
5. Proses Hidrolisis Amilopektin
Amilopektin dapat dihidrolisis oleh enzim:
-
α-amilase → memutus ikatan α(1→4) secara acak pada rantai utama → menghasilkan maltosa dan dekstrin.
-
β-amilase → memutus ikatan α(1→4) dari ujung non-pereduksi → menghasilkan maltosa.
-
Enzim debranching (enzim pullulanase) → memutus ikatan α(1→6) → melepaskan cabang menjadi molekul glukosa atau maltosa.
Reaksi Hidrolisis:
Amilopektin+H2O→α−amilaseMaltosa + Dekstrin\text{Amilopektin} + H_2O \xrightarrow{\alpha-\text{amilase}} \text{Maltosa + Dekstrin}Amilopektin+H2Oα−amilaseMaltosa + Dekstrin
6. Perbedaan Amilopektin vs Amilosa
| Parameter | Amilopektin | Amilosa |
|---|---|---|
| Struktur | Bercabang | Linear |
| Ikatan Glikosidik | α(1→4) dan α(1→6) | α(1→4) |
| Kelarutan | Lebih mudah larut dalam air | Kurang larut |
| Proses Pencernaan | Lebih cepat dicerna | Lebih lambat dicerna |
| Warna dengan Iodin | Merah keunguan | Biru |
| Perbandingan dalam Pati | 70–80% | 20–30% |
| Tekstur pada Produk | Lunak dan kenyal | Keras dan padat |
7. Fungsi dan Peran Amilopektin dalam Tubuh
✅ Sumber energi cepat → Struktur bercabang memungkinkan pelepasan glukosa dengan cepat saat dipecah oleh enzim amilase.
✅ Pencernaan lebih cepat → Karena percabangan memberikan banyak titik akses bagi enzim amilase.
✅ Cadangan energi jangka pendek → Karena glukosa dari amilopektin cepat tersedia dalam tubuh untuk metabolisme energi.
8. Hubungan Struktur dan Fungsi
| Struktur | Pengaruh pada Sifat |
|---|---|
| Ikatan α(1→4) glikosidik | Membentuk rantai utama |
| Ikatan α(1→6) glikosidik | Membentuk percabangan |
| Percabangan tinggi | Lebih mudah larut dan cepat terhidrolisis |
| Struktur fleksibel | Dapat menyimpan dan melepaskan glukosa dengan cepat |
| Penyimpanan di tumbuhan | Memberikan energi cadangan untuk metabolisme |
9. Peran Amilopektin dalam Industri
✅ Pangan → Memberikan tekstur kenyal dan lunak pada makanan.
✅ Farmasi → Sebagai bahan pengikat tablet dan agen pengental.
✅ Tekstil → Digunakan untuk finishing tekstil karena memberikan tekstur lembut.
✅ Industri kertas → Sebagai bahan pengikat untuk meningkatkan kekuatan kertas.
10. Kesimpulan
✅ Amilopektin adalah polisakarida bercabang yang membentuk struktur kompleks melalui ikatan α(1→4) dan α(1→6).
✅ Percabangan membuat amilopektin lebih mudah larut dan lebih cepat terhidrolisis dibandingkan amilosa.
✅ Amilopektin merupakan komponen utama dalam pati, memberikan tekstur lembut dan menjadi sumber energi yang cepat tersedia.
✅ Karena percabangannya, amilopektin lebih mudah digunakan dalam berbagai produk makanan dan industri.
✅ Ikatan α(1→4) glikosidik → Membentuk rantai utama
✅ Ikatan α(1→6) glikosidik → Membentuk percabangan
✅ Percabangan tinggi → Cepat terhidrolisis → Sumber energi cepat
✅ Produk pangan → Beras ketan, kentang, jagung lilin
74 Syarah (Penjelasan) Slide ke-37
Slide ini menjelaskan struktur amilopektin secara lebih rinci dengan menampilkan susunan molekul dan ikatan glikosidik yang membentuk percabangan dalam struktur amilopektin. Amilopektin adalah polisakarida bercabang yang merupakan salah satu komponen utama dari pati (sekitar 70–80%). Struktur ini terdiri dari unit-unit D-glukosa yang saling berikatan melalui ikatan glikosidik dengan pola tertentu, membentuk cabang.
1. Struktur Amilopektin
Amilopektin memiliki struktur dasar yang tersusun dari:
✅ Unit D-glukosa yang saling terikat melalui dua jenis ikatan glikosidik:
-
Ikatan α(1→4) glikosidik → membentuk rantai utama (linear).
-
Ikatan α(1→6) glikosidik → membentuk cabang pada rantai utama.
Amilopektin memiliki struktur yang mirip dengan glikogen, tetapi dengan tingkat percabangan yang lebih jarang.
2. Ikatan Glikosidik pada Amilopektin
-
Ikatan α(1→4) Glikosidik
➡️ Terjadi antara atom karbon C1 dari satu molekul glukosa dengan atom karbon C4 dari molekul glukosa lainnya.
➡️ Membentuk struktur linear pada rantai utama amilopektin.
Reaksi Pembentukan:
Glukosa+Glukosa→α−amilaseMaltosa\text{Glukosa} + \text{Glukosa} \xrightarrow{\alpha-\text{amilase}} \text{Maltosa}Glukosa+Glukosaα−amilaseMaltosa
-
Ikatan α(1→6) Glikosidik
➡️ Terjadi antara atom karbon C1 dari satu molekul glukosa dengan atom karbon C6 dari molekul glukosa lainnya.
➡️ Ikatan ini membentuk percabangan pada struktur amilopektin.
➡️ Percabangan ini terjadi setiap 24–30 unit glukosa.
Reaksi Pembentukan:
Glukosa+Glukosa→Branching EnzymeIkatan α(1→6)\text{Glukosa} + \text{Glukosa} \xrightarrow{\text{Branching Enzyme}} \text{Ikatan α(1→6)}Glukosa+GlukosaBranching EnzymeIkatan α(1→6)
3. Sifat Fisik dan Kimia Amilopektin
✅ Struktur bercabang → Memberikan sifat kelarutan yang tinggi dalam air.
✅ Percabangan tinggi → Membuatnya lebih mudah dihidrolisis oleh enzim amilase.
✅ Warna merah keunguan dengan larutan iodin karena struktur bercabang tidak membentuk heliks sempurna.
✅ Lebih cepat dicerna dibandingkan amilosa karena percabangan menyediakan lebih banyak titik akses bagi enzim.
4. Proses Hidrolisis Amilopektin
Amilopektin dihidrolisis oleh tiga jenis enzim utama:
-
α-amilase
➡️ Memecah ikatan α(1→4) → menghasilkan maltosa dan dekstrin. -
β-amilase
➡️ Memecah ikatan α(1→4) dari ujung non-pereduksi → menghasilkan maltosa. -
Enzim debranching (enzim pullulanase)
➡️ Memecah ikatan α(1→6) → melepaskan cabang menjadi molekul glukosa atau maltosa.
5. Peran Amilopektin dalam Pati
✅ Amilopektin menyusun sekitar 70–80% dari total pati dalam tumbuhan.
✅ Karena sifat bercabangnya, amilopektin:
-
Lebih mudah larut dalam air.
-
Lebih cepat dihidrolisis oleh enzim dibandingkan amilosa.
-
Memberikan tekstur lengket pada makanan berbasis pati (misalnya beras ketan).
-
Memengaruhi indeks glikemik makanan karena struktur bercabang meningkatkan laju pencernaan dan pelepasan glukosa.
6. Perbedaan Amilopektin vs Amilosa
| Parameter | Amilopektin | Amilosa |
|---|---|---|
| Struktur | Bercabang | Linear |
| Ikatan Glikosidik | α(1→4) dan α(1→6) | α(1→4) |
| Kelarutan dalam Air | Tinggi | Rendah |
| Warna dengan Iodin | Merah keunguan | Biru |
| Laju Pencernaan | Cepat | Lambat |
| Contoh | Beras ketan, ubi, kentang | Gandum, jagung |
| Tekstur Produk | Kenyal, lembut | Padat, keras |
7. Fungsi dan Peran Amilopektin dalam Tubuh
✅ Sebagai cadangan energi jangka pendek → karena pelepasan glukosa berlangsung cepat.
✅ Lebih cepat dicerna → karena percabangan memberikan banyak titik akses untuk aksi enzim.
✅ Meningkatkan kadar gula darah lebih cepat dibandingkan amilosa → memberikan energi cepat.
✅ Meningkatkan indeks glikemik makanan karena struktur bercabang mudah dipecah.
8. Peran Amilopektin dalam Industri
✅ Pangan
-
Memberikan tekstur lengket dan kenyal pada produk seperti ketan dan roti.
-
Sumber utama untuk membuat sirup glukosa, maltodekstrin, dan pemanis.
✅ Farmasi
-
Sebagai pengisi tablet dan bahan pengikat.
-
Meningkatkan daya tahan dan pelepasan zat aktif.
✅ Industri tekstil dan kertas
-
Sebagai bahan perekat dan bahan penguat.
-
Memberikan daya tahan dan tekstur pada kain dan kertas.
9. Kesimpulan
✅ Amilopektin adalah polisakarida bercabang yang tersusun dari unit glukosa dengan ikatan α(1→4) dan α(1→6).
✅ Ikatan α(1→4) membentuk rantai utama, sedangkan ikatan α(1→6) membentuk percabangan.
✅ Sifat bercabang membuat amilopektin:
-
Lebih mudah larut
-
Lebih cepat terhidrolisis
-
Lebih mudah dicerna
✅ Amilopektin memiliki peran penting sebagai cadangan energi dalam tumbuhan dan sumber energi cepat bagi tubuh manusia.
✅ Amilopektin banyak digunakan dalam industri pangan, farmasi, dan tekstil karena sifatnya yang mudah larut dan fleksibel.
✅ Ikatan α(1→4) glikosidik → Struktur rantai utama
✅ Ikatan α(1→6) glikosidik → Membentuk percabangan
✅ Percabangan tinggi → Mudah larut dan cepat terhidrolisis
✅ Pati kaya amilopektin → Beras ketan, ubi, kentang
✅ Indeks Glikemik Tinggi → Menyediakan energi cepat
76 Syarah (Penjelasan) Slide ke-38
Slide ini menjelaskan struktur heliks yang dibentuk oleh amilosa dan amilopektin. Struktur heliks adalah bentuk khas dari rantai polisakarida yang memungkinkan molekul glukosa tersusun dalam bentuk spiral atau gulungan untuk menciptakan stabilitas struktur dan mempermudah penyimpanan energi.
1. Struktur Heliks pada Amilosa dan Amilopektin
✅ Amilosa → Membentuk struktur heliks tunggal (lebih teratur).
✅ Amilopektin → Membentuk struktur heliks bercabang karena adanya ikatan α(1→6) yang membentuk percabangan.
Struktur heliks ini dihasilkan oleh interaksi antar molekul melalui:
-
Ikatan hidrogen → Antara gugus hidroksil (-OH) pada molekul glukosa.
-
Gaya Van der Waals → Memberikan stabilitas tambahan pada heliks.
➡️ Amilosa membentuk heliks kompak karena strukturnya linear tanpa percabangan.
➡️ Amilopektin membentuk heliks bercabang karena memiliki banyak percabangan yang memungkinkan fleksibilitas struktur.
2. Struktur Heliks Amilosa
Amilosa terdiri dari unit D-glukosa yang dihubungkan oleh ikatan α(1→4) glikosidik.
-
Bentuk linier ini memungkinkan molekul untuk melilit membentuk struktur heliks tunggal.
-
Setiap putaran heliks pada amilosa mencakup sekitar 6 unit glukosa.
-
Struktur ini lebih rapat dan teratur dibandingkan amilopektin.
➡️ Amilosa dapat bereaksi dengan iodin menghasilkan warna biru tua karena iodin dapat masuk ke dalam rongga heliks amilosa.
Reaksi dengan Iodin:
Amilosa+Iodin→Kompleks Iodin-Amilosa (warna biru)\text{Amilosa} + \text{Iodin} \xrightarrow{} \text{Kompleks Iodin-Amilosa (warna biru)}Amilosa+IodinKompleks Iodin-Amilosa (warna biru)
3. Struktur Heliks Amilopektin
Amilopektin terdiri dari unit D-glukosa yang dihubungkan oleh:
-
Ikatan α(1→4) glikosidik → Membentuk rantai utama.
-
Ikatan α(1→6) glikosidik → Membentuk percabangan setiap 24–30 unit glukosa.
➡️ Struktur bercabang ini memungkinkan amilopektin membentuk heliks pendek pada rantai utama dan percabangan, tetapi struktur heliksnya tidak sekokoh amilosa karena percabangan mengganggu keteraturan struktur heliks.
➡️ Reaksi dengan iodin menghasilkan warna merah keunguan karena iodin tidak dapat sepenuhnya masuk ke dalam heliks akibat struktur yang tidak teratur.
Reaksi dengan Iodin:
Amilopektin+Iodin→Kompleks Iodin-Amilopektin (warna merah keunguan)\text{Amilopektin} + \text{Iodin} \xrightarrow{} \text{Kompleks Iodin-Amilopektin (warna merah keunguan)}Amilopektin+IodinKompleks Iodin-Amilopektin (warna merah keunguan)
4. Perbedaan Heliks Amilosa vs Amilopektin
| Parameter | Amilosa | Amilopektin |
|---|---|---|
| Struktur | Linear | Bercabang |
| Ikatan Glikosidik | α(1→4) | α(1→4) dan α(1→6) |
| Bentuk Heliks | Kompak dan teratur | Lebih longgar dan fleksibel |
| Interaksi dengan Iodin | Warna biru tua | Warna merah keunguan |
| Kelurusan Struktur | Lurus → membentuk heliks kompak | Bercabang → membentuk heliks tidak teratur |
| Kelarutan dalam Air | Lebih rendah karena struktur kompak | Lebih tinggi karena percabangan mempermudah akses air |
5. Fungsi dan Peran Struktur Heliks dalam Amilosa dan Amilopektin
✅ Amilosa
-
Struktur heliks kompak → Memberikan daya tahan tinggi terhadap degradasi enzimatis.
-
Digunakan untuk penyimpanan energi jangka panjang dalam tumbuhan.
-
Membentuk tekstur lebih keras pada pati makanan yang kaya amilosa (contoh: beras pera).
✅ Amilopektin
-
Struktur heliks bercabang → Memberikan akses enzim lebih mudah → Mudah dicerna.
-
Digunakan untuk penyimpanan energi jangka pendek karena mudah dipecah.
-
Membentuk tekstur lebih lengket dan kenyal pada pati makanan yang kaya amilopektin (contoh: beras ketan).
6. Hubungan dengan Pencernaan dan Indeks Glikemik
-
Amilopektin memiliki struktur bercabang → Enzim amilase mudah mengakses titik pemecahan → Pencernaan lebih cepat → Indeks glikemik tinggi
-
Amilosa memiliki struktur heliks rapat → Lebih sulit dicerna → Indeks glikemik rendah
➡️ Beras ketan → Kandungan amilopektin tinggi → Lebih cepat meningkatkan kadar glukosa darah.
➡️ Beras pera → Kandungan amilosa tinggi → Kadar glukosa darah meningkat lebih lambat.
7. Peran Struktur Heliks dalam Industri
✅ Pangan
-
Amilopektin → Memberikan tekstur lembut dan elastis pada produk seperti roti, kue, dan mochi.
-
Amilosa → Memberikan tekstur kering dan keras pada produk seperti biskuit dan kerupuk.
✅ Farmasi
-
Amilosa → Digunakan sebagai pengisi tablet → Meningkatkan daya tahan dan ketahanan larut.
-
Amilopektin → Digunakan untuk mempercepat pelepasan zat aktif dalam tablet.
✅ Tekstil dan Kertas
-
Amilosa → Memberikan sifat kaku dan kering.
-
Amilopektin → Memberikan sifat fleksibel dan mudah dibentuk.
8. Kesimpulan
✅ Amilosa dan amilopektin membentuk struktur heliks karena adanya ikatan α(1→4) glikosidik.
✅ Amilopektin memiliki struktur lebih fleksibel karena bercabang → lebih mudah dicerna → indeks glikemik tinggi.
✅ Amilosa membentuk struktur lebih rapat → lebih tahan terhadap degradasi → indeks glikemik rendah.
✅ Struktur heliks memungkinkan molekul untuk menyimpan energi dalam bentuk yang lebih stabil dan efisien.
✅ Amilosa → Heliks kompak → Indeks Glikemik Rendah
✅ Amilopektin → Heliks bercabang → Indeks Glikemik Tinggi
✅ Peran dalam industri → Tekstur, kelarutan, dan daya tahan produk
78 Syarah (Penjelasan) Slide ke-39
Slide ini membahas tentang glikogen, yang merupakan polisakarida simpanan utama dalam tubuh hewan. Glikogen memiliki struktur yang mirip dengan amilopektin, namun memiliki tingkat percabangan yang lebih tinggi karena adanya lebih banyak ikatan α(1→6) glikosidik.
1. Struktur Glikogen
✅ Glikogen terdiri dari unit D-glukosa yang dihubungkan oleh:
-
Ikatan α(1→4) glikosidik → Membentuk rantai utama glukosa.
-
Ikatan α(1→6) glikosidik → Membentuk percabangan yang terjadi setiap 8–12 residu glukosa (lebih sering dibandingkan amilopektin).
➡️ Karena memiliki lebih banyak percabangan, glikogen memiliki struktur yang lebih kompak dan lebih larut dalam air dibandingkan amilopektin.
➡️ Percabangan yang tinggi memungkinkan lebih banyak titik akses bagi enzim glikogen fosforilase untuk memecah glikogen menjadi glukosa.
Reaksi dasar pembentukan ikatan dalam glikogen:
Glukosa-1-fosfat→UDP-glukosa pirofosforilaseUDP-glukosa→Glikogen sintaseIkatan α(1→4) glikosidik\text{Glukosa-1-fosfat} \xrightarrow{\text{UDP-glukosa pirofosforilase}} \text{UDP-glukosa} \xrightarrow{\text{Glikogen sintase}} \text{Ikatan α(1→4) glikosidik}Glukosa-1-fosfatUDP-glukosa pirofosforilaseUDP-glukosaGlikogen sintaseIkatan α(1→4) glikosidik
Enzim Branching (1→6):
Glikogen branching enzim→Ikatan α(1→6) glikosidik\text{Glikogen branching enzim} \xrightarrow{} \text{Ikatan α(1→6) glikosidik}Glikogen branching enzimIkatan α(1→6) glikosidik
2. Ciri Khas Glikogen Dibanding Amilopektin
| Parameter | Amilopektin | Glikogen |
|---|---|---|
| Ikatan utama | α(1→4) glikosidik | α(1→4) glikosidik |
| Percabangan | α(1→6) setiap 24–30 residu | α(1→6) setiap 8–12 residu |
| Tingkat percabangan | Lebih rendah | Lebih tinggi |
| Kelarutan dalam air | Relatif rendah | Lebih tinggi |
| Penyimpanan | Pada tumbuhan (pati) | Pada hewan (hati dan otot) |
| Aksesibilitas oleh enzim | Lebih lambat | Lebih cepat |
| Kepadatan energi | Rendah | Lebih tinggi |
➡️ Tingkat percabangan yang lebih tinggi dalam glikogen menciptakan lebih banyak titik akses bagi enzim untuk degradasi → memungkinkan pelepasan glukosa lebih cepat untuk memenuhi kebutuhan energi.
3. Fungsi dan Peran Glikogen
✅ Sumber energi cadangan utama dalam tubuh hewan → disimpan di:
-
Hati → Glikogen di hati berfungsi untuk menjaga kadar glukosa darah (homeostasis glukosa).
-
Otot → Glikogen di otot berfungsi untuk menyediakan energi langsung selama aktivitas fisik (glikolisis).
✅ Pengaturan metabolisme glikogen dikontrol oleh hormon:
-
Insulin → Merangsang pembentukan glikogen (glikogenesis).
-
Glukagon → Merangsang pemecahan glikogen (glikogenolisis).
-
Adrenalin → Merangsang pemecahan glikogen di otot selama aktivitas fisik atau stres.
➡️ Proses penguraian glikogen (glikogenolisis):
-
Glikogen → dipecah oleh enzim glikogen fosforilase → menghasilkan glukosa-1-fosfat
-
Glukosa-1-fosfat → diubah menjadi glukosa-6-fosfat oleh enzim fosfoglukomutase
-
Di hati → glukosa-6-fosfat diubah menjadi glukosa oleh glukosa-6-fosfatase → masuk ke dalam darah
-
Di otot → glukosa-6-fosfat masuk ke jalur glikolisis → menjadi ATP
4. Kenapa Percabangan Tinggi Penting?
✅ Lebih banyak titik cabang → lebih banyak titik akses untuk enzim →
➡️ Proses penguraian glikogen menjadi glukosa lebih cepat saat tubuh membutuhkan energi dalam waktu singkat.
✅ Percabangan meningkatkan kelarutan →
➡️ Glikogen dapat disimpan dalam konsentrasi tinggi di dalam sel tanpa menyebabkan osmotik yang berlebihan.
✅ Metabolisme glikogen lebih efisien →
➡️ Struktur bercabang memberikan lebih banyak titik awal untuk aksi enzim → mempercepat pelepasan energi selama aktivitas tinggi.
5. Regulasi Metabolisme Glikogen
➡️ Glikogenesis (Sintesis Glikogen):
-
Dirangsang oleh insulin (setelah makan).
-
Glukosa berlebih → disimpan sebagai glikogen di hati dan otot.
➡️ Glikogenolisis (Pemecahan Glikogen):
-
Dirangsang oleh glukagon (dalam kondisi puasa) dan adrenalin (saat stres atau aktivitas fisik).
-
Glikogen → dipecah menjadi glukosa untuk menjaga kadar glukosa darah atau memberikan energi untuk kontraksi otot.
➡️ Efek olahraga →
-
Aktivitas fisik merangsang pelepasan adrenalin → meningkatkan glikogenolisis → menyediakan ATP untuk kontraksi otot.
6. Perbedaan Glikogen di Hati vs Otot
| Lokasi | Fungsi | Keterangan |
|---|---|---|
| Hati | Menjaga kadar glukosa darah (homeostasis) | Glukosa hasil degradasi glikogen dilepaskan ke darah |
| Otot | Menyediakan energi untuk kontraksi otot | Glukosa hasil degradasi glikogen masuk ke jalur glikolisis untuk membentuk ATP |
➡️ Glikogen hati → menyediakan glukosa untuk seluruh tubuh.
➡️ Glikogen otot → menyediakan energi lokal untuk kontraksi otot.
7. Fungsi Glikogen dalam Kondisi Normal dan Stres
✅ Kondisi normal:
-
Glikogen di hati → menjaga kadar glukosa darah tetap stabil.
-
Glikogen di otot → menyediakan energi untuk aktivitas ringan.
✅ Kondisi stres atau aktivitas tinggi:
-
Glikogen di hati dan otot → dipecah lebih cepat untuk menyediakan energi segera.
-
Aktivasi oleh adrenalin → meningkatkan metabolisme glikogenolisis di otot dan hati.
8. Peran Glikogen dalam Penyakit dan Kondisi Klinis
✅ Hipo/Hiperglikemia → Ketidakseimbangan metabolisme glikogen menyebabkan gangguan kadar glukosa darah.
✅ Glikogenosis (Penyakit Penyimpanan Glikogen):
-
Penyakit akibat kelainan metabolisme glikogen → glikogen terakumulasi di hati atau otot → menyebabkan gangguan metabolisme.
➡️ Penyakit Pompe → Defisiensi enzim asam maltase → akumulasi glikogen dalam lisosom.
➡️ Penyakit McArdle → Defisiensi enzim glikogen fosforilase → otot tidak dapat menggunakan glikogen untuk energi → menyebabkan kelelahan otot.
9. Kesimpulan
✅ Glikogen adalah polisakarida simpanan utama dalam tubuh hewan.
✅ Struktur mirip amilopektin tetapi lebih bercabang → mempercepat akses enzim.
✅ Disimpan di hati dan otot → hati untuk regulasi glukosa darah, otot untuk kontraksi otot.
✅ Hormon insulin, glukagon, dan adrenalin mengatur metabolisme glikogen.
✅ Struktur bercabang tinggi memungkinkan penguraian cepat untuk menyediakan energi saat dibutuhkan.
80 Syarah (Penjelasan) Slide ke-40
Slide ini membahas struktur glikogen secara lebih detail, terutama tentang jenis ikatan yang terdapat di dalamnya, yaitu ikatan α(1→4) glikosidik dan ikatan α(1→6) glikosidik yang membentuk percabangan.
1. Struktur Glikogen dalam Detail
✅ Glikogen adalah polisakarida simpanan utama dalam tubuh hewan, yang terdiri dari residu D-glukosa yang dihubungkan oleh:
-
Ikatan α(1→4) glikosidik → Membentuk rantai utama glukosa yang memanjang.
-
Ikatan α(1→6) glikosidik → Membentuk titik percabangan pada setiap 8–12 residu glukosa.
➡️ Ikatan α(1→4) glikosidik dihasilkan oleh enzim glikogen sintase yang bekerja dengan menambahkan molekul glukosa-1-fosfat ke rantai glikogen.
➡️ Ikatan α(1→6) glikosidik dihasilkan oleh enzim branching enzyme yang memotong sebagian rantai utama dan menempelkannya ke posisi baru melalui ikatan α(1→6).
2. Detail Ikatan dalam Glikogen
🧪 Ikatan α(1→4) glikosidik
➡️ Merupakan ikatan utama dalam glikogen → Membentuk rantai lurus dari residu D-glukosa.
➡️ Setiap molekul glukosa ditambahkan melalui ujung non-pereduksi oleh glikogen sintase.
💡 Reaksi pembentukan ikatan α(1→4):
UDP-glukosa+Glikogen (n)→Glikogen sintaseGlikogen (n+1)+UDP\text{UDP-glukosa} + \text{Glikogen (n)} \xrightarrow{\text{Glikogen sintase}} \text{Glikogen (n+1)} + \text{UDP}UDP-glukosa+Glikogen (n)Glikogen sintaseGlikogen (n+1)+UDP
🧪 Ikatan α(1→6) glikosidik
➡️ Membentuk percabangan dalam struktur glikogen.
➡️ Percabangan terjadi setiap 8–12 residu → dihasilkan oleh branching enzyme.
➡️ Ikatan ini memudahkan akses enzim untuk memecah glikogen menjadi glukosa dengan cepat saat dibutuhkan.
💡 Reaksi pembentukan ikatan α(1→6):
-
Enzim branching enzyme memotong fragmen rantai lurus yang telah terbentuk oleh ikatan α(1→4).
-
Fragmen tersebut dipindahkan ke posisi baru dan diikat melalui ikatan α(1→6).
3. Percabangan pada Glikogen
✅ Tingkat percabangan dalam glikogen lebih tinggi dibandingkan dengan amilopektin → hal ini menciptakan struktur kompak dan lebih mudah dipecah.
✅ Percabangan → menyediakan lebih banyak ujung non-pereduksi yang dapat menjadi titik kerja untuk enzim glikogen fosforilase saat pemecahan glikogen.
✅ Struktur bercabang → memungkinkan penguraian yang lebih cepat dan pemulihan energi yang lebih cepat selama aktivitas fisik atau stres metabolik.
➡️ Efek percabangan:
-
Semakin tinggi jumlah percabangan → semakin mudah glikogen dipecah oleh enzim.
-
Semakin banyak ujung non-pereduksi → semakin banyak enzim yang dapat bekerja secara bersamaan → penyediaan energi lebih cepat.
4. Mengapa Glikogen Lebih Bercabang dari Amilopektin?
✅ Percabangan tinggi memberikan beberapa keuntungan:
-
Kompak → lebih banyak glukosa bisa disimpan dalam ruang kecil.
-
Cepat dipecah → percabangan menyediakan banyak titik kerja untuk enzim glikogen fosforilase.
-
Pelepasan glukosa cepat → penting dalam aktivitas fisik dan saat kadar glukosa darah menurun.
➡️ Amilopektin → memiliki ikatan α(1→6) setiap 24–30 residu.
➡️ Glikogen → memiliki ikatan α(1→6) setiap 8–12 residu → jauh lebih bercabang dan mudah dipecah.
5. Keuntungan Percabangan Tinggi pada Glikogen
| Faktor | Glikogen | Amilopektin |
|---|---|---|
| Tingkat percabangan | Tinggi (setiap 8–12 residu) | Lebih rendah (setiap 24–30 residu) |
| Aksesibilitas enzim | Tinggi → cepat dipecah menjadi glukosa | Rendah → pelepasan glukosa lebih lambat |
| Fungsi utama | Sumber energi cepat di hewan | Cadangan energi di tumbuhan |
| Kelimpahan | Terdapat di hati dan otot | Terdapat di jaringan tumbuhan |
➡️ Tingkat percabangan yang tinggi memungkinkan pemecahan glikogen menjadi glukosa dalam waktu yang sangat singkat untuk menyediakan energi selama kontraksi otot atau stres metabolik.
6. Peran Percabangan dalam Proses Energi
✅ Glikogen dipecah oleh glikogen fosforilase → bekerja pada ikatan α(1→4) dari ujung non-pereduksi.
✅ Ketika glikogen fosforilase mendekati titik percabangan → enzim debranching enzyme akan:
-
Memindahkan fragmen rantai bercabang ke rantai utama.
-
Memutus ikatan α(1→6) → melepaskan glukosa bebas.
✅ Efeknya:
-
Penyediaan glukosa menjadi lebih cepat karena banyaknya titik akses.
-
Pelepasan energi cepat → mendukung aktivitas otot dan homeostasis glukosa darah.
7. Penyakit Terkait Metabolisme Glikogen
✅ Penyakit Pompe → Defisiensi enzim asam maltase → akumulasi glikogen di lisosom → menyebabkan kelemahan otot dan gagal jantung.
✅ Penyakit McArdle → Defisiensi glikogen fosforilase di otot → otot tidak dapat menggunakan glikogen untuk energi → menyebabkan kram otot saat aktivitas fisik.
✅ Hepatomegali (pembesaran hati) → Akumulasi glikogen akibat ketidakseimbangan aktivitas glikogen sintase dan glikogen fosforilase.
8. Regulasi Metabolisme Glikogen
🔹 Hormon pengatur utama:
-
Insulin → Merangsang glikogenesis → setelah makan → meningkatkan simpanan glikogen di hati dan otot.
-
Glukagon → Merangsang glikogenolisis → saat kadar glukosa darah menurun → meningkatkan pelepasan glukosa dari hati ke darah.
-
Adrenalin → Merangsang glikogenolisis di otot → menyediakan energi saat aktivitas fisik tinggi atau stres.
9. Kesimpulan
✅ Struktur glikogen terdiri dari ikatan α(1→4) dan ikatan percabangan α(1→6).
✅ Percabangan tinggi pada glikogen mempermudah aksesibilitas enzim → pelepasan glukosa lebih cepat.
✅ Regulasi metabolisme glikogen dikontrol oleh insulin, glukagon, dan adrenalin.
✅ Fungsi glikogen → sumber energi utama saat aktivitas fisik dan menjaga kadar glukosa darah.
✅ Gangguan metabolisme glikogen → dapat menyebabkan penyakit otot dan hati.
82 Syarah (Penjelasan) Slide ke-41
Slide ini menjelaskan tentang selulosa, yang merupakan salah satu polisakarida utama yang membentuk struktur pada dinding sel tumbuhan. Selulosa memiliki struktur unik yang memberikan kekuatan dan ketahanan terhadap degradasi oleh enzim pencernaan manusia.
1. Pengertian Selulosa
✅ Selulosa adalah polisakarida yang tersusun dari unit D-glukosa yang dihubungkan oleh ikatan β(1→4) glikosidik.
✅ Merupakan polisakarida struktural yang ditemukan dalam dinding sel tumbuhan → memberikan kekuatan mekanis dan kestabilan pada sel tumbuhan.
➡️ Selulosa merupakan komponen utama dari:
-
Dinding sel tumbuhan
-
Serat alami seperti kapas, linen, dan rami
-
Kayu dan produk berbasis kayu
➡️ Pada tumbuhan, selulosa membentuk sekitar 30–50% dari dinding sel.
2. Struktur Kimia Selulosa
✅ Selulosa adalah polimer linear yang tersusun dari unit D-glukosa dengan konfigurasi β pada posisi anomerik.
✅ Setiap residu D-glukosa dihubungkan oleh ikatan β(1→4) glikosidik.
✅ Konfigurasi β menghasilkan rantai lurus yang memungkinkan interaksi hidrogen antar-rantai → membentuk serat yang kuat dan tidak larut dalam air.
💡 Struktur dasar ikatan:
(C6H10O5)𝑛
➡️ Ikatan β(1→4) → menyebabkan molekul glukosa tersusun bergantian secara terbalik → membentuk rantai panjang yang lurus dan kaku.
➡️ Rantai selulosa saling berdekatan dan terhubung oleh ikatan hidrogen antar-rantai → membentuk mikrofibril → memperkuat struktur dinding sel.
3. Sifat Fisik dan Kimia Selulosa
✅ Tidak bercabang → karena semua glukosa dihubungkan oleh ikatan β(1→4).
✅ Tidak larut dalam air → akibat interaksi hidrogen yang kuat antar-rantai glukosa.
✅ Resisten terhadap degradasi enzim → sebagian besar enzim pencernaan manusia seperti amilase tidak dapat memecah ikatan β(1→4).
➡️ Enzim selulase (yang dimiliki oleh bakteri atau hewan pemamah biak seperti sapi) → mampu memecah ikatan β(1→4) menjadi glukosa.
➡️ Manusia tidak memiliki enzim selulase → selulosa berfungsi sebagai serat makanan (dietary fiber) → meningkatkan pergerakan usus dan pencernaan.
4. Ikatan β(1→4) Gikosidik pada Selulosa
✅ Konfigurasi β menyebabkan setiap unit glukosa berorientasi terbalik dibandingkan unit sebelumnya → membentuk rantai lurus yang kaku.
✅ Rantai-rantai selulosa berdekatan → membentuk mikrofibril yang stabil melalui ikatan hidrogen:
-
Ikatan intramolekuler → antara gugus hidroksil dalam rantai selulosa yang sama.
-
Ikatan intermolekuler → antara gugus hidroksil pada rantai selulosa yang berdekatan → membentuk struktur serat yang sangat kuat.
💡 Efek struktur β(1→4):
-
Memberikan kekuatan tarik → tahan terhadap tekanan mekanis.
-
Menjadikan selulosa tidak larut dalam air dan tahan terhadap enzim pencernaan manusia.
5. Fungsi Selulosa dalam Tumbuhan
✅ Sebagai komponen utama dinding sel → memberikan kekuatan mekanik pada sel tumbuhan.
✅ Membentuk mikrofibril → memperkuat struktur sel dan mempertahankan tekanan turgor pada sel tumbuhan.
✅ Mencegah perubahan bentuk sel → melindungi sel terhadap tekanan osmotik dan mekanik.
✅ Peningkatan ketahanan terhadap patogen → karena ikatan β(1→4) sulit dipecah oleh enzim patogen.
6. Selulosa dalam Makanan
✅ Selulosa adalah komponen utama serat makanan (dietary fiber):
-
Tidak dicerna di saluran pencernaan manusia → meningkatkan pergerakan usus.
-
Berfungsi sebagai bulk laxative → mempercepat pengeluaran sisa makanan melalui usus.
-
Membantu mengontrol kadar glukosa → memperlambat penyerapan glukosa ke dalam darah.
✅ Sumber utama selulosa dalam makanan:
-
Buah dan sayuran
-
Sereal utuh (whole grains)
-
Kacang-kacangan
-
Produk olahan gandum
💡 Efek fisiologis serat makanan:
-
Mengurangi risiko diabetes dan penyakit jantung.
-
Membantu menurunkan kolesterol.
-
Meningkatkan fungsi pencernaan → mencegah sembelit.
7. Perbedaan Selulosa, Amilosa, dan Amilopektin
| Properti | Selulosa | Amilosa | Amilopektin |
|---|---|---|---|
| Jenis Ikatan | β(1→4) | α(1→4) | α(1→4) dan α(1→6) |
| Percabangan | Tidak bercabang | Tidak bercabang | Bercabang |
| Struktur | Lurus dan kaku | Lurus | Bercabang |
| Fungsi | Struktural (dinding sel) | Cadangan energi | Cadangan energi |
| Dapat dicerna manusia | Tidak | Ya | Ya |
| Sifat Larut | Tidak larut | Larut sebagian | Larut sebagian |
8. Proses Degradasi Selulosa
✅ Selulosa dipecah oleh enzim selulase → dihasilkan oleh:
-
Bakteri dalam saluran pencernaan hewan ruminansia (sapi, kambing)
-
Mikroorganisme tanah
-
Serangga pemakan kayu (rayap)
✅ Hasil akhir:
-
Selobiosa → dipecah lebih lanjut menjadi glukosa oleh enzim β-glukosidase.
-
Glukosa → digunakan sebagai sumber energi oleh mikroorganisme dan hewan ruminansia.
9. Kegunaan Selulosa dalam Industri
✅ Pembuatan kertas → selulosa dari kayu atau serat tumbuhan.
✅ Industri tekstil → serat kapas → hampir 100% selulosa.
✅ Pembuatan plastik selulosa (selofan, nitroselulosa).
✅ Industri farmasi → selulosa mikrokristalin → sebagai bahan pengikat tablet.
✅ Pembuatan bioetanol → selulosa dipecah menjadi glukosa → difermentasi menjadi etanol.
10. Kesimpulan
✅ Selulosa adalah polisakarida utama dalam dinding sel tumbuhan yang berperan dalam memberikan kekuatan struktural.
✅ Ikatan β(1→4) glikosidik menyebabkan selulosa memiliki struktur kaku dan tidak bercabang.
✅ Selulosa tidak larut dalam air dan tidak dapat dicerna oleh manusia karena manusia tidak memiliki enzim selulase.
✅ Selulosa merupakan serat makanan → meningkatkan kesehatan pencernaan dan menurunkan risiko penyakit metabolik.
✅ Struktur serat yang kuat memungkinkan penggunaan selulosa dalam industri kertas, tekstil, dan plastik.
84 Syarah (Penjelasan) Slide ke-42
Slide ini membahas tentang ketidakmampuan manusia dalam mencerna selulosa, serta kemampuan organisme lain seperti rayap dan hewan ruminansia dalam memecah selulosa menggunakan enzim selulase.
1. Hidrolisis Selulosa oleh Enzim
✅ Selulosa tidak dapat dihidrolisis oleh enzim α-amilase yang terdapat di saluran pencernaan manusia.
✅ Hal ini disebabkan oleh perbedaan konfigurasi ikatan glikosidik:
-
Amilase hanya dapat memecah ikatan α(1→4) glikosidik pada pati dan glikogen.
-
Selulosa memiliki ikatan β(1→4) glikosidik → tidak dapat dipecah oleh enzim α-amilase.
💡 α-amilase adalah enzim utama dalam proses pencernaan pati → ditemukan dalam saliva dan pankreas → berperan dalam memecah pati menjadi maltosa dan glukosa.
💡 Karena ikatan β(1→4) pada selulosa → enzim amilase tidak dapat mengenali dan memecah struktur selulosa.
2. Pencernaan Selulosa pada Rayap (Trichonympha)
✅ Rayap memiliki protozoa simbiotik dalam saluran pencernaannya → Trichonympha → menghasilkan enzim selulase.
✅ Enzim selulase pada rayap mampu:
-
Menghidrolisis ikatan β(1→4) glikosidik → memecah selulosa menjadi selobiosa.
-
Selobiosa → dipecah lebih lanjut menjadi D-glukosa oleh enzim β-glukosidase.
-
Glukosa → digunakan sebagai sumber energi oleh rayap dan protozoa simbiotiknya.
💡 Proses ini memungkinkan rayap untuk mendapatkan nutrisi dari kayu dan serat tumbuhan yang kaya akan selulosa.
3. Pencernaan Selulosa pada Hewan Ruminansia (Contoh: Sapi)
✅ Hewan ruminansia seperti sapi memiliki kemampuan untuk mencerna selulosa melalui:
-
Kehadiran mikroba rumen seperti bakteri selulolitik, protozoa, dan fungi dalam rumen.
-
Mikroba ini menghasilkan enzim selulase → memecah ikatan β(1→4) glikosidik pada selulosa menjadi selobiosa dan kemudian menjadi glukosa.
✅ Proses fermentasi dalam rumen → menghasilkan:
-
Asam lemak rantai pendek → seperti asam asetat, propionat, dan butirat → diserap oleh epitel rumen → digunakan sebagai sumber energi.
-
Karbon dioksida (CO₂) dan metana (CH₄) → dikeluarkan melalui proses eruktasi (sendawa) → berperan dalam efek gas rumah kaca.
-
Glukosa → diserap dalam bentuk metabolit hasil fermentasi → dimanfaatkan untuk sintesis energi (ATP).
💡 Proses fermentasi ini terjadi di dalam rumen, yaitu lambung pertama hewan ruminansia, yang berisi populasi mikroba simbiotik.
💡 Bakteri utama yang berperan dalam pemecahan selulosa:
-
Ruminococcus flavefaciens
-
Fibrobacter succinogenes
-
Butyrivibrio fibrisolvens
4. Reaksi Hidrolisis Selulosa pada Ruminansia
✅ Proses:
Selulosa→SelulaseSelobiosa→β-glukosidaseGlukosa\text{Selulosa} \xrightarrow{\text{Selulase}} \text{Selobiosa} \xrightarrow{\beta\text{-glukosidase}} \text{Glukosa}SelulosaSelulaseSelobiosaβ-glukosidaseGlukosa
✅ Glukosa hasil pemecahan selulosa akan difermentasi menjadi:
-
Asam asetat (C₂) → 65%
-
Asam propionat (C₃) → 20%
-
Asam butirat (C₄) → 15%
✅ Produk akhir:
-
Energi metabolik → dari hasil fermentasi asam lemak.
-
Gas CO₂ dan CH₄ → hasil sampingan dari aktivitas mikroba dalam rumen.
-
Produk metabolit → digunakan untuk sintesis protein dan lemak susu pada sapi perah.
5. Perbandingan Pencernaan Selulosa pada Manusia dan Hewan
| Organisme | Enzim Pemecah Selulosa | Produk Akhir | Efektivitas Pencernaan |
|---|---|---|---|
| Manusia | Tidak memiliki enzim selulase | Tidak ada | Tidak dapat mencerna selulosa |
| Rayap | Protozoa Trichonympha → selulase | Glukosa | Efektif (sebagai sumber energi utama) |
| Sapi (Ruminansia) | Mikroba rumen → selulase | Asam lemak rantai pendek, CO₂, CH₄ | Sangat efektif |
6. Produk Fermentasi Selulosa pada Hewan Ruminansia
✅ Asam asetat → digunakan sebagai bahan dasar untuk sintesis lemak tubuh dan lemak susu.
✅ Asam propionat → digunakan sebagai prekursor untuk sintesis glukosa melalui glukoneogenesis di hati.
✅ Asam butirat → diubah menjadi β-hydroxybutyrate → digunakan sebagai sumber energi langsung oleh jaringan tubuh.
✅ CO₂ dan CH₄ → dilepaskan melalui sendawa → berperan dalam kontribusi gas rumah kaca.
7. Implikasi Ekologi dan Lingkungan
✅ Produksi metana (CH₄) oleh hewan ruminansia → berkontribusi terhadap efek gas rumah kaca.
✅ Estimasi:
-
Sapi → melepaskan sekitar 100–200 liter CH₄ per hari.
-
Gas metana → memiliki potensi pemanasan global 25 kali lebih besar daripada CO₂ dalam jangka waktu 100 tahun.
✅ Upaya untuk mengurangi produksi metana pada hewan ruminansia:
-
Modifikasi pakan → menambahkan minyak nabati → menghambat aktivitas metanogen dalam rumen.
-
Menambah senyawa penghambat enzim metanogen → seperti 3-nitrooxypropanol (3-NOP).
-
Meningkatkan kualitas pakan → mempercepat fermentasi dan menurunkan produksi metana.
8. Kesimpulan
✅ Manusia tidak dapat mencerna selulosa karena tidak memiliki enzim selulase.
✅ Rayap dan hewan ruminansia mampu mencerna selulosa karena memiliki mikroorganisme simbiotik yang menghasilkan enzim selulase.
✅ Produk akhir pencernaan selulosa pada hewan ruminansia berupa asam lemak rantai pendek, yang menjadi sumber energi utama bagi hewan tersebut.
✅ Produk fermentasi berupa metana → berperan dalam kontribusi terhadap efek gas rumah kaca → tantangan dalam sektor peternakan global.
86 Syarah (Penjelasan) Slide ke-43
Slide ini menunjukkan struktur selulosa dalam bentuk susunan molekul glukosa yang terhubung dengan ikatan β(1→4) glikosidik. Slide ini juga menyoroti pola interaksi antar molekul melalui ikatan hidrogen yang menghasilkan struktur yang kuat dan tidak larut dalam air.
1. Struktur Selulosa
✅ Selulosa adalah polisakarida yang tersusun dari rantai panjang molekul D-glukosa yang dihubungkan oleh ikatan β(1→4) glikosidik.
✅ Ikatan β(1→4) glikosidik menghasilkan rantai molekul yang lurus dan kaku, yang memungkinkan molekul selulosa untuk:
-
Membentuk ikatan hidrogen intra- dan intermolekuler.
-
Menyusun struktur mikrofibril yang kuat dan tidak mudah larut dalam air.
➡️ Reaksi Polimerisasi Selulosa
n (Glukosa)→β(1→4) glikosidikSelulosa\text{n} \, \text{(Glukosa)} \xrightarrow{\beta(1\rightarrow4) \, \text{glikosidik}} \text{Selulosa}n(Glukosa)β(1→4)glikosidikSelulosa
💡 Rantai selulosa terdiri dari 10.000 hingga 15.000 unit glukosa yang membentuk rantai panjang.
2. Ikatan β(1→4) Glikosidik
✅ Ikatan β(1→4) glikosidik membuat selulosa tidak dapat dipecah oleh enzim α-amilase → karena enzim α-amilase hanya dapat memecah ikatan α(1→4) glikosidik.
✅ Struktur β(1→4) memungkinkan pembentukan:
-
Ikatan hidrogen intramolekuler → mempertahankan struktur rantai.
-
Ikatan hidrogen intermolekuler → membentuk susunan paralel dan menciptakan serat yang kuat.
3. Struktur Supramolekuler Selulosa
✅ Struktur selulosa terdiri dari susunan mikrofibril yang tersusun dalam:
-
Rantai linear → ditahan oleh ikatan hidrogen intramolekuler.
-
Tumpukan paralel → diperkuat oleh ikatan hidrogen intermolekuler.
✅ Ikatan hidrogen menghasilkan struktur kristalin yang tidak mudah ditembus oleh air atau enzim.
💡 Pola ikatan hidrogen ini menyebabkan:
-
Ketidaklarutan selulosa dalam air → karena molekul air tidak mampu memutus ikatan hidrogen dalam struktur selulosa.
-
Ketahanan mekanik tinggi → selulosa menjadi komponen utama dalam dinding sel tumbuhan.
4. Perbedaan Selulosa dengan Amilosa dan Amilopektin
| Polisakarida | Monomer | Ikatan Glikosidik | Percabangan | Sifat Larut |
|---|---|---|---|---|
| Selulosa | β-D-Glukosa | β(1→4) | Tidak ada | Tidak larut dalam air |
| Amilosa | α-D-Glukosa | α(1→4) | Tidak ada | Larut dalam air (sebagian) |
| Amilopektin | α-D-Glukosa | α(1→4), α(1→6) | Ada | Larut dalam air |
➡️ Struktur selulosa yang tidak bercabang dan memiliki ikatan β(1→4) menyebabkan susunan molekul yang lebih rapat dan stabil dibandingkan pati (amilosa dan amilopektin).
➡️ Hal ini menyebabkan selulosa tidak mudah terurai oleh enzim pencernaan manusia.
5. Peran Selulosa di Alam
✅ Sebagai Komponen Dinding Sel
-
Selulosa membentuk dinding sel tumbuhan → memberikan kekuatan mekanik dan ketahanan struktural.
-
Struktur selulosa yang rapat dan berserat → berperan dalam perlindungan sel dan pengangkutan air di jaringan tumbuhan.
✅ Sebagai Bahan Dasar untuk Kertas dan Kapas
-
Kertas → dibuat dari pulp kayu yang kaya akan selulosa.
-
Kapas → mengandung hingga 90% selulosa → memberikan tekstur yang kuat dan elastis.
✅ Sebagai Sumber Pangan untuk Herbivora dan Rayap
-
Herbivora (seperti sapi) → mampu mencerna selulosa dengan bantuan mikroba rumen yang menghasilkan enzim selulase.
-
Rayap → mampu mencerna selulosa melalui aktivitas mikroba simbiotik dalam saluran pencernaannya.
6. Kristalinitas Selulosa
✅ Selulosa memiliki daerah:
-
Kristalin → susunan molekul yang teratur → sulit terurai.
-
Amorf → susunan molekul yang tidak teratur → lebih mudah dihidrolisis oleh enzim selulase.
💡 Selulosa mikro-kristalin → digunakan dalam industri makanan dan farmasi sebagai pengental dan pengisi tablet karena sifatnya yang tidak larut.
7. Kesimpulan
✅ Selulosa adalah polisakarida utama pada dinding sel tumbuhan → memberikan kekuatan mekanis dan ketahanan struktural.
✅ Ikatan β(1→4) glikosidik membuat selulosa tidak dapat dicerna oleh manusia, tetapi dapat dipecah oleh mikroba tertentu yang memiliki enzim selulase.
✅ Sifat kristalin dan pola ikatan hidrogen yang kompleks menyebabkan selulosa tidak larut dalam air dan memiliki ketahanan mekanis tinggi.
✅ Selulosa memainkan peran penting dalam ekologi, industri, dan bioteknologi karena ketahanannya yang luar biasa dan sifat strukturalnya yang stabil.
88 Syarah (Penjelasan) Slide ke-44
Slide ini menampilkan perbedaan utama antara struktur pati (starch) dan selulosa (cellulose) berdasarkan jenis ikatan glikosidik yang terbentuk di antara residu glukosa. Perbedaan ini menghasilkan sifat fisik dan kimia yang sangat berbeda di antara keduanya.
1. Struktur Kimia Pati dan Selulosa
✅ Pati (Starch)
-
Pati adalah polisakarida yang tersusun dari monomer glukosa yang dihubungkan dengan ikatan α(1→4) glikosidik.
-
Ikatan α(1→4) menciptakan struktur rantai yang melengkung dan cenderung membentuk spiral.
-
Pati adalah polisakarida penyimpanan utama dalam tanaman → berfungsi sebagai cadangan energi.
✅ Selulosa (Cellulose)
-
Selulosa adalah polisakarida struktural yang tersusun dari monomer glukosa yang dihubungkan dengan ikatan β(1→4) glikosidik.
-
Ikatan β(1→4) menciptakan struktur rantai yang lurus dan memungkinkan pembentukan ikatan hidrogen antar rantai → menciptakan serat yang kuat dan stabil.
-
Selulosa merupakan komponen utama dinding sel tumbuhan → memberikan kekuatan mekanis dan ketahanan struktural.
2. Perbedaan Ikatan Glikosidik
| Polisakarida | Ikatan Glikosidik | Bentuk Rantai | Sifat Fisik |
|---|---|---|---|
| Pati | α(1→4) dan α(1→6) | Melengkung, membentuk spiral | Larut sebagian dalam air, mudah dicerna |
| Selulosa | β(1→4) | Lurus, membentuk serat | Tidak larut dalam air, sulit dicerna |
➡️ Ikatan α(1→4) pada pati menghasilkan struktur yang fleksibel dan dapat dicerna oleh enzim α-amilase.
➡️ Ikatan β(1→4) pada selulosa menghasilkan struktur yang kaku dan tahan terhadap degradasi oleh enzim pencernaan manusia.
3. Perbedaan Fungsi Biologis
✅ Pati
-
Berfungsi sebagai cadangan energi dalam tumbuhan.
-
Disimpan dalam plastid (amiloplas) → dipecah menjadi glukosa saat energi dibutuhkan.
-
Mudah dihidrolisis oleh enzim α-amilase menjadi maltosa dan glukosa.
✅ Selulosa
-
Berfungsi sebagai struktur utama dinding sel tumbuhan.
-
Memberikan kekuatan mekanik dan ketahanan struktural.
-
Tidak dapat dicerna oleh manusia → karena enzim α-amilase tidak dapat memecah ikatan β(1→4).
-
Dapat dicerna oleh:
-
Hewan ruminansia (seperti sapi) → dengan bantuan mikroba yang menghasilkan enzim selulase.
-
Rayap → melalui aktivitas mikroba simbiotik dalam sistem pencernaannya.
-
4. Implikasi Struktural
🔹 Pati → struktur melingkar dan bercabang → mudah terurai → sebagai cadangan energi.
🔹 Selulosa → struktur linear dan tidak bercabang → membentuk serat → sebagai komponen struktural.
💡 Perbedaan bentuk ini diakibatkan oleh posisi ikatan glikosidik:
-
Ikatan α(1→4) menciptakan lengkungan → menghasilkan struktur yang fleksibel dan mudah terurai.
-
Ikatan β(1→4) menciptakan rantai lurus → menghasilkan struktur yang kaku dan tidak mudah terurai.
5. Relevansi Biologis dan Industri
✅ Pati → sebagai sumber utama energi dalam makanan (nasi, kentang, jagung).
✅ Selulosa → digunakan dalam industri kertas, tekstil (kapas), dan bahan bangunan.
✅ Hidrolisis Pati → menghasilkan maltosa dan glukosa → dapat dimanfaatkan dalam produksi bioetanol.
✅ Hidrolisis Selulosa → sulit dilakukan → memerlukan enzim selulase yang dihasilkan oleh mikroorganisme tertentu.
6. Kesimpulan
✅ Ikatan α(1→4) dan β(1→4) memiliki dampak struktural yang besar:
-
Ikatan α(1→4) → menghasilkan struktur fleksibel → mudah dicerna dan digunakan sebagai energi.
-
Ikatan β(1→4) → menghasilkan struktur kaku dan tahan → berfungsi sebagai penyokong struktural dalam sel tumbuhan.
✅ Perbedaan struktur antara pati dan selulosa menentukan fungsi biologis dan sifat fisiknya dalam organisme.
✅ Oleh karena itu, pati digunakan sebagai sumber energi, sedangkan selulosa digunakan sebagai komponen struktural.
90 Syarah (Penjelasan) Slide ke-45
Slide ini menjelaskan fungsi utama polisakarida dalam sistem biologis, yaitu sebagai penyimpan energi dan unsur struktural dalam sel dan jaringan pengikat. Polisakarida adalah karbohidrat kompleks yang tersusun dari banyak monomer monosakarida yang dihubungkan oleh ikatan glikosidik.
1. Fungsi Polisakarida Sebagai Penyimpan Energi
✅ Penyimpanan Energi dalam Sel
Polisakarida yang berperan dalam penyimpanan energi tersusun dari glukosa dan memiliki struktur bercabang atau tidak bercabang. Polisakarida ini dapat dengan mudah dipecah kembali menjadi glukosa untuk kebutuhan metabolisme.
➡️ Pati (starch) → pada tumbuhan
➡️ Glikogen → pada hewan dan manusia
▶️ Pati (Starch)
-
Pati adalah polisakarida utama dalam tumbuhan yang berfungsi sebagai cadangan energi.
-
Pati tersusun dari:
-
Amilosa → rantai lurus α(1→4)
-
Amilopektin → rantai bercabang dengan ikatan α(1→4) dan cabang α(1→6)
-
-
Disimpan di organ penyimpanan seperti biji, akar, dan umbi.
-
Mudah dicerna oleh enzim amilase menjadi maltosa dan glukosa.
▶️ Glikogen
-
Glikogen adalah polisakarida utama dalam hewan yang disimpan di hati dan otot.
-
Tersusun dari monomer glukosa dengan ikatan α(1→4) dan percabangan pada α(1→6).
-
Glikogen dapat dengan cepat dipecah menjadi glukosa saat dibutuhkan untuk energi melalui proses glikogenolisis.
-
Sifat percabangan glikogen yang lebih banyak dibanding amilopektin memungkinkan penyimpanan energi yang lebih efisien dan penguraian energi yang lebih cepat.
▶️ Fruktan (Inulin)
-
Inulin adalah polisakarida yang tersusun dari unit fruktosa yang terhubung oleh ikatan β(2→1).
-
Digunakan sebagai cadangan energi dalam beberapa tumbuhan (contohnya: bawang dan dahlia).
-
Inulin sulit dicerna oleh tubuh manusia, tetapi berfungsi sebagai prebiotik (makanan untuk bakteri baik di usus).
2. Fungsi Polisakarida sebagai Unsur Struktural
✅ Struktur Sel dan Jaringan Pengikat
Polisakarida yang berperan sebagai komponen struktural memiliki ikatan β yang kuat dan membentuk serat yang tidak mudah larut dalam air.
➡️ Selulosa → pada dinding sel tumbuhan
➡️ Kitin → pada eksoskeleton serangga dan dinding sel jamur
➡️ Pektin → pada dinding sel tumbuhan
▶️ Selulosa
-
Polisakarida utama dalam dinding sel tumbuhan.
-
Tersusun dari glukosa dengan ikatan β(1→4) → membentuk rantai lurus yang tersusun dalam bentuk lembaran paralel.
-
Ikatan hidrogen antar rantai selulosa memberikan kekuatan dan ketahanan struktural pada dinding sel.
-
Tidak dapat dicerna oleh manusia karena tubuh manusia tidak memiliki enzim selulase.
▶️ Kitin
-
Tersusun dari N-asetilglukosamin (GlcNAc) dengan ikatan β(1→4).
-
Komponen utama dari eksoskeleton serangga, krustasea, dan dinding sel jamur.
-
Bersifat keras dan kuat karena adanya interaksi antar rantai melalui ikatan hidrogen.
▶️ Pektin
-
Polisakarida utama dalam dinding sel tumbuhan → menyusun lamela tengah pada sel tumbuhan.
-
Terdiri dari asam galakturonat yang dihubungkan oleh ikatan α(1→4).
-
Berfungsi dalam proses pertumbuhan sel dan adhesi antar sel.
-
Pektin larut dalam air → dapat digunakan dalam pembuatan gel (seperti selai).
3. Perbedaan Fungsi Polisakarida Berdasarkan Struktur
| Jenis Polisakarida | Peran | Ikatan | Contoh |
|---|---|---|---|
| Pati (Starch) | Penyimpanan energi | α(1→4) dan α(1→6) | Amilosa, amilopektin |
| Glikogen | Penyimpanan energi | α(1→4) dan α(1→6) | Glikogen di hati dan otot |
| Selulosa | Struktur sel | β(1→4) | Dinding sel tumbuhan |
| Kitin | Struktur luar (kerangka) | β(1→4) | Eksoskeleton serangga |
| Pektin | Perekat antar sel | α(1→4) | Dinding sel tumbuhan |
4. Implikasi Biologis
✅ Pati dan glikogen → mudah terurai → berperan dalam metabolisme energi.
✅ Selulosa dan kitin → kuat dan kaku → berperan dalam perlindungan dan ketahanan sel.
✅ Pektin → memungkinkan perekat antar sel → berperan dalam pembentukan jaringan tumbuhan.
5. Kesimpulan
➡️ Polisakarida dengan ikatan α → fleksibel dan mudah dicerna → berperan dalam penyimpanan energi.
➡️ Polisakarida dengan ikatan β → kaku dan kuat → berperan dalam struktur sel.
➡️ Polisakarida berperan penting dalam fungsi metabolisme (penyimpanan energi) dan struktur sel (komponen pelindung dan penguat).
92 Syarah (Penjelasan) Slide ke-46
Slide ini menjelaskan klasifikasi polisakarida berdasarkan komposisi monomer yang menyusunnya. Polisakarida merupakan polimer yang tersusun dari monosakarida yang dihubungkan oleh ikatan glikosidik. Berdasarkan jenis monomer yang menyusunnya, polisakarida dibagi menjadi dua kategori utama: homopolisakarida dan heteropolisakarida.
1. Homopolisakarida
✅ Definisi
Homopolisakarida adalah polisakarida yang tersusun dari satu jenis monomer yang berulang.
➡️ Semua unit penyusunnya berasal dari jenis monosakarida yang sama (misalnya hanya glukosa atau hanya fruktosa).
✅ Contoh Homopolisakarida
▶️ Pati (Starch)
-
Tersusun dari unit D-glukosa yang dihubungkan oleh ikatan α(1→4) dan percabangan α(1→6).
-
Berfungsi sebagai cadangan energi pada tumbuhan.
-
Komponen utama:
-
Amilosa → rantai lurus
-
Amilopektin → rantai bercabang
-
▶️ Glikogen
-
Polimer D-glukosa yang dihubungkan oleh ikatan α(1→4) dan percabangan α(1→6).
-
Struktur lebih bercabang dibandingkan amilopektin.
-
Berfungsi sebagai cadangan energi pada hewan dan manusia (di simpan di hati dan otot).
▶️ Selulosa
-
Tersusun dari unit D-glukosa yang dihubungkan oleh ikatan β(1→4).
-
Struktur linear dan membentuk serat yang kuat karena adanya ikatan hidrogen antar rantai.
-
Berperan sebagai komponen struktural pada dinding sel tumbuhan.
▶️ Kitin
-
Homopolisakarida yang tersusun dari N-asetilglukosamin (GlcNAc) yang dihubungkan oleh ikatan β(1→4).
-
Merupakan komponen utama eksoskeleton pada serangga dan krustasea.
✅ Ciri-Ciri Homopolisakarida
-
Hanya terdiri dari satu jenis monomer (misalnya glukosa atau fruktosa).
-
Bisa bersifat linear atau bercabang tergantung pada jenis ikatan glikosidiknya.
-
Fungsi:
-
Penyimpanan energi → pati dan glikogen
-
Struktur → selulosa dan kitin
-
2. Heteropolisakarida
✅ Definisi
Heteropolisakarida adalah polisakarida yang tersusun dari dua jenis atau lebih monomer yang berbeda.
➡️ Kombinasi unit monosakarida yang berbeda (misalnya glukosa + galaktosa + asam uronat).
➡️ Berperan dalam struktur jaringan dan matriks ekstraseluler.
✅ Contoh Heteropolisakarida
▶️ Asam Hialuronat
-
Terdiri dari unit berulang asam glukuronat dan N-asetilglukosamin.
-
Merupakan komponen utama dari jaringan ikat, cairan sinovial, dan vitreous humor (mata).
-
Memberikan sifat pelumas dan peredam goncangan dalam jaringan tubuh.
▶️ Heparin
-
Tersusun dari unit berulang asam glukuronat dan glukosamin.
-
Berfungsi sebagai antikoagulan alami dalam darah (mencegah pembekuan darah).
▶️ Pektin
-
Tersusun dari asam galakturonat dan ramnosa.
-
Berperan dalam dinding sel tumbuhan untuk mempertahankan kekuatan jaringan.
▶️ Agarosa
-
Polimer dari galaktosa dan 3,6-anhidrogalaktosa.
-
Digunakan dalam bioteknologi sebagai media gel untuk elektroforesis dan kultur mikroorganisme.
✅ Ciri-Ciri Heteropolisakarida
-
Terdiri dari lebih dari satu jenis monomer (misalnya glukosa + galaktosa).
-
Umumnya bersifat kompleks dan berperan dalam struktur dan fisiologi sel.
-
Fungsi:
-
Sebagai pelumas (asam hialuronat).
-
Sebagai antikoagulan (heparin).
-
Sebagai penyusun dinding sel tumbuhan (pektin).
-
3. Perbedaan Homopolisakarida dan Heteropolisakarida
| Kategori | Jenis Monomer | Contoh | Fungsi |
|---|---|---|---|
| Homopolisakarida | Satu jenis monosakarida | Pati, glikogen, selulosa, kitin | Penyimpanan energi, struktur |
| Heteropolisakarida | Dua atau lebih jenis monosakarida | Asam hialuronat, heparin, pektin | Pelumas, antikoagulan, matriks ekstraseluler |
4. Implikasi Biologis
✅ Homopolisakarida
-
Berperan dalam penyimpanan energi → pati dan glikogen.
-
Berperan dalam struktur sel → selulosa dan kitin.
✅ Heteropolisakarida
-
Berperan dalam struktur jaringan ikat → asam hialuronat dan pektin.
-
Berperan dalam pengaturan fisiologis → heparin sebagai antikoagulan.
-
Berperan dalam pengisian ruang antar sel → asam hialuronat.
5. Kesimpulan
➡️ Homopolisakarida terdiri dari satu jenis monomer → terutama berperan dalam penyimpanan energi dan struktur sel.
➡️ Heteropolisakarida terdiri dari dua atau lebih jenis monomer → berperan dalam struktur jaringan ikat, pengaturan fisiologis, dan matriks sel.
➡️ Kedua jenis polisakarida memiliki peran biologis yang saling melengkapi dalam sistem metabolisme dan struktur sel.
94 Syarah (Penjelasan) Slide ke-47
Terima kasih atas efforts rekan-rekan sekalian untuk mempelajari slide ini wa jazakumullahu khairan katsiiro